博纳吐单抗治疗急性B 淋巴细胞白血病的回顾性研究*
陆佳玲 黄慧娟 陈妍心 何哲炜 李蒙娜 马骁②③④ 吴德沛②③④
急性淋巴细胞白血病患者预后不佳,传统方案是以VDP、VDLCP、hyper-CVAD 为主的诱导化疗[1-2],其缓解率较低,同时因原发耐药、化疗不良反应等原因限制了治疗方案的选择[3]。近年来在传统化疗联合免疫治疗下,初治急性B 淋巴细胞白血病(B-cell acute lymphoblastic leukemia,B-ALL)的缓解率较前改善,但长期生存率仅30%~50%,复发难治性BALL(relapsed and refractory B-cell acute lymphoblastic leukemia,R/R B-ALL)患者预后更差,总生存期(overall survival,OS)仅为2~8 个月,5 年OS 率低于10%[4-5]。因此,开发新药改善B-ALL 患者生存受到广泛重视。博纳吐单抗是目前国内首个批准用于治疗血液恶性肿瘤的双特异性抗体,以CD19、CD3 为靶点,诱导细胞毒性T 淋巴细胞裂解CD19 阳性B 淋巴细胞。临床研究证实博纳吐单抗可明显提高BALL 缓解率,改善生存期,且耐受性良好,已被美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)、日本厚生劳动省(MHLW)以及中国国家药品监督管理局(NMPA)批准用于治疗成人和儿童R/R B-ALL、微小残留病(minimal residual disease,MRD)阳性的BALL。本研究对21 例应用博纳吐单抗治疗的BALL 患者进行回顾性分析,探讨其临床疗效和安全性。
1 材料与方法
1.1 临床资料
本研究纳入2021 年8 月至2022 年4 月于苏州大学附属第一医院及苏州弘慈血液病医院接受博纳吐单抗治疗的21 例B-ALL 患者,其中男性10 例,女性11 例,中位年龄44(22~64)岁。11 例血液学未缓解(non-remission,NR),14 例MRD 阳性,包括11 例NR 和3 例完全缓解(complete response,CR)/CR 伴血液学不完全恢复(CR with incomplete hematological recovery,CRi)且MRD 阳性,7 例化疗或移植后MRD 阴性B-ALL。B-ALL 的诊断符合2016 版世界卫生组织(WHO)造血和淋巴组织肿瘤的分型诊断标准[6],所有患者经MICM 检查确诊,其中N/KRAS 突变4 例,PAX5 突变5 例,TP53 突变3 例(图1)。按照2021 美国国立综合癌症网络(NCCN)ALL 预后分层体系[7],分为预后良好组8 例(38.1%),预后不良组13 例(61.9%),见表1。
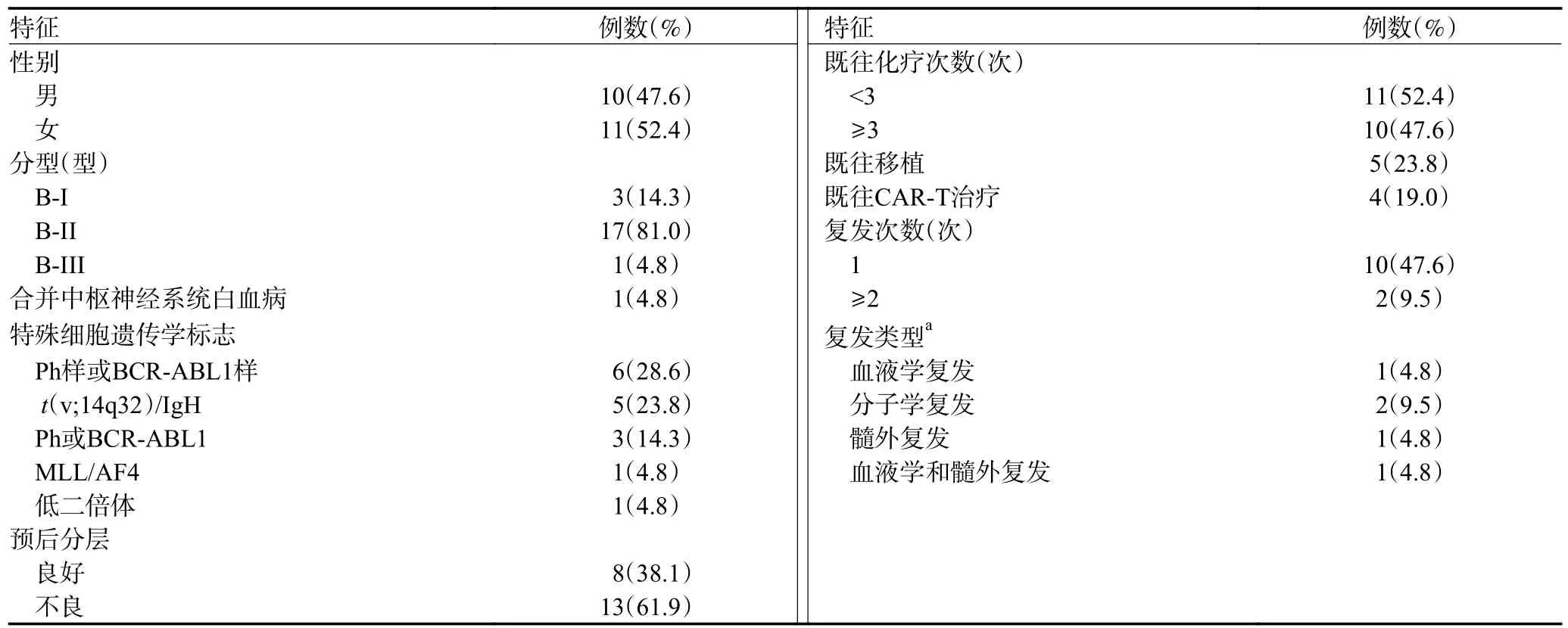
表1 21 例接受博纳吐单抗治疗B-ALL 患者的临床特征

图1 21 例急性B 淋巴细胞白血病患者基因突变情况及应用博纳吐单抗的疗效
1.2 方法
1.2.1 治疗方案 对于体质量超过45 kg 的患者,博纳吐单抗第1 个诱导周期9 μg/d,第1~7 天,28 μg/d,第8~28 天,停药14 天,第2 个诱导和巩固治疗周期28 μg/d,第1~28 天,停药14 天,维持治疗周期28 μg/d,第1~28 天,停药56 天,静脉输液。每个周期内第1 次给药前1 h、升高剂量前(如第1 周期第8 天)预先给予20 mg 地塞米松。博纳吐单抗具体用量根据骨髓抑制情况和不良事件相应调整,若减少剂量和对症治疗后,不良反应仍无法控制,则中断治疗。1 例体质量低于45 kg,以7 μg/d,第1~7 天,23 μg/d,第8~28 天用药。3 例用药开始时即存在持续粒细胞缺乏(粒缺),用药过程中因重度粒缺中断治疗。Ph 阳性B-ALL 患者以博纳吐单抗和酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)联合治疗,3 例Ph 阳性患者分别口服普纳替尼、达沙替尼、奥雷巴替尼,所有患者在1 个治疗周期结束后复查骨髓。5 例患者在博纳吐单抗治疗后桥接移植,均使用改良BU/CY 预处理方案。
1.2.2 评价标准 完全缓解(complete response,CR):白血病症状和体征消失,外周血无白血病细胞,骨髓原始细胞<5%,无髓外白血病且外周血ANC≥1.0×109/L,PLT≥100×109/L。CRi:外周血 ANC<1.0×109/L 或 PLT<100×109/L,其余满足CR 的标准。MRD 反应:使用流式细胞仪检测白血病细胞<1×10-4。MRD 转换:MRD阴性者在治疗后使用流式细胞仪检测白血病细胞≥1×10-4。总生存时间(overall survival,OS)为治疗开始至患者死亡或末次随访的时间。无白血病生存(leukemia-free survival,LFS)时间为从第1 次缓解至疾病复发或任何原因死亡的时间。无进展生存(progression-free survival,PFS)时间为治疗开始至疾病进展、复发、任何原因死亡或末次随访的时间。根据CTCAE 5.0 标准对不良事件进行报告和分级。
1.2.3 随访 随访以短信或电话方式随访,随访日期截至2022 年4 月。
1.3 统计学分析
采用SPSS 23.0 软件进行统计学分析。计数资料以百分比(%)表示,采用χ2检验;生存分析采用Kaplan-Meier 法,差异性检验采用Log-rank 法。检验水准α=0.05。以P<0.05 为差异具有统计学意义。
2 结果
2.1 疗效
中位随访5.1(1.3~8.3)个月,21 例急性B 细胞白血病患者接受博纳吐单抗治疗的中位周期数为1(1~3)个,11 例在治疗前血液学未缓解,3 例血液学缓解但分子学未缓解,7 例MRD 阴性。11 例复发难治性患者中,完全缓解/完全缓解伴血液学不完全恢复(CR/CRi)率为45.5%(4 例评效为CR,1 例评效为CRi),其中MRD 反应率为80.0%(4/5),3 例患者存在N/KRAS、TP53、NOTCH1、PAX5 突变,CR/CRi率均为33.3%(图1)。本研究发现预后良好组和不良组的CR 率分别为75.0%和28.6%,差异无统计学意义(P>0.05)。14 例分子学未缓解患者中,MRD 反应率为42.9%,其中3 例用药前CR/CRi 且MRD 阳性者全部出现MRD 反应。预后良好组和不良组的MRD 转阴率分别为66.7% 和37.5%,差异无统计学意义(P>0.05)。另外,博纳吐单抗作为一线挽救疗法或是后续挽救疗法、既往复发次数、后期桥接移植对CR 率、MRD 反应率差异均无统计学意义。7 例MRD阴性患者应用博纳吐单抗巩固治疗,4 例患者维持MRD 阴性,3 例在1 个疗程后发生MRD 转换,其中1 例患者4 个月后发生盆腔复发。
21 例患者6 个月OS、LFS 率分别为90.0%和55.0%,中位OS(median OS,mOS)、LFS 时间未达到(图2)。在CR/CRi(n=10)和NR(n=11)状态下进行博纳吐单抗治疗患者的6 个月LFS 率分别为80.0%和35.0%(P=0.021),在MRD 阳性和MRD 阴性状态下治疗的6 个月LFS 率分别为85.0% 和40.0%(P=0.038)。博纳吐单抗治疗后获得或维持CR/CRi、MRD 反应的患者有更长的生存期(6 个月OS:100%vs.60.0%,P=0.013;100%vs.76.0%,P=0.082)。
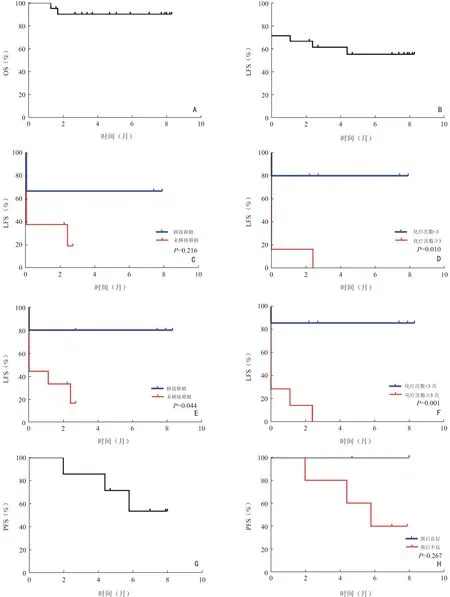
图2 Kaplan-Meier 曲线
11 例复发难治性B-ALL 患者中,mOS、LFS 未达到,6 个月OS 率、LFS 率分别为80.0%和34.0%。5 例患者经博纳吐单抗治疗后缓解,较未缓解者具有更长久的OS,6 个月OS 率分别为100.0% 和60.0%(P=0.151)。3 例患者接受异基因造血干细胞移植,桥接移植患者的OS 和LFS 较未桥接移植者持久,但差异未见明显统计学意义。14 例MRD 阳性患者的中位LFS 为1.75 个月,mOS 未达到。博纳吐单抗治疗后获得MRD 反应者OS 和LFS 更优益,6 个月OS分别为100.0%和68.0%(P=0.123),6 个月LFS 分别为68.0% 和14.0%(P=0.012)。桥接移植(n=5)与未移植(n=9)患者的6 个月OS 分别为100.0%和76.0%(P=0.260),2 个月LFS 分别为80.0% 和33.0%(P=0.044)。无论是复发难治性或MRD 阳性患者,既往化疗次数少于3 次者可获得更持久的无白血病生存期(P=0.010,P=0.001)。7 例MRD 阴性患者应用博纳吐单抗巩固治疗,中位PFS(median PFS,mPFS)未达到,6 个月PFS 为55%,预后良好组6 个月PFS 优于预后不良组,分别为100.0%和40.0%,但无显著性差异(P=0.267),见图2。
2.2 不良反应
截至2022 年4 月,19 例生存,2 例死亡,死亡原因为急性肝衰竭并发肝性脑病、感染性休克,均发生在博纳吐单抗治疗未缓解后行挽救化疗和CAR-T 治疗期间。所有患者均有血液学不良反应,其中19 例(90.5%)患者不良反应≥3 级。最常见的非血液学不良反应为细胞因子释放综合征(cytokine release syndrome,CRS)(57.1%)、肝功能损伤(57.1%)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)延长(57.1%)、低钾血症(42.9%)、神经系统症状(23.8%)。仅1 例CRS 3 级。神经系统症状多表现为头痛、外周神经痛、面部及四肢感觉异常。所有患者均未见输液反应和肿瘤溶解综合征。治疗相关的不良反应见表2。
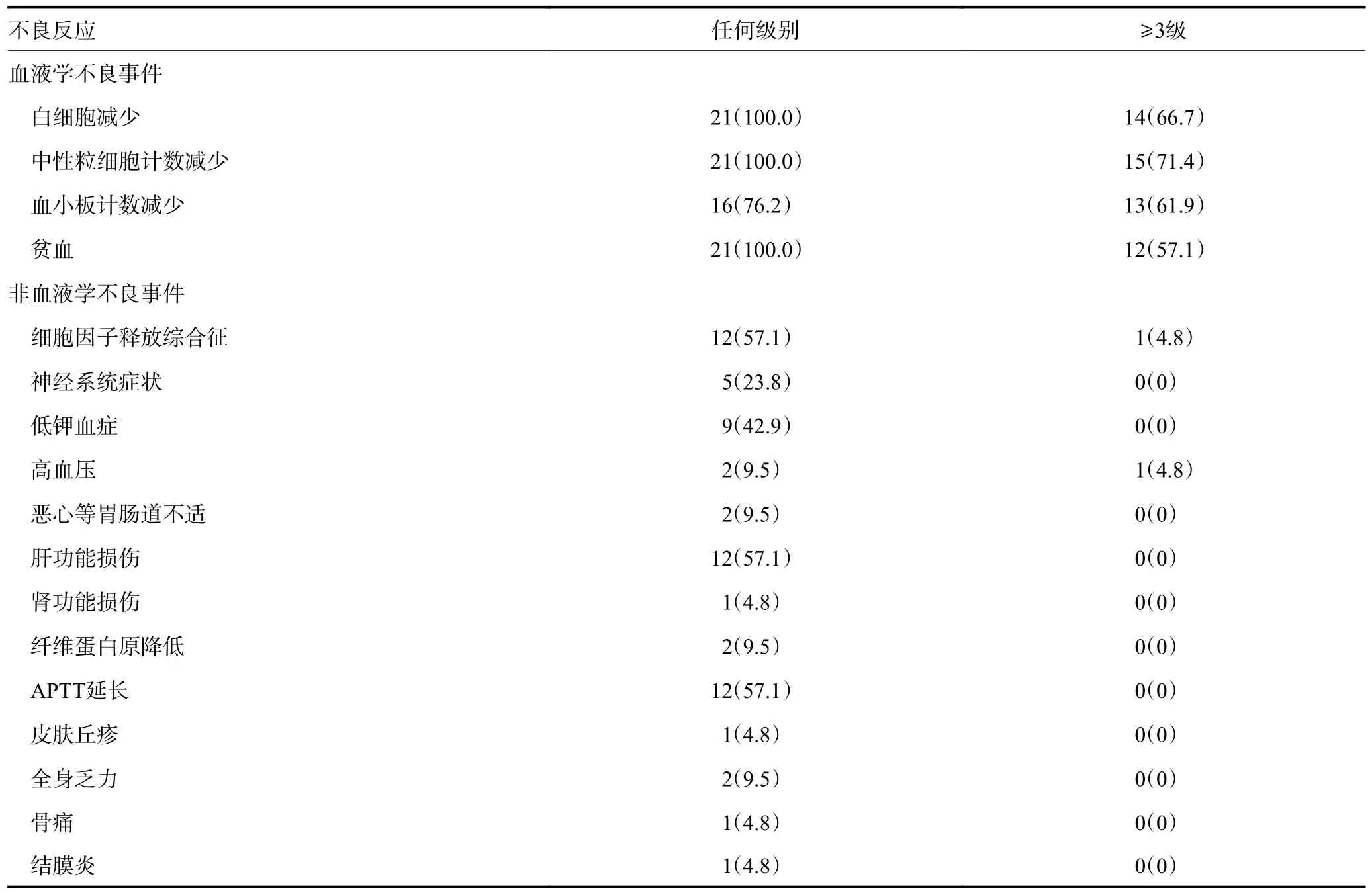
表2 接受博纳吐单抗治疗中出现的不良事件 例(%)
3 讨论
博纳吐单抗是首个CD19-CD3 双特异性抗体,是以CD19 为靶点开发的T 细胞衔接器蛋白,两个相连的单链可变片段分别通过连接T 细胞受体(TCR)复合物上的CD3 与B 细胞系来源的细胞上表达的CD19,将CD19 定向至CD3,激活内源性T 细胞,从而介导活化的T 细胞与肿瘤细胞间的突触形成、细胞黏附分子的上调、溶细胞蛋白的产生、炎性细胞因子的释放以及T 细胞增殖,发挥抗体介导的细胞毒作用,导致CD19+B 细胞裂解[8]。对于R/R ALL 患者,选择何种治疗方案从而提高患者生存时间一直是研究的重点。博纳吐单抗在治疗成人B-ALL 方面已有相关的单药临床试验,Topp 等[8]纳入189 例费城染色体阴性R/R B-ALL 患者,经过2 个周期博纳吐单抗治疗后43%获得完全缓解/完全缓解伴部分血液学恢复(complete response/complete response with partial hematological recovery,CR/CRh),中位无复发生存期(median relapse-free survival,mRFS)和mOS 分别为5.9 个月和6.1 个月。一项大样本Ⅲ期随机对照研究(TOWER)充分证实博纳吐单抗较传统化疗缓解率更高,完全缓解/完全缓解伴部分血液学恢复/完全缓解伴不完全血液学恢复(complete response/complete response with partial hematological recovery/complete response with incomplete hematological recovery,CR/CRh/CRi)为44%,而且缓解程度更深,MRD 反应率为76%,mOS 为7.7 个月,6 个月无事件生存期为31%[9]。对于R/R ALL 患者,提高MRD 缓解程度是一大挑战,本研究的R/R B-ALL 患者经博纳吐单抗治疗后CR/CRi 率与国外报道相似,获得CR/CRi 患者中MRD 反应率为80.0%,用药前血液学缓解且MRD阳性患者的反应率为100.0%,而Gökbuget 等[10-11]、Brown 等[12]在成人和青少年患者中分别获得78%和75%的MRD 反应率,虽然本研究中MRD 反应率更高,但样本量小,后期将扩大样本量进行评估。
高复发次数是B-ALL 预后的不良因素[13]。本研究中复发次数较少者有更好的OS(6 个月OS 分别为100.0%和70.0%)。本研究同时发现既往化疗次数对预后有影响,化疗次数少于3 次者较3 次及以上者拥有更长久的LFS。因此,早期进行博纳吐单抗干预尤为重要,不仅早期可获得缓解,而且能改善无白血病生存。
同种异体造血干细胞移植依然是R/R B-ALL 获得缓解的最成熟的方式,MRD 高水平是移植后复发的不利因素,降低MRD 水平以提高移植后生存至关重要。本研究中MRD 阳性患者桥接移植后OS、LFS较前显著提升。Aldoss 等[14]对B-ALL 患者移植前不同挽救疗法进行预后分析,分为联合化疗、博纳吐单抗、奥英妥珠单抗组,1 年RFS 分别为64.2%、61.2%和14.3%,博纳吐单抗桥接移植效果与化疗相似,但化疗不良反应减少,即使在严重感染期间,博纳吐单抗也能作为桥接移植的有效手段[15]。
B-ALL 患者在移植或传统化疗后可获得缓解,但复发风险很高,目前有前瞻性研究表明博纳吐单抗用于移植或化疗后巩固维持治疗可延长无病生存期。Gaballa 等[5]在23 例移植后B-ALL 患者中应用博纳吐单抗巩固治疗,1 年PFS 率为71%。Brown 等[12]在208 例中高危首次复发的年轻B-ALL 患者中进行的随机对照研究,患者在诱导化疗后接受博纳吐单抗和强化化疗进行巩固治疗,两组的2 年LFS 率分别为54.4%和39.0%(单侧P=0.03)。本研究中7 例经传统化疗或移植后获得MRD 阴性的患者应用博纳吐单抗巩固治疗,MRD 转化率为42.9%,6 个月PFS 率为55.0%,未观察到博纳吐单抗巩固治疗的长期效益,但随访时间短、样本量小,需后期随访评估。
在安全性方面,有研究表明R/R B-ALL 患者接受博纳吐单抗治疗时99% 均报道不良事件,其中87%为3 级及以上的不良事件,19%发生了致命的不良事件[9]。本研究中所有患者均出现任何等级的不良事件,3 级及以上不良事件发生率更高,主要为骨髓抑制,仅1 例3 级CRS,未出现致命性不良事件。
综上所述,本研究回顾性分析了21 例R/R、MRD阳性和MRD 阴性巩固治疗的B-ALL 患者应用博纳吐单抗的临床疗效以及安全性,结果显示博纳吐单抗治疗后血液学缓解率和分子学缓解率高,早期博纳吐单抗治疗和桥接移植的OS 和LFS 时间长,且严重不良反应少,有望成为挽救性治疗、桥接移植的可行选择之一。但鉴于本研究纳入样本量少、随访时间短,所得结论仍亟需多中心、大规模临床研究进一步确证。

