CRISPR-Cas9技术在植物次生代谢物生产中的研究进展
杨洋,王凤林,刘德,罗园园,朱建华
暨南大学药学院,广州 510632
基因突变(gene mutation)广泛存在于自然界中,从长远的生物进化史来看,进化的过程是遗传物质不断突变的结果,基因突变在一定程度上对生物物种的多样性起着积极的作用[1]。在自然条件下,一个特定基因相对于庞大的基因组来说,其突变概率是极低的。当科技研究发展至基因水平时,人们则需要对脱氧核糖核酸(deoxyribonucleic acid,DNA)序列中某个或某些特定的基因进行改造,即基因编辑技术。
基因编辑技术能够针对生物体基因组中特定的基因(目的基因)进行修饰,实现对特定DNA片段的插入、删除及定点突变,从而导致目的基因(gene of interest)序列改变,造成基因沉默、激活或移码突变(frame shift mutation)等。基因编辑的本质是利用具有靶向性的核酸内切酶,对DNA特定位点进行剪切,造成DNA双链断裂,然后利用生物体自身的DNA损伤修复(DNA repair)功能,实现对目的基因的编辑[2]。
近年来,随着基因编辑技术的不断发展,已有4种核酸酶家族被用于基因编辑,分别为:大范围核酸酶(meganucleases)[3]、锌指核酸酶(zinc finger nuclease,ZFN)[4]、转录激活样效应物核酸酶(transcription activator-like effector nuclease,TALEN)[5]以及成簇的有规律的间隔短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)相关蛋白(CRISPR-associated protein,Cas)[6]。CRISPR-Cas技术是继ZFN和TALEN后的第3代基因编辑技术[7]。ZFN和TALEN技术通过对转录激活因子中DNA结构域的蛋白质模体——锌指模体和氨基酸模块的识别来确定不同的DNA序列[8],而CRISPR-Cas9基因编辑技术通过sgRNA(small guide ribonucleic acid)来进行目的基因的定位,其设计简单、操作简便、效率高且成本低,已被广泛应用于多个领域的基因编辑中。
次级代谢产物(secondary metabolites)是相对于初级代谢(primary metabolism)产物而言的。初级代谢产物是植物代谢产生的维持植物机体生命活动必不可少的物质,如糖类、蛋白质、核酸和脂质等[9]。次级代谢产物是在特定条件下,由初级代谢产物经过进一步转化所产生的一类非必需的小分子有机化合物,包括萜类、生物碱、黄酮和皂苷等物质[10]。次级代谢产物一般具有药用价值,因此对植物次级代谢产物的研究有着重要意义。
2013年,Li等[11]首次成功利用CRISPR-Cas9技术对拟南芥和烟草原生质体进行基因编辑,展示了CRISPR-Cas9技术的高效性、简便性、多功能性和特异性,为该技术在植物中进行高精度基因编辑提供了新思路。自此之后,CRISPR-Cas9技术开始广泛用于水稻[12]、拟南芥[13]、烟草[14]、小麦[15]、大豆[16]和番茄[17]等植物的研究中,以提高农作物产量、改良品质、提高植物抗病性、提高非生物胁迫抗性和增强除草剂抗性[18]。本文综述了CRISPR-Cas9技术在植物次生代谢产物生产中的研究进展,以期为CRISPR-Cas9技术在药用植物领域的应用提供参考。
1 天然CRISPR-Cas9系统
CRISPR-Cas9系统是古细菌和细菌中存在的一种获得性免疫机制,1987年日本科学家首次在大肠杆菌中发现[19]。CRISPR是存在于原核生物基因组内的一段具有回文结构的重复序列[20],Cas9是由原核生物中Cas基因编码的一种蛋白,具有核酸酶活性,可切割DNA使双链DNA断裂(double strand breaks,DSB)。由于Cas基因编码蛋白通常与CRISPR序列区域同时起作用,故被命名为CRISPR关联(CRISPR-associated,Cas)基因[21]。当细菌遭受病毒入侵后,Cas1和Cas2编码的蛋白质扫描入侵的DNA,同时识别出外源DNA的原间隔物相邻基序(protospacer adjacent motif,PAM),PAM序列多为5'-NGG结构,之后Cas1和Cas2编码的蛋白质将临近PAM的DNA序列从外源DNA中剪切下来,在其他酶的协助下将剪切下来的DNA片段作为间隔序列插入到临近的CRISPR序列中,然后进行DNA修复,修补双链缺口。CRISPR序列经过转录及转录后加工表达产生成熟的crRNA(CRISPR RNA)和反式激活crRNA(trans-activating crRNA),最后crRNA、tracrRNA和Cas9蛋白组成复合物(图1A)。当细菌再次遭受到相同的外源DNA入侵时,crRNA/tracrRNA/Cas9复合物可识别出与crRNA互补的PAM序列,并准确定位到外源DNA的PAM区域,通过Cas9对外源DNA进行精准切割,导致DNA双链断裂,使外源DNA的表达沉默,从而为细菌和古细菌提供针对病毒的适应性免疫[6](图1B)。
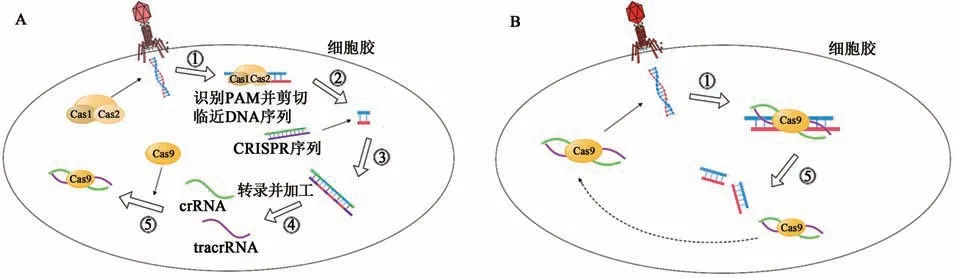
图1 天然CRISPR-Cas9系统[19]Fig.1 Natural CRISPR-Cas9 system[19]
2 基于CRISPR-Cas9的基因编辑技术原理
基于CRISPR-Cas9的基因编辑技术即利用CRISPR-Cas作为工具酶的一种基因编辑技术。通过人工设计一段小向导RNA(small guide RNA,sgRNA)以对目的基因进行定位,sgRNA具有靶向特异性,相当于天然细菌系统中crRNA和tracrRNA的复合物(图2)。sgRNA能够引导Cas9核酸内切酶至具有合适PAM的基因位点,通过Cas9的核酸酶活性切割目的基因使DNA双链断裂(double strand break,DSB)[22-23]。DSB可以通过非同源末端连接(non-homologous end joining,NHEJ)重组修复和同源定向修复(homology-directed repair,HDR)两种方式进行修复。由于NHEJ不需要通过同源DNA对DNA进行修复,因而以该种方式进行修复的DNA链同源性不高,修复的DNA序列中可能存在一定的错误,从而导致目的基因发生移码突变或终止密码子提前出现;而以HDR方式的修复,参与修复的两段DNA在相当长的范围内序列相同,故此种修复方式可以引入特定位点的突变或插入所需的基因序列[22,24]。通过CRISPR系统介导的HDR修复,除了可以对DSB进行修复外,还能够精确地将突变引入基因组[25]。
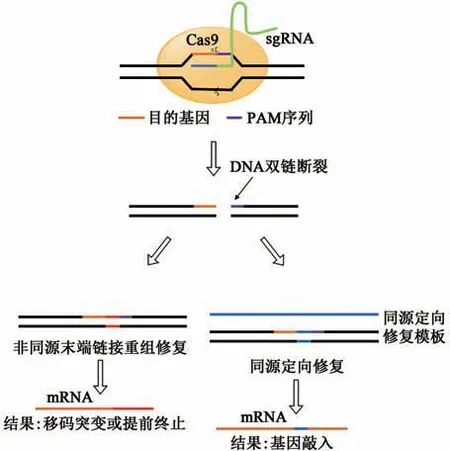
图2 基于CRISPR-Cas9的基因编辑技术原理[6]Fig.2 Principle of gene editing technology based on CRISPR-Cas9[6]
3 基于CRISPR-Cas9的基因编辑方法
3.1 基因敲除
Cas9蛋白切割DNA双链产生DSB,通常情况下,细胞通过NHEJ修复DNA双链断裂,在修复过程中极易发生碱基错配或缺失,导致移码突变,从而使基因沉默,达到基因敲除的目的[26]。利用CRISPR-Cas9技术对基因进行敲除,操作简单、效率高,因此被广泛应用于医学、药学和植物学等领域,用以阐明疾病发生机制、治疗疾病、发现药物作用靶点和提高植物产量、改良性状等[27]。马笃军等[28]利用CRISPR-Cas9技术敲除骨髓间充质干细胞相关结合蛋白Rab(ras-associated binding)家族基因RAB39B后,发现敲低RAB39B基因能够降低骨髓间充质干细胞增殖,同时促进细胞凋亡,证实了RAB39B基因与骨髓间充质干细胞的增殖、软骨分化的相关性。Miao等[29]利用CRISPR-Cas9技术敲除脱落酸受体家族蛋白PYL1/4/5(pyrabactin resistance 1-like 1/4/5)三基因的水稻突变体产量更高、生长最好。
3.2 基因敲入
细菌内存在与DSB互补的同源DNA时,还可以通过HDR的方式来修复DSB,该修复方式准确性高,可以将需要插入基因的互补片段人工导入细胞内,使DSB以导入片段作为模板进行修复,从而达到基因敲入的目的[22,24]。Zhao等[30]通过CRISPRCas9技术将低密度脂蛋白受体(low-density lipoprotein receptor,Ldlr)基因导入Ldlr基因缺陷的小鼠中,发现体内AAV-CRISPR-Cas9介导的Ldlr基因可挽救部分ldlr突变体的Ldlr表达,有效改善动脉粥样硬化,为家族性高胆固醇血症患者提供了一种潜在的治疗途径。
3.3 碱基编辑
尽管相对于NHEJ来说,HDR修复具有高度保真性,但其整合频率比NHEJ要低得多,且需要外源的修复模板,应用受到一定的限制。而利用Cas9突变体(de-activated Cas9,dCas9)和碱基编辑因子融合蛋白可以对单个碱基进行替换,且该过程不需要外源修复模板,从而实现G/C碱基向A/T碱基的转换,这一技术被称为碱基编辑(base editing,BE)[31]。由于其可对单个碱基精准点突变的优点,碱基编辑目前已被广泛应用于植物[32]、动物[33]和微生物[34]领域,在改善作物性状、实现精准育种以及治疗点突变引起的疾病等方面有着巨大的潜能。
3.4 基因抑制/激活
一种碱基编辑技术设计了HNH和RuvC结构域活性丧失的dCas9,使dCas9失去了核酸酶功能,只能在sgRNA引导下与DNA结合,而不对DNA进行剪切[35]。通过sgRNA的引导dCas9可以结合到转录起始位点,使基因无法继续转录,从而抑制基因表达。
通过CRISPR-Cas9技术对启动子序列进行干扰,同样可达到基因抑制或激活的目的。Čermák等[36]通过CRISPR-Cas9技术,使用双生病毒复制子对番茄基因进行遗传修饰,成功在控制花青素生物合成基因的上游插入一个强启动子,导致番茄组织中色素过表达和异位积累。
3.5 多基因编辑
若设计多个不同的sgRNA,分别将其转入细胞中,则CRISPR-Cas9系统可以通过sgRNA的引导同时对多个基因进行编辑。Yu等[37]通过CRISPRCas9系统同时编辑拟南芥中AtRPL10家族的三个同源基因AtRPL10A、AtRPL10B和AtRPL10C,得到了传统杂交难以得到的三基因突变体。
4 CRISPR-Cas9技术在植物次生代谢物生产中的应用
传统的转基因技术虽然可用于阐明次生代谢物生物合成途径、提高植物中的次生代谢物含量[38]以及改良植物遗传性质[39],但是外源基因的插入在一定程度上影响了植物的安全性。CRISPRCas9技术不存在外源基因的整合,虽然可能会在T0代植物基因组上插入标记基因、sgRNA序列和Cas9序列,但是这三者与靶基因没有密切的连锁关系,通过自交在T1代植株中能够筛选得到不含有外源基因的目标植株[40]。
4.1 醌类化合物
醌类化合物广泛分布于动物和植物中,大多具有重要的生物活性。目前,CRISPR-Cas9技术在醌类化合物的生产上多用于阐明药用植物丹参中活性成分丹参酮的生物合成。丹参酮类化合物是丹参的主要活性成分,临床上可用于治疗冠心病、心肌梗死[41],是一类二萜醌类化合物,通过异戊二烯代谢途径产生,其共同前体物质是牻牛儿基牻牛儿基焦磷酸(geranylgeranyl pyrophosphate,GGPP)[42]。李斌[43]首次将CRISPR-Cas9技术应用于药用植物丹参,成功获得了丹参二萜合酶SmCPS1(Salvia miltiorrhizacommitted diterpene synthase gene 1)基因的毛状根突变体和丹参二萜合酶SmCYP76AH1(Salvia miltiorrhizacommitted diterpene synthase gene 76AH1)毛状根突变体。同时,该研究证明SmCPS1基因位于丹参二萜类化合物共同前体物质GGPP的下游。这一基因的成功敲除为丹参中其他二萜醌类化合物的异源合成提供了可能。化合物前体形成重要的中间体后,会经细胞色素P450等后修饰酶催化生成各种复杂的化学结构,因此,细胞色素P450酶CYPs(cytochrome P450 enzymes)通常在天然产物的生物合成中起着至关重要的作用。Li等[44]报道了两个重要的P450酶CYP76AK2和CYP76AK3在丹参酮生物合成途径中的作用。利用一个三重靶标CRISPR-Cas9系统对丹参中的CYP76AK2和CYP76AK3基因进行靶向敲除,结果显示,突变体中五种丹参酮的含量均显著降低,说明这两种酶可能参与了丹参酮的生物合成。该研究结果为鉴定CYP76AK2和CYP76AK3的催化功能奠定了基础,也进一步丰富了对丹参酮次级代谢合成网络的认识。醌类物质可由酚类物质经植物多酚氧化酶(polyphenol oxidase,PPO)催化生成,对烟草而言,醌类化合物偏高会导致烟叶烘烤后品质变差。代卓毅等[45]选用烤烟品种NC89为实验材料,利用CRISPR-Cas9技术敲除PPO基因NtPPO8,结果表明,编辑NtPPO8后烟叶中PPO的活性降低、多酚类含量显著提高,有助于增强烟叶的耐烤性。总之在CRISPR-Cas9基因编辑技术的辅助下,不但有助于阐明丹参酮的生物合成途径,实现人工合成以降低丹参酮的生产成本,还可以改良植株的品质,提高其质量和价值,同时也为其他植物醌类化合物相关合成酶基因的编辑提供了参考方法。
4.2 苯丙酸类化合物
CRISPR-Cas9技术除了应用在丹参中的丹参酮生物合成研究外,还被用于研究丹参酚酸类成分的生物合成途径解析[46]。Deng等[47]从脱落酸(abscisic acid,ABA)诱导的丹参转录组文库中筛选到了一种碱性亮氨酸拉链转录因子bZIP(basic leucine zipper),并命名为SmbZIP1。利用CRISPR-Cas9敲除体系,辅助验证了SmbZIP1对脱落酸合成的促进作用和丹参酮合成的抑制作用,揭示了酚酸和丹参酮生物合成中一种新的调控因子,为丹参的代谢工程研究提供了新思路。Zhou等[48]利用CRISPR-Cas9系统对丹参水溶性酚酸合成途径中的迷迭香酸合成酶(rosmarinic acid synthase,RAS)基因SmRAS进行编辑,联合基因表达和代谢组学分析,发现编辑成功的毛状根系中,迷迭香酸和紫草精酸B等酚酸含量和RAS基因表达水平降低,这种现象在纯合突变体中尤为显著。此外,迷迭香酸生物合成前体3,4-二羟基苯基乳酸含量显著上升。这些结果表明,CRISPR-Cas9系统可以在生物信息学分析的辅助下识别一个基因家族中的重要基因,为丹参基因组编辑提供了一种高效、特异的工具。同时,丹参基因组测序的完成也为利用CRISPR-Cas9技术提高丹参中的次生代谢产物含量和改良丹参遗传性质提供了有利条件。
4.3 生物碱
生物碱是存在于自然界(主要为植物,少数为动物)的一类含氮碱性有机化合物,大多具有独特的生物活性。Zeng等[49]利用CRISPR-Cas9技术敲除了颠茄莨菪碱6β-羟化酶AbH6H(Atropa belladonnahyoscyamine 6β-hydroxylase)基因,提高了颠茄植株莨菪碱的含量,且不含有山莨菪碱和东莨菪碱,减小了提取莨菪碱的难度和成本,因此在低成本生产莨菪碱方面具有巨大的潜在适用性。Ma等[50]通过CRISPR-Cas9系统成功将茶树愈伤组织中的同源结构域亮氨酸拉链转录因子CsHB1(citrus HD-ZIPⅡtranscription)进行定向突变。在转基因愈伤组织中,转录因子CsHB1和N-甲基转移酶(N-methyltransferase,NMT)基因yhNMT1的表达分别下降65%和93%,咖啡因的积累下降97.5%,表明yhNMT1基因受CsHB1调控。这一结果将有助于理解茶中咖啡因生物合成的调控机制。此外,一些植物中含有毒生物碱,会限制其用药剂量和范围,如药用植物紫草(Symphytum officinale)具有抗炎、镇痛的作用[51],但其组织中存在有毒的吡咯利嗪类生物碱(pyrrolizidine alkaloids,PAs),从而阻碍了其应用[52]。Zakaria等[53]利用CRISPR-Cas9技术在有害突变中引入PAs生物合成途径中的第一个特异酶——同亚精胺合成酶(homospermidine synthase,HSS)基因,结果显示两个HSS等位基因中只要有一个失活就会导致毛状根中同亚精胺和PAs水平显著降低,而在两个等位基因均失活的毛状根中未检测到生物碱,该研究为非模式植物进一步研究PAs的生物合成提供了新思路。由此可见,对于具有药用价值的生物碱,利用CRISPR-Cas9技术对原植物进行基因编辑,有望提高植物中生物碱的产量、降低生产成本,从而降低病人的用药成本;而对于含有毒生物碱的药用植物,如某些含有PAs的草药,由于PAs水平超过了药物规定的最大耐受水平而被限制口服[54],利用CRISPR-Cas9对植物进行基因编辑,可降低其产生有毒生物碱的含量,进而扩大药用范围。
CRISPR-Cas9在生物碱合成中的应用不仅限于药用植物,也广泛应用于农作物领域,利用CRISPR-Cas9技术进行分子育种,可在基因水平上提升农作物品质和改良性状。水稻甜菜碱醛脱氢酶OsBadh2(Oryza sativabetaine aldehyde dehydrogenase 2)基因是稻米香味的主要控制基因,2-乙酰-1-吡咯啉(2-acetyl-1-pyrroline,2-AP)是稻米中的主要香味物质[56]。2-AP因其前体被OsBadh2催化氧化而合成受限,大米由此失去香味[57]。胡黎明等[12]选用常规稻华航31为受体材料,利用CRISPR-Cas9基因编辑技术对镉吸收转运蛋白基因OsNramp5(Oryza sativanatural resistance-associated macrophage protein)和香味基因OsBadh2同时进行编辑,创制OsNramp5和OsBadh2双基因敲除植株。与野生型华航31相比,所有双基因敲除植株中的香味物质2-AP含量均显著提高。对于同为单子叶植物的玉米,张翔等[58]利用CRISPR-Cas9技术对玉米中2个Badh2同源基因(ZmBADH2-1、ZmBADH2-2)同时进行定点敲除,成功获得了新型香型玉米。香型玉米种子中2-AP含量比编辑前的材料显著提高,香味更浓。烟草是一种传统的模式植物和重要的经济作物,烟草中烟碱的含量又关系到烟叶的品质和工业可用性[55]。冯吉等[14]将烤烟品种K326作为实验材料,利用CRISPR-Cas9技术定向敲除与烟草烟碱合成与转运相关的基因,最终成功获得低烟碱纯合基因型T2代烟草植株,为低烟碱烟草分子育种提供了理论和技术支撑。
4.4 萜类化合物
萜类化合物种类繁多、分布广泛,其中有一半以上是在植物中发现的,是植物体内一种重要的次生代谢物,对植物的生长、发育以及植物与生态环境之间的联系起着极为重要的作用。利用CRISPR-Cas9技术对主要活性物质为萜类化合物的药用植物进行基因编辑,探索其合成途径,可以实现萜类化合物的批量生产。青蒿素(artemisinin,ART)是我国科学家屠哟哟团队20世纪70年代初从传统中药黄花蒿(Artemisia annuaL.)中分离获得的一种具有过氧基团的新型倍半萜内酯类化合物,对恶性疟原虫、耐甲氟喹等抗疟药的疟原虫有显著的杀灭作用[59-60]。至今,青蒿素类药物仍是世界卫生组织(World Health Organization,WHO)倡导的“基于青蒿素的联合疗法”(artemisinin-based combination therapies,ACTs)首选抗疟药[60]。但由于天然青蒿中青蒿素含量极低,难以满足市场需求,如何提高青蒿中青蒿素的产量已成为研究的热点。CRISPR-Cas9技术在青蒿素生物合成通路前体关键酶基因的编辑上得到了充分应用。紫穗槐二烯合成酶(amorphadiene synthase,ADS)是催化焦磷酸法尼酯(farnesyl pyrophosphate,FPP)生成紫穗槐二烯的关键酶,是FPP走向青蒿素代谢通路的限速酶。Song等[61]利用CRISPR-Cas9对枯草芽孢杆菌中ADS生物合成通路的基因进行编辑,不仅引入特定的点突变和敲除基因,还将2.5 kb的GFPADS表达盒整合到枯草杆菌基因组中,这是CRISPR-Cas9报告整合到枯草杆菌基因组中的最大片段,经基因改造后的枯草芽孢杆菌,在没有经过任何发酵条件的优化下,紫穗槐二烯的含量由81 mg·L-1增加到116 mg·L-1。此外,杨林等[62]克隆了甘草1-脱氧-D-木酮糖-5-磷酸合酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS)基 因,采用基因融合法构建了过表达载体pCA-DXS。根据DXS第一外显子设计sgRNA序列,构建了CRISPR-Cas9基因编辑载体,通过发根农杆菌介导法诱导甘草胚轴的DXS基因过表达,结果表明,DXS基因过表达甘草毛状根样品中甘草酸含量明显降低,证实了DXS基因对甘草酸生物合成的负调控作用。
三萜是传统中药雷公藤(Tripterygium wilfordii)的主要活性成分。但是人们对植物中三萜的生物合成知之甚少。Liu等[63]从雷公藤中克隆了2种角鲨烯环氧化酶和5种氧化角鲨烯环化酶基因,利用CRISPR-Cas9系统和酵母异源表达鉴定其功能。这些基因的发现扩大了人们对三萜生物合成关键酶的了解,也为通过破坏竞争途径增加雷公藤组织培养中三萜的产量或通过重建三萜生物合成途径增加底盘细胞中三萜的产量提供了额外靶基因。
类胡萝卜素是一种四萜类化合物[64],是植物显现颜色的重要因素之一,也是人体内维生素A的主要来源,具有抗氧化、免疫调节、抗癌和延缓衰老等功效[65]。日本牵牛花(Ipomoea nil)可呈现出多种颜色,但唯独没有黄色,这表明花瓣中类胡萝卜素含量较低。Watanabe等[66]利用CRISPRCas9技术敲除了牵牛花中的类胡萝卜素剪切双加氧酶(carotenoid cleavage dioxygenase,CCD)基因,发现敲除CCD基因的白色花瓣变成淡黄色,这一结果表明CCD参与调控花瓣中类胡萝卜素的积累。
八氢番茄红素脱氢酶(phytoene desaturase,PDS)是合成类胡萝卜素的关键限速酶,无色的八氢番茄红素经PDS处理形成有色的类胡萝卜素。左鑫等[67]选择RcPDS1基因作为靶基因,利用CRISP-Cas9系统成功创制RcPDS1基因敲除植株,发现敲除RcPDS1基因的植株出现白化现象,这为进一步解释浙地黄中类胡萝卜素的生物合成机制提供了基础。编码和调节基因突变区域可以对基因功能产生不同的影响。Jayaraj等[68]在番茄类胡萝卜素上的研究也证明了这一点,CRISPRCas9系统通过番茄类胡萝卜素异构酶基因5'-UTR的缺失导致该基因的下调,使脯氨酸红素向番茄红素的转化率降低。
植物萜类化合物是植物中结构变化最多的一类次生代谢产物[65],其结构多样性在一定程度上阻碍了自身合成途径的阐明和进一步生产应用。而许多相关研究已表明,利用CRISPR-Cas9技术有助于萜类化合物生物合成途径的阐明,也为利用生物技术生产萜类化合物提供了科学资料。
4.5 木质素
木质素在植物次生细胞壁中含量丰富,与植物机械支持和水分传输等方面有着密不可分的关联。CRISPR-Cas9技术在木质素类化合物生产上的应用,有助于开发富含木质素的草生物、生产能源丰富的固体生物燃料和木质素衍生芳香族化合物。木质素生物合成相关基因的表达对秸秆植物的理化性质和遗传改良具有重要意义。Miyamoto等[69]利用CRISPR-Cas9介导的基因组编辑对水稻转录抑制因子OsMYB108(Oryza sativaavian myeloblastosis viral oncogene homolog)进行靶向敲除,获得了一种木质素丰富的模式转基因水稻。敲除OsMYB108的水稻突变体秆细胞壁中木质素生物合成基因表达增加,木质素沉积增强。兰科植物是第二大开花植物科,具有很高的观赏性和药用价值。目前,兰科植物铁皮石斛(Dendrobium officinale)全基因组测序已完成,因此有望成为兰科植物进化、发育和遗传研究的模型。Kui等[70]成功利用CRISPR-Cas9系统对铁皮石斛木质素生物合成途径的5个靶基因香豆酸-3羟化酶C3H(coumarate 3-hydroxylase)、肉桂酸-4-羟化酶C4H(cinnamate-4-hydroxylase)、4-香豆酸辅酶A连接酶4CL(4-coumarate coenzyme ligase)、肉桂酰辅酶A还原酶CCR(cinnamoyl coenzyme reductase)、不规则木质部IRX(irregular xylem)进行定向编辑,提示可以进一步利用该系统修饰其他化合物的生物合成途径,以更好地研究功能基因对药用植物发育和代谢影响的分子机制。
4.6 皂苷类化合物
目前,越来越多的研究关注皂苷的合成和代谢途径,探索皂苷合成途径中的关键酶基因,并试图通过基因层面的调控影响皂苷的合成,进而提高皂苷产量。王琪等[71-72]通过人参皂苷前体物质2,3-氧化角鲨烯的代谢通路,采用CRISPR-Cas9基因编辑技术构建了环阿屯醇合酶(cycloartenol synthase,CAS)和达玛烷二醇合成酶(dammarenediol synthase,DS)质粒 表 达载 体CRISPR-Cas9-CAS和CRISPR-Cas9-DS,探究载体与人参愈伤组织共培养时合适的抑菌压和筛选压,为以皂苷类化合物为主要活性成分的植物基因编辑体系建立奠定实验基础。人参根中含有2种四环三萜类皂苷,分别为原人参二醇型(protopanoxadiol-type saponins,PPD)和原人参三醇型(protopanaxatriol-type saponins,PPT),PPD在PPT合成酶的催化下合成PPT。Han等[73]利用CRISPR-Cas9介导的PPT合酶基因突变构建了人参纯合子突变系,并获得了完全缺失PPT型人参皂苷的突变人参根系。实验结果证明突变根通过消耗PPT型人参皂苷产生PPD型人参皂苷,这是首次利用CRISPR-Cas9系统产生靶向诱导突变以修饰人参属植物的皂苷生物合成。
盾叶薯蓣(Dioscorea zingiberensis)是中国特有的植物,其根状茎可用于分离多种甾体药物的合成前体——薯蓣皂苷元,其具有保护神经、降低高血脂、保护心血管、抗肿瘤、抗骨质疏松、抗炎、抗氧化、抗血栓、驱虫和抗过敏等功效[74]。Feng等[74]首次采用CRISPR-Cas9编辑工具对盾叶薯蓣薯蓣皂苷元合成过程中的关键酶法尼基焦磷酸合酶(farnesyl pyrophosphate synthase gene,FPS)基因Dzfps进行靶向突变,sgRNA设计在FPS的第一个外显子上,sgRNA表达盒由OsU3启动子驱动,Cas9由35S启动子驱动。结果发现,与野生型植株相比,分离突变体中法尼基焦磷酸合成酶基因的转录水平和角鲨烯的含量显著降低,该研究为定向改造盾叶薯蓣的基因组提供了一种快速有效的方法。
无论是人参皂苷还是薯蓣皂苷都是具有重要生物活性的化合物,由于对该类活性成分的大量需求,野生型药用资源正在不断减少。利用CRISPR-Cas9技术探索皂苷的生物合成途径,有望对皂苷进行量产或提高药用植物皂苷的产量,以缓解药用植物资源短缺的现状,同时也可保护野生资源。
4.7 甾体类化合物
目前,维生素D缺乏症已成为全球的健康问题。生理状态下,皮肤皮脂腺及其分泌物的7-脱氢胆固醇(7-dehydrocholesterol,7-DHC)经太阳照射后可以合成维生素D3。某些植物也可合成7-DHC,如番茄等植物的叶片和未成熟的绿色果实[75]。但通常情况下,7-DHC不会在植物中累积,而是转化为胆固醇。Li等[76]利用CRISPR-Cas9基因编辑技术敲除了番茄中7-DHC还原酶基因SI7-DR2(specific isoform of 7-dehydrocholesterol reductase 2),发现SI7-DR2的失活可以大大增加番茄叶片和未成熟果实中7-DHC的含量,而对番茄内其他化合物的含量及番茄的生长、发育和产量等没有显著影响。经紫外线照射后,番茄中的7-DHC可有效转变为维生素D3。以上研究结果提示番茄可以被开发为一种基于植物的、可持续的维生素D3来源。
4.8 黄酮类化合物
黄酮类化合物泛指两个苯环(A与B环)通过中央3个碳原子相互联结而成的一系列化合物,具有C6-C3-C6骨架特征,广泛存在于自然界中,在各种蔬菜、水果中都具有较高的含量。CRISPRCas9在黄酮类化合物生产方面主要应用于农作物领域,如提高水稻和荞麦中黄酮的含量以增加其营养价值、提高豆科植物中异黄酮的含量以增强其病毒抗性。
花青素在植物生长中起着重要的作用,是构成植物红色、蓝色和紫色的物质基础,并且具有很强的抗氧化和清除自由基活性。在植物中,MYBbHLH-WD40(MBW)复合体激活花青素生物合成基因,但在水稻中WD40的调控方式并不明确。Yang等[77]利用CRISPR-Cas9技术获得了水稻WD40基因OsTTG1突变体,发现该突变体各器官中花青素积累显著降低,确定OsTTG1(Oryza sativatransparent testa glabra1)是水稻和其他植物中花青素合成的关键基因。花青素合成酶(anthocyanin synthase,ANS)是植物花青素合成的关键酶,催化花青素生物合成的倒数第2步,可使无色花色素转变成有色花色素。杨迎霞等[78]以花青素合成途径中的关键基因BoANS为目标基因,成功建立了花椰菜CRISPR-Cas9基因编辑技术体系,结果显示基因编辑株花球表面颜色减退,该研究为花椰菜优质资源的创制提供了技术体系。
苦荞是一种重要的食用和药用植物,含有丰富的芦丁与其他黄酮类化合物,FtMYB45是一种R2R3-MYB转录因子,对荞麦类黄酮的生物合成具有负调控作用。Dong等[79]利用CRISPR-Cas9系统,设计了两个sgRNA靶向FtMYB45基因的第二外显子,利用发根农杆菌介导转化获得转基因毛状根,测序结果显示,共产生了6种类型的突变体系,突变频率达到50%;基于液相-三重四级质谱法(liquid chromatography coupled with triple quadrupole mass spectrometry)代谢组学结果亦显示,毛状根突变体中芦丁、儿茶素和其他黄酮类化合物含量均有所增加。这一研究表明,CRISPRCas9系统可以精确编辑荞麦基因组,为荞麦基因功能研究和品质改良奠定了基础。
异黄酮主要分布在豆科植物中,这些化合物在植物与环境的相互作用中起着关键作用,且有益于人类健康。异黄酮合酶(isoflavone synthasem,IFS)是合成异黄酮的关键酶,与黄烷酮-3-羟化酶(flavanone-3-hydroxylase,F3H)和黄酮合酶Ⅱ(flavone synthaseⅡ,FNSⅡ)共享一个底物。为了提高大豆异黄酮的含量,Zhang等[80]采用CRISPR-Cas9介导的多重基因编辑技术同时靶向大豆中的大豆黄烷酮-3-羟化酶GmF3H1(Glycine maxL.Merr.flavanone-3-hydroxylase1)、GmF3H2(Glycine maxL.Merr.flavanone-3-hydroxylase2)和大豆黄酮合酶GmFNSⅡ-1(Glycine maxL.Merr.flavone synthaseⅡ-1),使突变株中异黄酮的含量显著提高,从而增强了植株对大豆花叶病毒的抗性。
红三叶草(Trifolium pratense)是一种优质的豆科牧草,非常适合放牧和干草生产。Dinkins等[81]利用CRISPR-Cas9系统敲除红三叶草中异黄酮生物合成中的关键酶异黄酮合酶(isoflavone synthase,IFS1),使突变植株中包括芒柄花素、生物霉素A和染料木素在内的异黄酮水平显著降低。根瘤菌测试实验显示,异黄酮不参与红三叶的根瘤菌信号传导,但可能在根际防御中发挥作用。
CRISPR-Cas9技术已成为黄酮类化合物生物合成相关基因修饰和植物品种改良的重要工具。通过基因编辑有望大幅度地提高植物黄酮类成分的产量,培育高产优质新植物品种。
5 展望
CRISPR-Cas9基因编辑技术是第3代基因编辑技术,其以简便易行和高效迅速等优点在各个领域得以广泛应用。与TALENs和ZFNs技术相比,CRISPR-Cas9系统具有操作简单、精度高、编辑效率高和无标记等优点。植物次生代谢产物在植物与环境相互作用和整个生命活动中行使着重要的功能,它们不仅是植物防御体系的一部分,与植物的生长发育相关酶基因的时空表达息息相关,也是天然活性成分的主要来源,但该类成分在植物中的含量往往比较低,难以满足药物的进一步开发和利用。CRISPR-Cas9技术为植物基因工程的研究提供了新思路,其在提高植物次生代谢物产量、改良品质、提高植物抗性及阐明天然活性成分生物合成机理等方面起到至关重要的作用。
丰富的植物种类是人类的珍贵资源。中药多来源于植物,其发挥药效的物质基础大多是植物次生代谢物。通常天然植株中目的代谢物含量较低,如紫杉醇、青蒿素等,同时对药用植物有效成分进行化学合成时,又会遇到工艺流程复杂、成本高、合成过程中副反应多及污染环境等问题。近年来,随着对植物次生代谢产物合成生物学研究的深入认识,以及分子克隆和遗传转化技术的飞速发展,利用基因工程大规模生产植物组织代谢物已经成为该研究领域的热点,具有广阔的应用前景。
在基因编辑技术出现之前,转基因农作物引发了许多社会争论,但CRISPR-Cas9技术有望大大改善这种现状,其成本低廉和简便易行的特点可很快获得具有商业前景的农作物。在生产植物组织代谢物方面,由于资源有限,代谢工程不可能对所有代谢物质进行大规模筛选,所以为提高基因编辑技术的利用率,只能将研究资源集中到被广泛需要的药用成分以及主要农作物中与抗性、品质相关的次生代谢途径上。
总之,CRISPR-Cas9技术已经得到广泛应用,技术手段也在不断更新和完善,比如靶位点的突变效率和特异性的进一步提高,这为各种植物基因编辑体系的建立提供了充足的理论知识和可借鉴经验。由此推测,CRISPR-Cas9技术有望在突变效率、稳定性与安全性等方面得到更快的发展,其推广也必将会对人类疾病治疗、基因组定点编辑和植物遗传育种产生革命性的影响。

