暗色刺参的实时荧光PCR鉴定❋
吴 姗, 虞惠贞, 沈旭芳, 孙 超, 张 荃, 陈 哲, 尹文秀, 张明哲, 张晓峰
(杭州海关技术中心, 浙江 杭州 310016)
海参不仅是珍贵的食品,也是名贵的药材,在中国、日本、韩国、印度尼西亚等亚洲国家深受消费者喜爱。全球有海参1 400余种,分别属于6个目25个科,可供食用的海参约40多种[1]。暗色刺参(Isostichopusfuscus)属棘皮动物门(Echinodermata)海参纲(Holothuroidea)楯手目(Aspidochirotida)刺参科(Stichopo-didae),产于加拉帕戈斯群岛一带,墨西哥、巴拿马、秘鲁和厄瓜多尔是其主要出产国。暗色刺参是刺参中的珍品,也是被列入《濒危野生动植物种国际贸易公约》(CITES)目录的物种[2],但受到经济利益驱使,市场上暗色刺参的销售并未绝迹。
对濒危动植物的精准鉴别是开展濒危物种保护的最基本手段。传统的海参鉴别方法主要依赖海参的外部形态和解剖特征,如Toral[3]认为,鉴定完整形态的暗色刺参时,其钙质骨针(Calcareous spicules)的特征优于库维管(Cuvierian tubules)和钙质环(Calcareous ring)的形态特征,是一种较可靠的分类依据。但基于形态学的鉴定需要鉴定人经验丰富,在海参销售时,海参往往被加工成干海参、盐渍海参、即食海参、冻干海参、海参胶囊及海参口服液等,形态已经不完整,单纯从其形态上难以鉴别。
现代分子生物学的鉴别方法可有效克服上述形态学鉴定方法的不足,同时也比物理学的光谱结构分析法和化学的内含物质结构分析法更稳定可靠。律迎春等[4]基于线粒体细胞色素C氧化酶亚基 Ⅰ(Cytochrome oxidase subunit Ⅰ gene,CO Ⅰ)的序列特异性,通过斑点杂交方法鉴定了4种海参种类。此外,律迎春[5]又开发了PCR-RFLP方法并对梅花参(Thelenotaananas)、仿刺参(Apostichopusjaponicus)、加州拟刺参(Parastichopuscalifornicus)和北大西洋瓜参(Cucumariafrondosa)进行了鉴定。和律迎春的基于CO Ⅰ的序列特异性不同,Wen等[6]基于线粒体16S rRNA(16S ribosomal RNA)基因序列,也建立了PCR-RFLP的方法,对6种刺参科的海参进行了物种鉴定。但不论是斑点杂交,还是PCR-RFLP的方法,律迎春[5]认为PCR方法的准确率更高,可达到100%。Wen等[7]采用species-specific PCR的方法对市售的11种深加工海参进行鉴定,通过特异性引物的设计,对11种海参的16S rRNA进行了扩增,并得到了较准确的鉴定结果。Zuo等[8]则采用multiplex-PCR对仿刺参、加州拟刺参、梅花参等海参进行了鉴定。目前,利用分子生物学对海参种类进行鉴定的标准仅局限于仿刺参,包括DB21/T 2138—2013仿刺参基因识别检测方法[9]和DB37/T 2292—2013刺参(种质)[10],前者制定了仿刺参的荧光PCR的鉴定方法,后者利用微卫星定点分析进行物种鉴定。
进行濒危动物保护时,常关注的是哺乳动物、鸟类或鲸、鲨体型较大的海洋动物等,海参作为一种体型较小、较为低等的动物,受到的关注有限,因此目前尚未有利用分子生物学手段鉴定暗色刺参的报道。本研究基于暗色刺参物种特异性的核酸片段,设计了引物和探针,建立了能够精准鉴定暗色刺参的实时荧光PCR方法。与利用通用引物的非特异性分子鉴定方法(如DNA Barcoding方法)相比,本方法更简单、准确,适合在混合物中鉴定是否存在暗色刺参。
1 材料与方法
1.1 实验材料
用于实验的海参种类见表1。此外用于暗色刺参引物探针特异性验证的物种还包括:中国枪乌贼(Loligochinensis)、欧洲鳗(Anguillaanguilla)、大西洋鲑(Salmosalar)、大西洋鳕(Gadusmorhua),上述材料均购自市场。

表1 用于检测的海参物种Table 1 Sea cucumber species for study
1.2 DNA抽提及浓度测定
1.2.1 样品前处理 干海参:取10 g用水泡发,取泡发后的海参2 g,用振荡研磨仪(Bertin Precellys Evolution, Bertin Technologies, 法国)研磨成细末,研磨程序为:5 500 r/min,20 s,并重复4~6次。即食海参:取2 g直接用振荡研磨仪研磨成细末,程序同上。
1.2.2 DNA抽提 采用QIAGEN食品提取试剂盒(DNeasy nericon Food Kit),取样量为200 mg,加入DNA提取裂解液1 mL使研磨后的海参降解成液状,继续按照说明书进行DNA抽提,将抽提得到的DNA溶解在50 μL的水中,测定DNA浓度。
1.2.3 DNA浓度、纯度测定 使用NanoDrop ND-1000 (Thermo Fisher Scientific, 美国)测260和280 nm处的吸光值A260和A280,其中吸光值A260可换算成DNA浓度,用A260/A280比值表示DNA纯度。
1.3 暗色刺参样品的测序和BLAST比对
将购买的标识为“暗色刺参”的样品进行PCR扩增和测序,并进行BLAST比对。PCR扩增的方法见表2中参考文献[5,11-12],测序由北京擎科新业生物技术有限公司完成,得到的序列详见图1,序列进行BLAST比对的结果见表2。

表2 暗色刺参样本PCR扩增产物的序列比对Table 2 Sequence alignment of PCR products from I. fuscus sample

( (a), (b)和(c): 分别对应表2中的序列1、序列2和序列3。 (a), (b) and (c): Corresponding to sequence 1, sequence 2 and sequence 3, respectively, in table 2.)
1.4 暗色刺参特异性引物设计
在GenBank上收集暗色刺参和相关刺参科及其他近似物种的线粒体基因(见表3)。使用MegAlign软件对表3中所列的COⅠ和16S rRNA序列分别进行比对,找到与其他海参序列差异较大的区域(见图2),设计暗色刺参特异性引物和探针(见表4)。同时,根据1.3中测序得到的暗色刺参的序列(见图1),设计暗色刺参特异性引物和探针(见表4)。
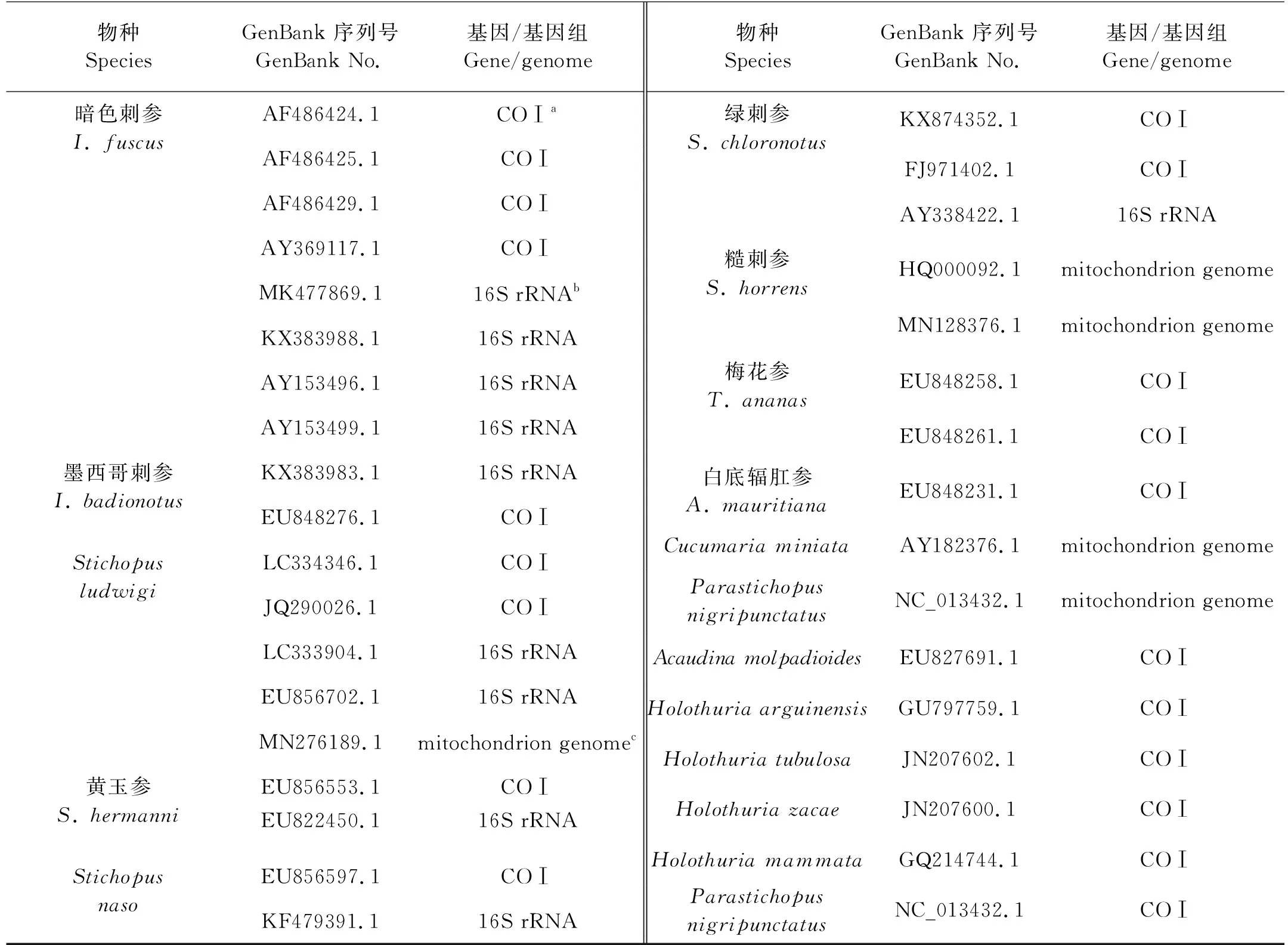
表3 用于引物探针设计的基因/基因组序列Table 3 Gene /Genome sequences (GenBank numbers) for primer and probe design

((a), (b)和(c): 分别为I-fu-1的上游引物, 探针和下游引物的设计区域。 (d), (e)和(f): 分别为I-fu-2的上游引物, 探针和下游引物设计区域。 方框表示对应的引物或探针序列的全部或者部分(图(d)和(f)只显示了部分的序列)。图中标黑的碱基表示和大多数序列中的碱基有差异。 (a), (b) and (c): Regions for design forward primer, probe and reverse primer of I-fu-1; (d), (e) and (f): Regions for design forward primer, probe and reverse primer of I-fu-2. The box in the figure indicates all or part of the corresponding primer or probe sequence ( (d) and (f) only show part of the sequences). Residues marked black were different from the majority.)

表4 引物探针序列Table 4 sequence for primer and probe
1.5 实时荧光PCR反应
实时荧光PCR反应体系如下:10 μL Premix Ex Taq(Takara,中国),上游引物(0.01 μmol/L)0.4 μL,下游引物(0.01 μmol/L)0.4 μL,探针(0.01 μmol/L)0.4 μL,取上述DNA 2 μL,用水补足体积至20 μL。应用荧光定量PCR仪lightcycle 480(Roche,美国)进行反应,反应程序为:(1) 95 ℃,10 s。(2) 95 ℃,5 s;60 ℃,23 s;40个循环。反应结束后采用仪器程序自带的“Abs Quant/Fit Points for All Samples”方法计算Ct(Ct表示每个反应管内荧光信号到达设定的域值时所经历的循环数)值。每个反应重复3次,本研究中所显示的Ct值是重复3次的平均值,SD为标准差。
为检验抽提得到的海参、乌贼、鱼类等物种的DNA质量,参照国家标准GB/T25165—2010[13],制备检测真核生物的引物探针组合18S rRNA,通过该荧光PCR反应得到Ct值,该Ct值可表示对应的DNA质量。荧光PCR反应条件,及引物和探针序列参照标准GB/T25165-2010[13]。
1.6 标准曲线绘制
为确定荧光PCR检测体系的检出限和线性范围,对目标DNA进行梯度稀释,并利用DNA浓度和Ct值之间的相关性绘制标准曲线。将抽提得到的DNA进行4倍梯度稀释,进行荧光PCR检测。变量相关性公式[14]:Ct值=blog10[DNA浓度]+a,其中log是对数函数符号;b是斜率;a是截距。
1.7 深加工不同种海参混合样中暗色刺参的检测
1.7.1 深加工混合样的制备及混合物的DNA提取 以暗色刺参、墨西哥刺参和梅花参为材料,制备深加工混合样。将海参用冷水浸泡12 h,再沸水炖煮20 min。将炖煮后的海参按照表5的比例混合,每个混合样总质量10 g,共制成7个样。按照比例混合后的10 g样品经过震荡研磨仪(型号同1.2)充分混合研磨成细末(反应程序同1.2),加入DNA提取裂解液(DNeasy nericon Food Kit,QIAGEN)15 mL,使10 g混合物完全降解成液状,取降解后液体混合物1 mL,继续进行DNA抽提,并测定DNA浓度和纯度(方法同1.2)。
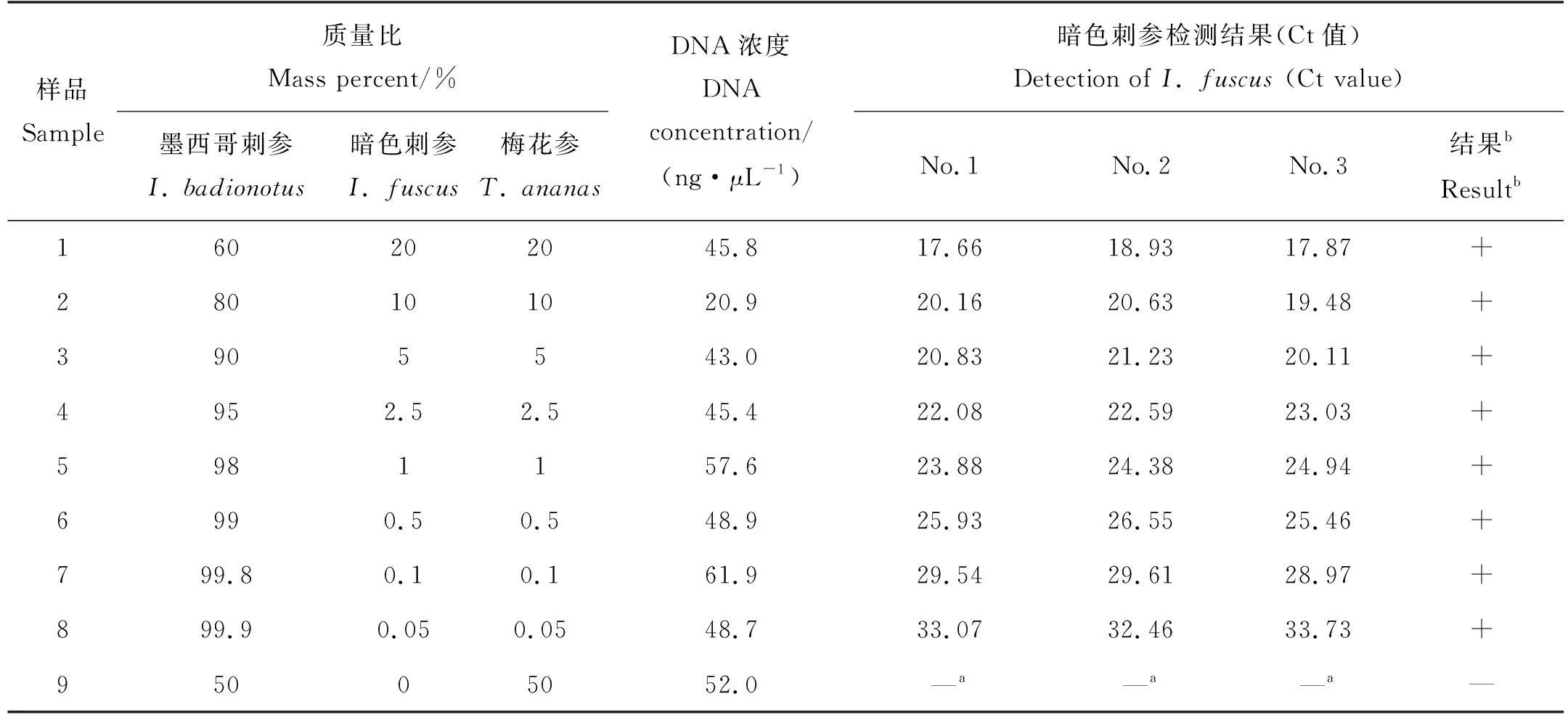
表5 3种深加工海参混合制品中暗色刺参的检测结果Table 5 Detection of I. fuscus in the mixed sample of three processed sea cucumbers
1.7.2 荧光PCR检测 根据1.5和1.6中不同引物探针的特异性、灵敏度的检测结果,采用最佳的引物探针组合I-fu-4进行检测,检测方法同1.5。每个浓度的样品重复检测3次,3次结果中2次的Ct值小于等于37即为阳性,否则为阴性。以“+”表示能检测到该百分含量的暗色刺参,以“—”表示不能检测到该百分含量的暗色刺参。
2 结果
2.1 引物探针的特异性验证
在GenBank上收集了暗色刺参和相关刺参科及其他近似物种的线粒体基因。如表3所示,只有少数海参,如Stichopusludwigi、Cucumariaminiata和Parastichopusnigripunctatus等具有完整的线粒体基因组信息,而多数海参只收集到线粒体中16S rRNA和COⅠ基因的信息。将表3中16S rRNA基因的序列进行排序比对,发现表3中海参之间的16S rRNA序列差异巨大,这可能是收集得到的序列不完整,长度差异大,从而导致序列比对有巨大差异,因此,未能在16S rRNA基因上找到适合设计引物探针的区域。通过比对COⅠ基因的序列,在图2所示的区域设计了具有暗色刺参物种特异性的引物探针组合I-fu-1和I-fu-2(见表4)。根据测序得到的序列1、2和3设计了相应的引物探针组合I-fu-3、I-fu-4、I-fu-5和I-fu-6(见表4)。
使用6组引物探针组合对20个样本(含阴性对照样本)进行检测,结果如表6所示。I-fu-1、I-fu-3、I-fu-4、I-fu-6的特异性较高,只在目标物种中得到阳性结果;I-fu-2和I-fu-5除了在暗色刺参中出现阳性结果,在同一属的墨西哥刺参中也得到了阳性结果。和I-fu-1、I-fu-3、I-fu-4比较,I-fu-6的检测效率不高,检测相同浓度的暗色刺参DNA,其余引物探针得到的Ct值在20~22之间,但I-fu-6的Ct值在28左右。因此在后续的灵敏度验证中只对I-fu-1、I-fu-3、I-fu-4这3组引物探针进行灵敏度验证。
表6并未完整列出20个样品的检测结果,而只列出了特异性引物(I-fu-1~I-fu-6)反应有阳性结果的样品,其余检测结果为阴性(低于检测限)的样品为:表1中的其他海参样品,中国枪乌贼、欧洲鳗、大西洋鲑和大西洋鳕样品,用于阴性对照的ddH2O。上述未列入表6的验证样品,用真核生物通用引物探针组合(18S rRNA)扩增其DNA,除ddH2O外均得到阳性结果,且Ct值在18~23之间,说明样品的DNA适合用于荧光PCR的扩增。
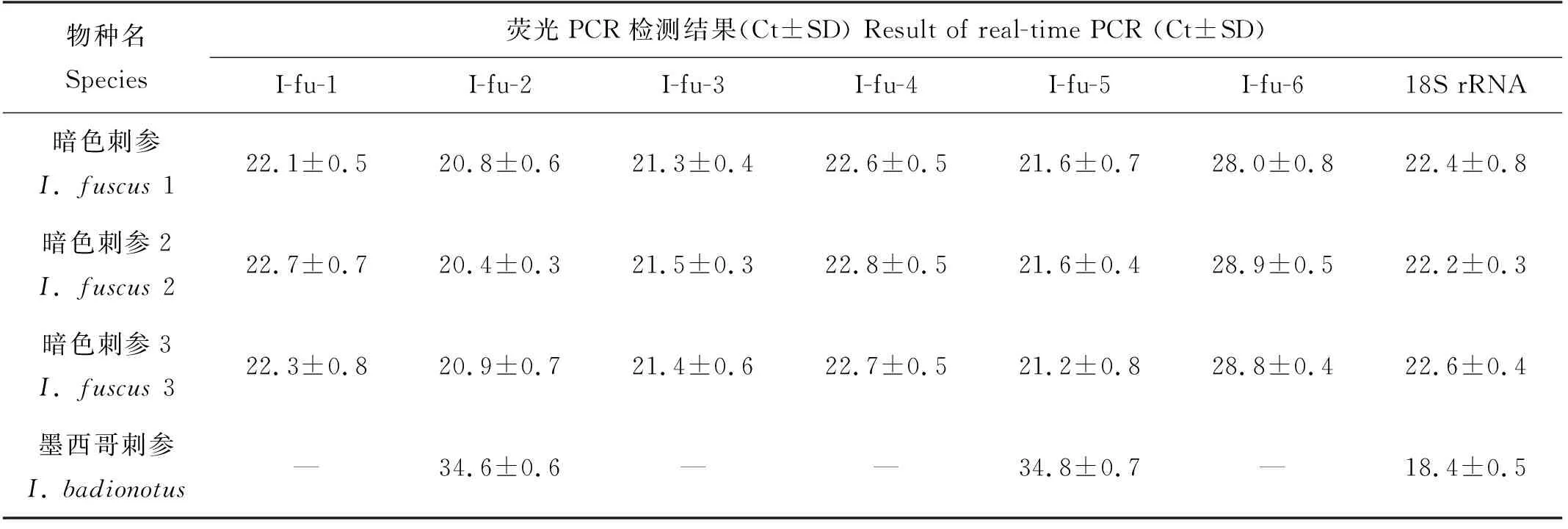
表6 暗色刺参引物探针的特异性验证Table 6 Specificity of primer and probe for detection of I. fuscus
2.2 引物探针的灵敏度验证
引物探针的检测灵敏度,即指在一次荧光PCR反应中能够检测到暗色刺参的最低浓度,且DNA样本中不包含其他物种的DNA。表7显示I-fu-3和I-fu-4的灵敏度优于I-fu-1,就real-time PCR扩增曲线的图形显示(图略),I-fu-4的阳性曲线显示的荧光值较高,阳性较强。比较了3组检测体系的检出限和线性范围,进一步比较I-fu-1、I-fu-3和I-fu-4引物探针组合的优劣。I-fu-1能检测到的最低浓度为0.003 ng/μL,以此浓度为低限,绘制得到的标准曲线的R2值大于0.99(y=-4.074 6x+25.751,R2=0.997 9),说明在此检测浓度范围内(40.0~0.003 ng/μL),检测得到的Ct值和DNA浓度相关性较大,I-fu-1的检测灵敏度为0.003 ng/μL左右。表7显示,I-fu-3和I-fu-4的最低检测浓度是0.000 8 ng/μL,同样以此浓度为低限,得到标准曲线的R2值分别为0.984 8(y=-3.813 1x+24.104)和0.996 2(y=-4.182 2x+23.116),说明在40.0~0.000 8 ng/μL的检测浓度范围内,I-fu-4得到的Ct值更可信,与DNA浓度的相关性更高。因此,就检测灵敏度而言I-fu-4优于I-fu-1和I-fu-3,可以达到0.000 8 ng/μL。
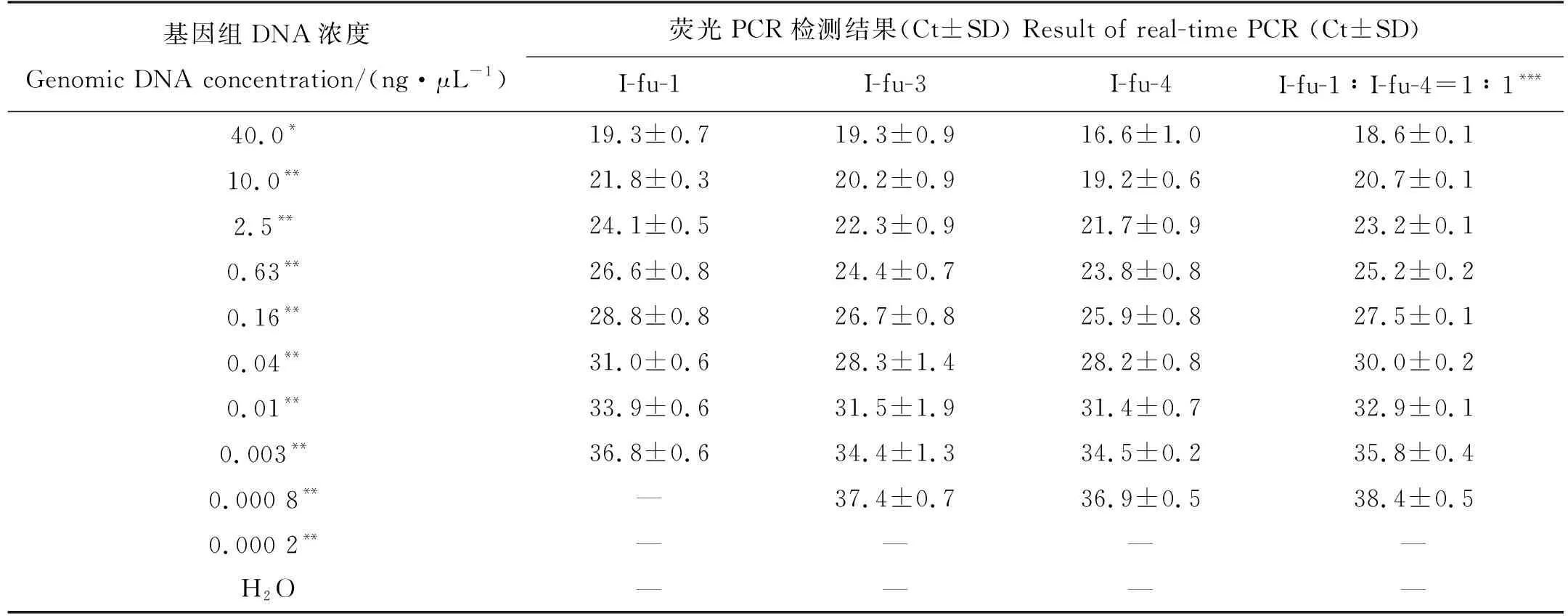
表7 暗色刺参引物探针的灵敏度验证Table 7 Sensitivity of primer and probe for detection of I. fuscus
2.3 不同种海参深加工混合样品中的检测灵敏度
用墨西哥刺参、梅花参和暗色刺参制备了9个不同含量比例的混合样品(见表5),样品1~8都含有目标物种暗色刺参,样品9为只含有墨西哥刺参和梅花参的阴性对照。检测结果的Ct值一方面受到目标海参百分含量的影响,另一方面和抽提得到DNA的浓度、纯度有关。表5所示,所提取的DNA浓度都在45 ng/μL左右(9个样品的纯度A260/A280在1.90~2.1之间,具体结果略),只有样品7浓度较高,达到61.9 ng/μL,而样品2浓度较低,为20.9 ng/μL,这也导致了含暗色刺参百分含量更高的样品2(含量为10%)与百分含量低一半的样品3(含量为5%)检测得到的Ct值相近。但总体趋势是,目标物种含量高,检测结果Ct值较低,随着目标物种含量的降低,Ct值升高,且样品1~8中目标物种的检测结果皆为阳性。通过计算得到暗色刺参含量最低的样品8(含量为0.05%)中暗色刺参的DNA浓度为0.024 ng/μL(48.7×0.05%=0.024),此时检测得到的Ct值为33左右(见表5),与表7中浓度相仿的样品(0.01 ng/μL)相比Ct值(31.4±0.7)略升高,说明在检测海参混合样品时,检测灵敏度较检测单纯样品时有所降低。
3 讨论
在动物研究领域,线粒体基因可以作为理想的分子标记用于种质鉴定,其中COⅠ、COⅡ、12S rRNA和16S rRNA基因是应用频率最高的一组分子标记[15-17]。在棘皮动物中,COⅠ和16S rRNA基因更是被广泛应用于种群分类鉴定和系统进化研究[18-19]。收集了暗色刺参及其近似种海参的16S rRNA和COⅠ基因,但序列比对后发现16S rRNA的序列长度不一,序列间差异极大,因此较难设计合适的引物探针。比较而言,在海参中COⅠ基因信息较全,种和种之间差异也较明显,适合于设计暗色刺参特异性引物探针,如本研究中的I-fu-1和I-fu-2。同时本研究又根据暗色刺参测序得到的序列设计了引物探针组合I-fu-3、I-fu-4、I-fu-5和I-fu-6。比较各引物探针组合的特异性和灵敏度,认为引物探针组合I-fu-4的结果最佳,特别在灵敏度上明显优于特异性同样优异的I-fu-1,而I-fu-4和I-fu-1的差异仅存在于I-fu-4的下游引物中较I-fu-1少一个碱基C,同时I-fu-1探针中一个碱基G在I-fu-4中被替换成碱基A。I-fu-1根据GenBank中序列(AF486424.1、AF486425.1和AF486429.1,图2(a)—(c))设计得到,I-fu-4则根据暗色刺参样品的测序结果设计得到,这两个序列产生差异的原因,可能是测序的误差,也可能是样品序列本身变异。但测序重复3次得到的结果一致,同时实验结果显示I-fu-4的引物探针组合较I-fu-1具有更高的检测灵敏度,因此较倾向是样本序列的变异。这是否会导致在用I-fu-4检测序列和AF486424.1、AF486425.1、AF486429.1等一致的暗色刺参样本时出现假阴性?但因为本研究实际没有购买到COⅠ序列和AF486424.1一致的暗色刺参样本,因此并未能进行验证。但本研究用I-fu-1检测序列不一致的暗色刺参样本时,检测结果也并未出现假阴性,由此推测,用I-fu-4检测COⅠ序列和AF486424.1等一致的暗色刺参样本时,出现假阴性的可能性较低。此外,我们将I-fu-1和I-fu-4两组引物探针进行1∶1混合后对现有的样本进行特异性和灵敏度检测,结果显示特异性不受影响,只在目标物种中检测到阳性(结果略),灵敏度和I-fu-4的结果相近,最低能检测到0.000 8 ng/μL浓度的样品(见表7),虽然此浓度下对应的Ct值为38左右,但显示的R2为0.994 9(y=-4.206 1x+24.801),说明该Ct值仍较为可信,能较准确反应DNA的浓度,因此为了防范因引物不匹配而造成的假阴性,可采用I-fu-1和I-fu-4两组引物探针进行1∶1混合的方法进行检测。
对3种混合海参样本的检测结果表明,本方法同样适用于混合物中目标物种暗色刺参的检测。在混合样本中,掺入的是和暗色刺参同一属的墨西哥刺参以及不同属的梅花参,一般而言混合样本中,物种间的遗传距离越近,则对目标物种的检测干扰越大。如作者之前的研究发现,在黄牛、水牛和牦牛的混合肉样中检测黄牛,比在黄牛、猪、羊的混合肉样中检测黄牛的检测灵敏度会降低很多[20]。在混合物检测的结果中(见表5),即便在墨西哥刺参含量高达99.9%,暗色刺参含量低至0.05%混合样中也成功检测到了目标物种暗色刺参。同时,研究中并未再制备暗色刺参含量更低的混合样本,是认为更低的含量在实际样本中存在的可能性很小,没有实际检测的意义,本方法的灵敏度以及特异性能够满足日常鉴定检测需求。
本文的检测方法是基于暗色刺参特有的DNA序列设计的,因而即便混合物中暗色刺参含量低至0.05%也能成功检出,相比较而言,使用通用引物(如DNA条形码) 检测的方法则不适用于在多种混合物中鉴定含量较低的目标物种[21-22]。本方法和律迎春等[4-5]开发的斑点杂交法和PCR-RFLP鉴定海参的方法相比较,省却了杂交、酶切等步骤;和Wen等[7]采用的species-specific PCR方法以及Zuo等[8]采用的multiplex-PCR方法相比较,省却了电泳跑胶的步骤,与上述方法相比本方法较简单、高效、易操作。
4 结语
对濒危动植物的鉴定是对濒危动植物保护的重要环节,本文探讨了被列入CITES目录的保护动物—暗色刺参的荧光PCR鉴定方法。经验证,基于暗色刺参线粒体的COⅠ基因设计的荧光PCR引物和探针具有高特异性和高灵敏度的特性,本方法适用于在混合样本中检测暗色刺参。使用本方法可快速、精准的鉴定暗色刺参,这将有利于该物种的保护工作。

