双齿含氧配体修饰Co2(CO)8催化环氧丙(乙)烷羰化酰胺化反应制备β-羟基酰胺
郭 琳,时广辉,陈晓超,刘 晔,2
(1.华东师范大学 化学与分子工程学院 上海市绿色化学与化工过程绿色化重点实验室,上海 200062;2.崇明生态研究院,上海 202162)
0 引言
羰化反应是通过催化的方法在有机化合物分子(烯烃、炔烃、卤代烃、醇、环氧化合物等)中引入羰基制备含氧羰基化合物的一类重要反应[1].常用的羰基源为一氧化碳(CO)气体.羰化反应具有高选择性和环境友好的特点,因而备受学术界和工业界青睐.由于环氧化合物分子内的环张力具有很高的反应活泼性,环氧化合物的羰化反应产物,如β-内酯(扩环羰化反应)、聚酯(羰化开环共聚反应)、β-羟基醛(氢甲酰化)、β-羟基羧酸酯(羰化酯化反应)、β-羟基酰胺(羰化酰胺化反应)等被广泛用于药物、可降解聚合物单体的前体[2-3](图1).其中,端位环氧化合物(如环氧乙烷、环氧丙烷等)通过羰化酰胺化反应制备β-羟基酰胺的过程,因具有100%原子经济性、合成路线简捷高效、产物高附加值等优点而备受关注.在已报道的环氧化合物羰化酰胺化反应中[4-6],主要以硅烷基氨(R1R2NSiMe3)作为氨源,在八羰基二钴(Co2(CO)8)的催化作用下得到β-硅氧基酰胺,随后在酸性条件下水解,制备出目标β-羟基酰胺化合物.以硅烷基氨作为亲核试剂时,其硅基对环氧化合物中氧原子的亲和作用有利于该羰化反应在温和条件下进行,使CO的操作压力大大降低[4-8].但硅烷基氨底物种类有限、价格高昂、对水极其敏感性,这些缺点使该反应的研究和应用受到了极大的限制.与硅烷基氨相比,以廉价易得、种类多样的有机(伯/仲)胺(R1R2NH)为亲核试剂的环氧化合物羰化酰胺化反应更符合绿色化学原则.但迄今为止,环氧化合物、CO和有机(伯/仲)胺的羰化酰胺化反应未见文献报道.此外,文献工作表明,在Co2(CO)8催化的环氧化合物羰化酯化反应研究中,普遍使用含氮配体(如3-羟基吡啶[9-10]、吡啶[11-13]、吡唑[14-15])调控均相Co催化剂的活性和选择性.另外,采用含有四羰基钴阴离子([Co(CO)4]–)的离子液体代替Co2(CO)8催化剂[16-20],还可以极大地促进Co催化剂的稳定性.
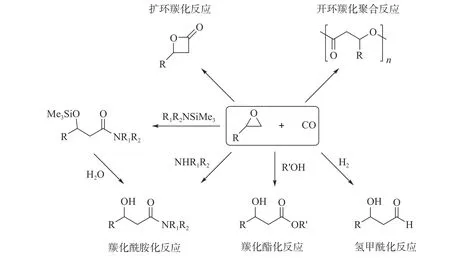
图1 端位环氧化合物的羰化反应Fig.1 Carbonylation of terminal epoxides
本文首次报道了在双齿含氧配体(L2)修饰的Co2(CO)8催化剂作用下,端位环氧化合物(如环氧乙烷、环氧丙烷等)和有机芳胺(ArNH2/ArRNH)通过具有100%原子经济性的羰化酰胺化反应,一步制备β-羟基酰胺化合物的方法.
1 实验部分
1.1 仪器与试剂
1,4-二氧六环(1,4-dioxane)、二氯甲烷、石油醚、乙酸乙酯等均为分析纯,购于国药集团试剂公司,使用前未经进一步纯化;超干四氢呋喃(tetrahydrofuran,THF)、4,5-双二苯基膦-9,9-二甲基氧杂蒽(9,9-dimethyl-4,5-bis(diphenylphosphino)xanthene,Xantphos)、三苯基膦、三苯基氧膦、8-羟基喹啉、3-羟基吡啶、环氧丙烷、环氧乙烷、苯胺、对甲苯胺、邻甲苯胺、对甲氧基苯胺、邻甲氧基苯胺、对氟苯胺、对溴苯胺、N-甲基苯胺、环己胺等均购自北京伊诺凯科技有限公司;Co2(CO)8购自中国科学院兰州化学物理研究所;柱层析使用300—400目硅胶,购自青岛海洋化工有限公司.
1.2 配体合成和均相羰化酰胺化反应操作步骤
1.2.1 双齿含氧配体L2的合成
L2配体通过双氧水氧化Xantphos(L1,9,9-二甲基-4,5-双二苯基膦-氧杂蒽)的方法合成,具体合成步骤参照文献[21-22].L2表征数据如下.1H NMR(500 MHz,CDCl3)d:7.59(d,J =7.8 Hz,2H,ArH),7.46~7.42(m,12H,ArH),7.35~7.31(m,8H,ArH),6.99~6.96(m,2H,ArH),6.86~6.81(m,2H,ArH),1.69(s,6H,–CH3).13C NMR(126 MHz,CDCl3)d:134.35,132.30,132.22,131.27,130.59,128.04,127.94,122.89,34.12,33.24.31P NMR(202 MHz,CDCl3)d:30.95(L2的1H/13C/31P NMR 表征图谱可与作者联系索取).
1.2.2 环氧丙(乙)烷和有机胺羰化酰胺化反应步骤
将苯胺(5 mmol,或其他有机胺)、环氧丙烷(7.5 mmol,或环氧乙烷)、L2(0.125 mmol)、THF(2 mL)、1,4-二氧六环(2 mL)、Co2(CO)8(0.125 mmol,在手套箱中称取)加入特制的具有聚四氟乙烯内衬胆的高压不锈钢反应釜(50 mL)中,反应釜密封后先用CO(0.2 MPa) 洗脱3次以置换出釜内空气;之后向反应釜内充入CO至压力为3.0 MPa;充气完毕后,关闭气阀并进行检漏;然后将反应釜置于油浴中加热搅拌一定时间;反应结束后,将反应釜移出油浴并置于水中冷却,待温度降至室温,缓慢打开出气阀放气泄压;当确认釜内无压力后打开反应釜,并将反应液移至容积为25 mL的玻璃样品瓶中(为保证反应液转移完全,用二氯甲烷洗涤反应釜3次,合并洗涤液于样品瓶中);然后利用气相色谱仪(gas chromatography,GC)对反应液进行定量分析(正十二烷作内标);再将样品瓶中的反应液蒸干,以石油醚/乙酸乙酯(体积比为4/1) 作为洗脱剂,通过硅胶柱分离纯化得化合物3.在3a—3i中,3e和3h为黄色油状液体,其余产物均为白色固体.反应的目标产物(β-羟基酰胺)3a—3i的核磁共振分析数据详见表1(产物3a—3i的1H/13C NMR图谱可与作者联系索取).
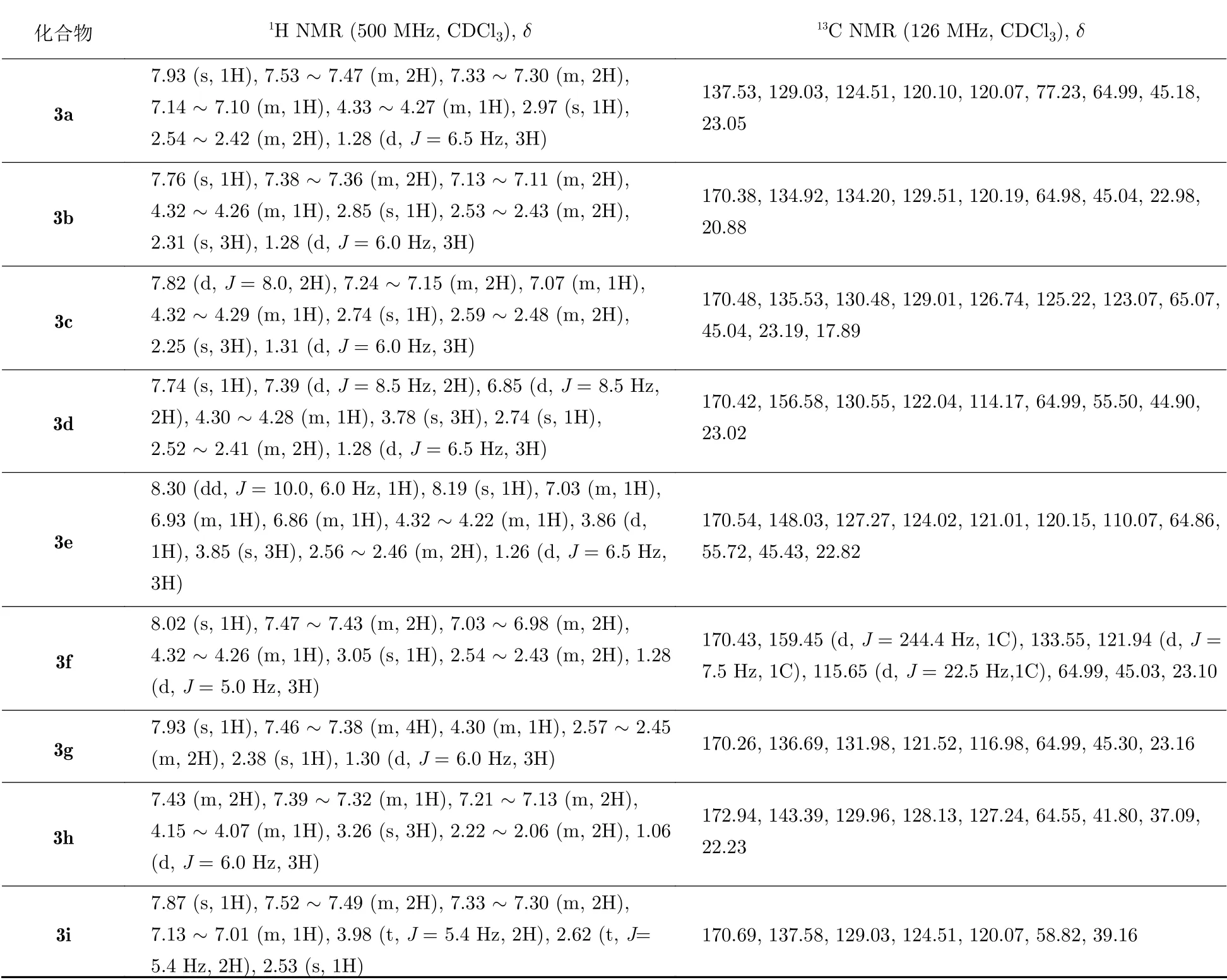
表1 反应产物3a—3i的1H NMR和13C NMR光谱表征数据Tab.1 1H NMR and 13C NMR results for products 3a—3i
2 结果与讨论
2.1 反应条件优化
首先,以Co2(CO)8为催化剂前体(nCo2(CO)8/n苯胺=2.5 mol%(摩尔百分比,下同)),考察了一系列常见膦配体和含氧/氮配体对反应的影响(表2).在不加入任何配体的条件下,苯胺的转化率为80%,但目标产物3-羟基-N-苯基丁酰胺(3a)的收率仅为41%(表2序号1).当加入膦配体,如Xantphos(L1)或PPh3(L3),虽然双齿膦配体L1可以提高底物苯胺的转化率至90%,但对目标产物3-羟基-N-苯基丁酰胺(3a)的生成没有促进效果,目标产物的收率为42%(表2序号2);而单齿膦配体PPh3(L3)的引入则进一步抑制了羰化酰胺化反应速度,导致目标产物3a的收率下降至6%(表2序号4).与膦配体L1和L3相比,采用含氧配体L2和L4(即膦配体L1和L3相应的氧化物)则能明显提高环氧丙烷羰化酰胺化反应的效率(表2序号3、序号5).尤其L2配体,在保证苯胺转化率的前提下,目标产物3a的选择性显著提高,使收率升至64%(表2序号3).另据文献报道,在环氧化合物羰化酯化反应中,N,O-杂合配体能有效促进钴催化剂的活性和选择性[23-24].受此启发,本文进一步考察了N,O-杂合配体L5和L6对反应的影响.实验结果表明,L5和L6虽然促进了苯胺的转化,但对目标产物3a的选择性和收率没有明显提升作用(表2序号6、序号7).可见,只有双齿含氧配体L2可以有效提高Co2(CO)8对羰化酰胺化反应的催化活性(表2序号3对比序号1),但反应过程中环氧丙烷和苯胺的开环加成副反应(生成副产物4a)仍普遍存在,无法完全抑制.对比L1(d=–18.10)和L2(d=29.26)配体的31P NMR分析数据,L2配体中P原子的化学位移显著向低场移动,说明L2配体中P原子不再具有σ-给电子的配位能力,是作为典型的双齿含氧配体发挥配位作用.可见,L1配体与L2配体的骨架结构虽然类似,但两者起到配位作用的原子不同.L1是典型的双齿膦配体,L2则为双齿氧配体.L1配体中具有配位能力的磷原子以C-Pσ单键方式成键,使得L1与Co-金属中心配位时,可以通过C-Pσ键的旋转形成热力学稳定的双齿膦螯合配合物,而被L1配位占据的Co-金属中心则无法及时配位活化CO底物分子,导致相应的羰化反应受到抑制;与L1相比,L2配体中具有配位能力的氧原子以P=O双键方式成键,L2与Co-金属中心配位时,不利的空间位阻效应导致P=O配位点能够及时从Co-金属中心解离,从而保证了CO底物分子的配位活化和相应的羰化反应更有利地进行.另外,L2配体作为热力学更稳定的含磷氧化物,其自身抗氧化降解能力远远优于膦配体L1,所以L2配体修饰的Co2(CO)8催化剂稳定性良好,循环使用3次后,3a的收率仍保持在55%(表2序号3).

表2 Co2(CO)8催化环氧丙烷和苯胺的羰化酰胺化反应中的配体效应条件优化Tab.2 Effect of the ligands on the Co2(CO)8-catalyzed aminocarbonylation of propylene oxide with aniline
在筛选出最佳配体L2后,以双齿含氧配体L2修饰的Co2(CO)8为催化剂(nCo2(CO)8/n苯胺=2.5 mol%),来考察不同反应条件对苯胺、环氧丙烷和CO的羰化酰胺化反应的影响.L2通过双氧水氧化Xantphos(L1)制得(见第1章实验部分).实验结果表明(表3),在四氢呋喃和二氧六环(vTHF/vdioxane=1/1(体积比))混合溶剂中,60℃下,苯胺的转化率和目标产物3-羟基-N-苯基丁酰胺(3a)收率分别为83%和64%(表3序号3),优于在单一溶剂THF(表3序号1)或二氧六环(表3序号2)中的反应结果;当反应温度从60℃升至80℃时,虽然苯胺的转化率相当(约83%),但检测到环氧丙烷和苯胺加成生成的副产物1-苯胺-2-丙醇(4a)和3a脱水的副产物5a,导致目标产物3a的收率由64%下降至57%(表3序号3对比序号5).更低的反应温度40℃则无法保证苯胺的有效转化(表3序号4),仅得到30%的苯胺转化率.另外,增加CO压力,延长反应时间或改变L2/Co的摩尔比并不能有效提高目标产物的收率(表3序号6—10).另外,表3中序号11的补充实验结果表明,在80℃、无催化剂存在的条件下,仍有60%的苯胺可以和环氧丙烷加成生成氨基醇(4a),说明该副反应是受温度控制的非催化过程.因此,较低的反应温度(60℃,表3序号3)更有利于抑制环氧丙烷和苯胺的亲核加成副反应,从而使催化剂(Co2(CO)8-L2)催化的羰化反应占据优势.综上所述,在优化出的最佳反应条件(nCo2(CO)8/n苯胺=2.5 mol%、nL2/nCo=1/1(摩尔比)、四氢呋喃/1,4-二氧六环混合溶剂、60℃、CO 3.0 MPa、6 h)下,苯胺、环氧丙烷和CO通过羰化酰胺化反应制得3-羟基-N-苯基丁酰胺(3a)的最高收率为64%;但环氧丙烷和苯胺通过开环加成生成1-苯基胺-2-丙醇(4a)的副反应过程普遍存在;该反应的区域选择性良好,环氧丙烷的开环仅发生在不带甲基取代基的碳-氧键上.

表3 L2存在下Co2(CO)8催化环氧丙烷和苯胺的羰化酰胺化反应条件优化Tab.3 Optimization of the reaction conditions for the aminocarbonylation of propylene oxide with aniline catalyzed by L2-modified Co2(CO)8
2.2 反应底物普适性和反应机理
L2配体修饰的Co2(CO)8催化剂对不同有机胺和环氧化合物(环氧丙烷或环氧乙烷)的羰化酰胺化反应的底物普适性考察结果见图2.含有不同取代基的芳香胺均适用于该反应体系.无论是苯环上含有氟、溴等吸电子基团,还是甲基、甲氧基等供电子基团的芳香胺,均可顺利地与环氧化合物发生羰化酰胺化反应,获得收率为37%~90%的目标化合物3.其中,苯环上含给电子基团的芳香胺比含吸电子基团的芳香胺对应的目标产率更高(3b、3d对比3f、3g).苯环上含邻位取代基与含对位取代基的芳香胺相比,由于邻位空间位阻效应的影响,使目标产物的收率极大降低(3b对比3c,3d对比3e).当采用二级芳香胺,如N-甲基苯胺时,目标产物3h的收率显著下降,仅为18%.此外,当采用环氧乙烷与苯胺进行羰化酰胺化反应,目标化合物3i的收率达到72%.然而,在相同的反应条件下,脂肪胺与环氧化合物无法发生羰化酰胺化反应生成相应的3j.
根据文献[26-27]报道及上述实验结果,本文提出了L2参与的Co2(CO)8催化环氧丙(乙)烷和芳香(伯/仲)胺的羰化酰胺化反应机理,如图3所示.首先在亲核试剂芳香胺和CO存在的条件下,L2配体与Co2(CO)8发生配位作用生成活性中间体H[Co(CO)2(L2)](A),A中的H质子通过氢键作用活化环氧化物的O原子,阴离子[Co(CO)2(L2)]-作为亲核试剂进攻环氧化合物C原子, 从而使环氧化合物C-O键开环断裂生成烷基Co络合物中间体(B).当底物为环氧丙烷时,不带取代基的C原子具有更强的亲电性和更小的空间位阻,所以[Co(CO)2(L2)]-阴离子只选择性地进攻不带取代基的C原子生成β-羟基丙烷基Co络合物中间体B;随后,B与Co中心原子配位的CO发生分子内迁移插入Co-C键中,同时气相CO分子再与Co进行配位,形成酰基Co络合物中间体C;最后,C和有机胺亲核试剂通过氨解反应生成目标产物3-羟基-N-芳基酰胺类化合物,并伴随活性中间体A的再生.根据此反应机理可知,当脂肪胺代替芳香胺作为亲核试剂时,一方面脂肪胺的强碱性不利于活性中间体A的生成[24-26],另一方面脂肪胺的弱亲核性也不利于其与中间体C的氨解反应,最终导致反应无法进行(图2,故无法生成目标产物3j);同理,当采用二级芳香胺,如N-甲基苯胺,其较苯胺增强的碱性和更大的空间位阻效应, 会抑制中间体A的生成和中间体C的快速氨解,从而导致目标产物3h (图2)的收率显著下降.
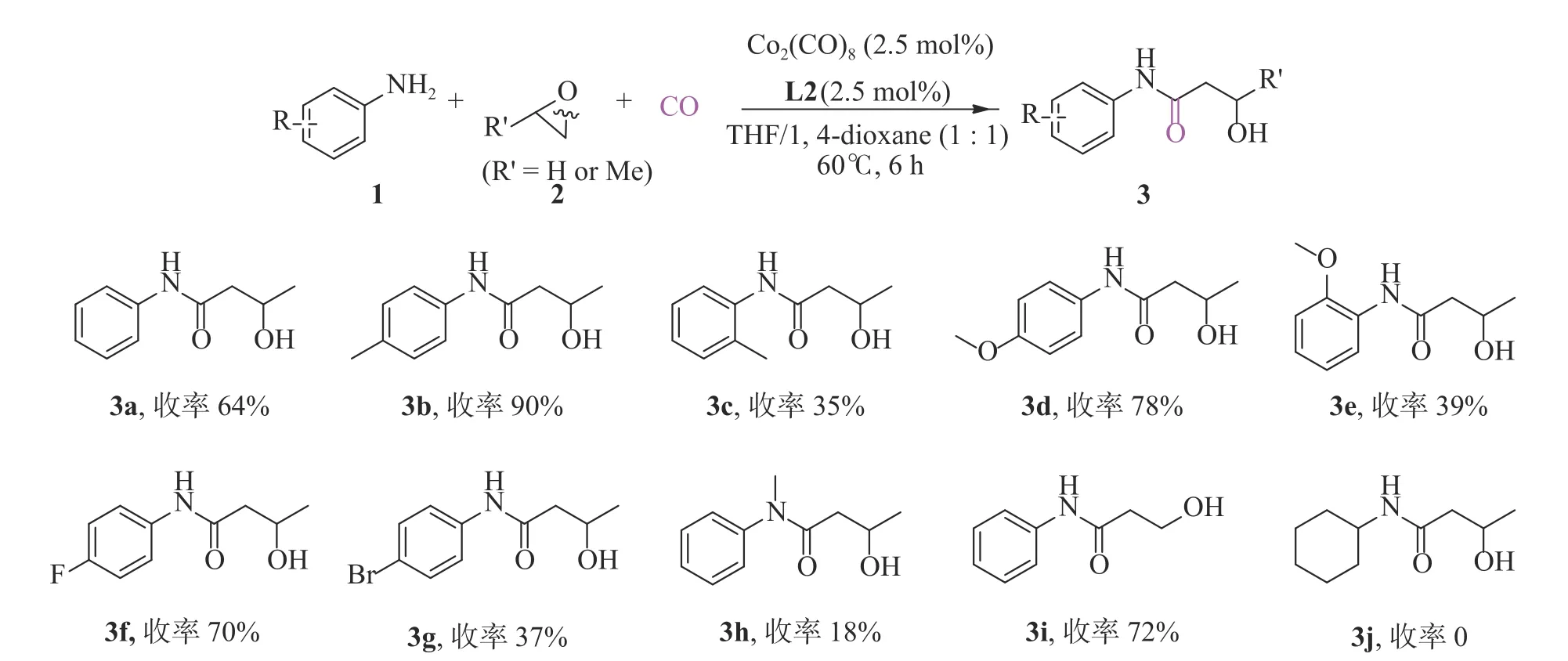
图2 底物普适性Fig.2 Substrate scope
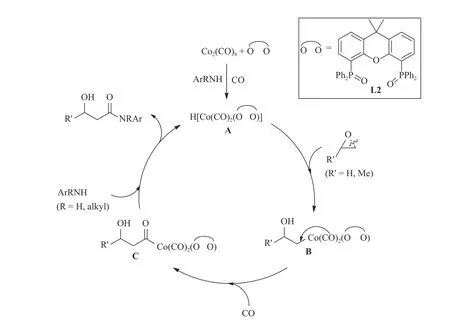
图3 L2修饰Co2(CO)8催化剂催化芳香胺、环氧化合物和CO的羰化酰胺化反应机理Fig.3 Proposed mechanism of aminocarbonylation of epoxides with aromatic amines and CO over the L2-modified Co2(CO)8 catalyst
3 结 论
在温和的条件下(60℃、CO 3.0 MPa、6 h),实现了基于含氧双齿配体L2修饰的Co2(CO)8催化环氧丙(乙)烷与芳香(伯/仲)胺的羰化酰胺化反应,提出了通过羰化酰胺化法一步合成3-羟基-N-苯基丁(丙)酰胺类化合物的方法.L2配体作为稳定性良好的双齿含氧配体,可以显著提升Co2(CO)8对环氧丙烷羰化酰胺化反应的活性和选择性,环氧丙烷的开环插羰只发生在没有甲基取代基的碳原子上.L2修饰的Co2(CO)8催化剂体系具有良好的底物普适性,一系列苯胺衍生物和环氧丙(乙)烷底物均适用于本方法,相应3-羟基-N-苯基酰胺类化合物的收率为18%~90%,底物芳香胺和环氧化合物中所含取代基的电子效应和空间效应对反应有显著影响.

