天然产物:农药新靶标与农药创制间的桥梁
房正奇,高栓虎,何海兵
(华东师范大学 化学与分子工程学院 上海市绿色化学与化工过程绿色化重点实验室,上海 200062)
0 引 言
联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)数据显示,全世界每年多达40%的农作物因虫害而损失,经济损失达700亿美元.伴随全球人口的持续增长,提高农作物产量、保证粮食安全始终是全球性的需求,发现及控制农作物病害是重要的保障措施之一[1].尽管转基因作物、生物农药等抵抗病虫害手段相继出现[2],但对于复杂地理和气候环境下的病虫害治理,化学农药仍然是最重要的手段之一.
早在1746年,人们便从烟草中分离提取出尼古丁用于虫害的防治,作为现代农药起源的标志之一.化学农药于20世纪40年代末开启了高速发展,4,4′-二氯二苯三氯乙烷(dichloro-diphenyltrichloroethane,DDT)、有机磷农药(organophosphorus pesticides,OPs)、芸苔素内酯、N-甲基氨基甲酸酯类等有机农药被合成或发现,该时代也被称为“农药发现的黄金时代”[3].然而,伴随着传统化学农药的长期大量使用,农药的抗性(resistance)、再增猖獗(resurgence)和残留(residue)问题(“3R”问题)也日益凸显.当下,对哺乳动物是否无毒或低毒,对空气、土壤、环境生物等是否友好成为新农药创制成败的关键.无论“3R”问题的解决还是作物病虫害防治的需要,新机制和新靶标的发现成为现代农药创制的基本前提.
2012年美国国家环境保护局(environmental protection agency,EPA)将所有277种常规农药的活性成分分为4类:生物类(biology,B),天然产物类(natural products,NP),合成类(synthesis,S)和合成天然产物衍生类(synthetic natural product derivatives,SND).考虑到NP、SND及B类农药均源于天然产物,合计占比达69.3%,因此,基于天然产物的研究被视为新农药创制和发展的最为重要的途径之一.而天然产物及其衍生物作为工具化合物对新农药靶点的探索和识别,则为后续农药活性分子的设计、开发提供了分子基础,是合成农药(S)与合成天然衍生农药(SND)发展的基石[4].
1 基于已知生物靶点发现的活性天然产物及农药创制
1.1 以虫体钠离子通道为靶点的化学农药发现和发展
生物体内的电压门控钠离子通道(voltage-gated sodium channel)是参与神经信号传导的重要组成部分,以它为靶点的农药能引起害虫神经膜的去极化并促进神经递质的释放,使昆虫行动失调、虫体麻痹直至死亡.早期的DDT类农药便是作用于该靶点的一种高效杀虫农药,但由于其对环境污染严重,对哺乳动物具有生殖毒性,因此被陆续禁止使用.
早在1828年,人们就已发现除虫菊的提取物具有良好的杀虫活性,该提取物后来被命名为“除虫菊酯”(图1).除虫菊酯与DDT均作用于虫体神经膜内的钠离子通道,通过抑制钠离子通道的关闭使虫体麻痹直至死亡.天然的除虫菊酯是一种理想的农药,其具有广谱的杀虫活性,且对哺乳动物毒性较低,环境危害小,在体内易降解.但由于其具有光敏性,室外环境下易分解,导致持效性差,难以在大田推广和使用.

图1 天然除虫菊酯及拟除虫菊酯的化学结构Fig.1 Chemical structures of natural pyrethrin and some synthetic pyrethroids
研究发现天然除虫菊酯的光不稳定性源于其酯的结构及三元环上的偕二甲基,为了改善其稳定性问题并提高杀虫活性,科学家们尝试对除虫菊酯的结构进行改造,获得了系列除虫菊酯类似物—拟除虫菊酯(图1)[5].1973年,Elliot首次合成了药效更强、对太阳光稳定的拟除虫菊酯、二氯苯醚菊酯(permethrin)和氯氰菊酯(cypermethrin),与有机磷和氨基甲酯类农药相比,仅需10%的剂量就能达到同等的杀虫效果[6].日本Sumitomo化学公司的Ohno等[7]研究发现偕二甲基环丙烷结构的缺失对于杀虫效果并无明显影响,于1976年成功开发出了氰戊菊酯(fenvalerate又称灭杀菊酯),其杀虫活性优于二氯苯醚菊酯.在我国,华东师范大学的顾可权等[8-12]也开发了系列具有新结构的高活性拟除虫菊酯类化合物,为我国拟除虫菊酯类农药的发展做出了卓越的贡献.
1.2 以谷氨酸门控氯离子通道为靶点的化学农药发现和发展
谷氨酸门控氯离子通道(glutamate-gated chloride channels,GluCls)仅发现于无脊椎动物,能够调控神经传导.大多数昆虫具有单一的GluCls基因,因而该离子通道是一种理想的杀虫农药靶标.阿维菌素是首个作用于该靶标的高活性农药,1976年由日本北里大学的大村智教授和Merk公司的Campbell教授从阿维菌素链霉菌中分离得到(图2),后续通过氢化阿维菌素的22、23号位的双键得到伊维菌素(ivermectin),该药物有效治愈了长时间困扰非洲的寄生虫疾病—河盲症和象皮病.大村智教授和Campbell教授也因该成就,与我国科学家屠呦呦教授共同获得了2015年诺贝尔生理学或医学奖.伊维菌素对哺乳类动物的生物毒性极低,也作为抗寄生虫兽药被广泛使用[13].
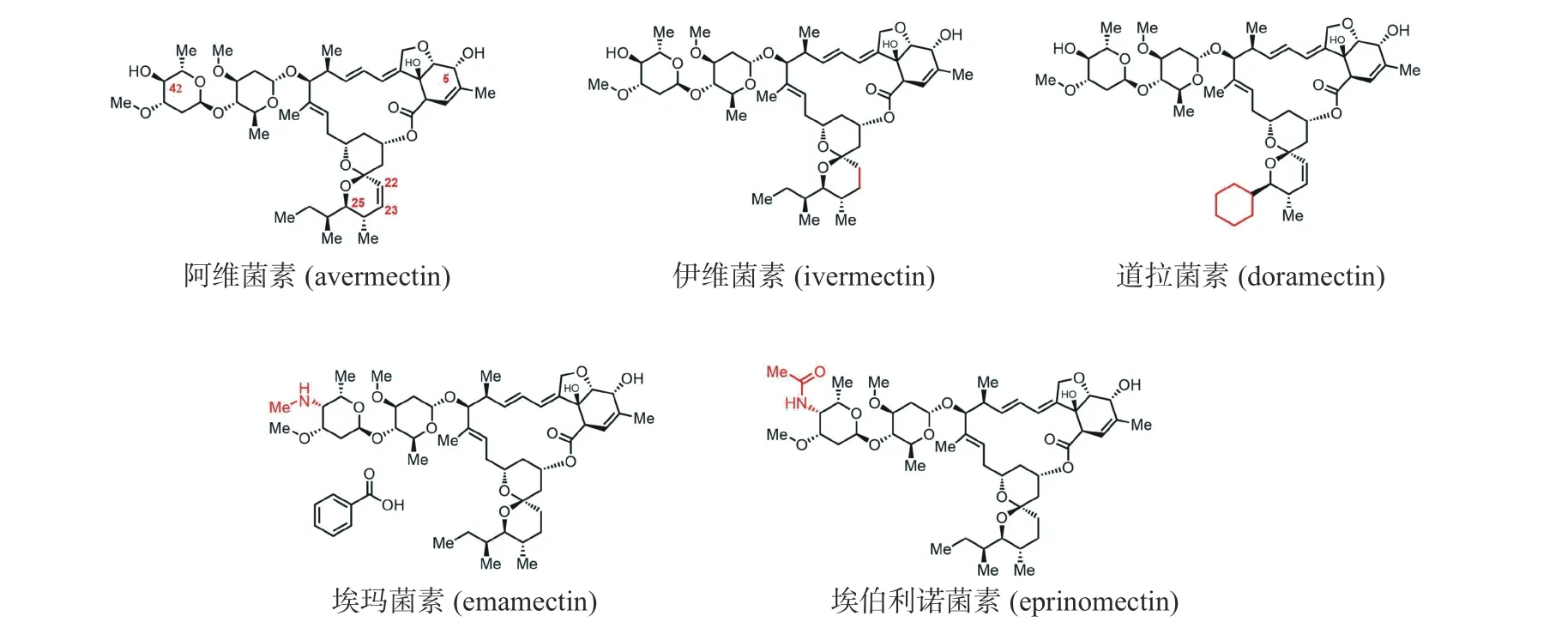
图2 阿维菌素及阿维菌素衍生物的化学结构Fig.2 Chemical structures of avermectin and its derivatives
早期的研究认为,伊维菌素作用于昆虫神经系统中的γ-氨基丁酸(γ-aminobutyric acid,GABA)受体,促进神经递质抑制剂GABA的释放,抑制昆虫神经传导,使昆虫麻痹死亡.后续Hibbs等通过伊维菌素和GluCl的复合物晶体(图3,晶体数据来自PDB(protein data bank)数据库,code:3RIA)证实伊维菌素是直接与GluCl结合,从而稳定了氯离子通道打开的构象,导致昆虫死亡[14].Hibbs还将该复合物分别与GABA和木防己苦毒素(picrotoxin,一种氯离子通道开放抑制剂)进行竞争实验,发现后两者并不能竞争掉伊维菌素与GluCl的结合,间接证明伊维菌素与GluCl的结合方式不同于GABA及木防己苦毒素.

图3 不同视图下GluCl与伊维菌素的结合位点Fig.3 Two orientation of a GluCl interface binding with ivermectin
辉瑞公司通过改变发酵工艺中阿维菌素链霉菌培养基的成分,得到了道拉菌素(doramectin,图2),与阿维菌素结构的差异在于25位的烷基链[15].该化合物对体内肠道线虫,以及体外的皮蝇,毛虱等都具有良好的杀虫活性,作为兽药上市使用.
埃玛菌素(emamectin,图2)和埃伯利诺菌素(eprinomectin,图2)是在阿维菌素的基础骨架上将4″位的羟基转变为甲氨基或乙酰胺基[16].前者的苯甲酸盐对鳞翅目和双翅目的杀虫活性比阿维菌素提高了3个数量级,具有高效、低毒、低残留等优势,广泛用于如蔬菜、棉花等作物的害虫防治.后者作为一种常用的杀虫兽药,其具有广谱、低残留的特点,并且是为数不多可以用于家畜各生长时期的杀虫剂,被广泛使用.
1.3 以保幼素受体为靶点的化学农药发现和发展
天然保幼素(juvenile hormone,图4)又称返幼激素、咽侧体激素,是昆虫发育过程中咽侧体释放分泌的一种激素,首次于1956年从天蛾蚕腹中提取得到.针对虫卵,可以抑制胚胎的发育过程;对幼虫可以增加其蜕皮次数,抑制其成虫特征的出现;针对成虫,能够控制其性发育,产生不孕现象.天然保幼素类化合物具有独特的杀虫机制,选择性高、杀虫谱广、污染小、对哺乳动物安全且不易产生抗性,是一种理想的杀虫农药[17].
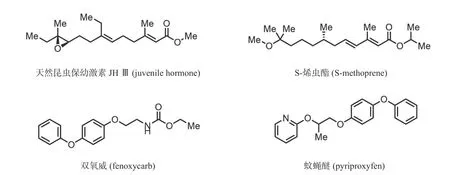
图4 以保幼素受体为靶点的化学农药结构式Fig.4 Chemical structures of pesticides targeted on juvenile hormone receptor
20世纪70年代,基于天然昆虫保幼素的结构,Zoecon公司的研究人员仿照保幼激素JH 的生物合成途径,合成了系列保幼激素分子类似物,最终开发出第一个商业化人工合成昆虫生长调节剂(insect growth regulator, IGR)—S-烯虫酯(S-methoprene). S-烯虫酯的活性是天然保幼素的近2 000倍,可以说S-烯虫酯是源于自然而优于自然的典范之一.同时,Zoecon公司的研究人员基于昆虫生物学提出了“生物合理”(biorational)的概念,以此描述烯虫酯这类高效且特异性地灭杀害虫,同时对人及其他非靶标生物又具有高安全性的杀虫剂[18].
Suzuki等通过天然保幼素结合蛋白(juvenile hormone binding protein,JHBP)的gate-open构型以及与天然保幼素(juvenile hormone,JH)结合的单晶结构(图5,晶体数据来自PDB数据库,code:2RQF)解释了其机制[19].在与JH结合后,JHBP较短的α1和α2片段与4条β蛋白片段形成包裹结构,其末端由α1的C段和α3的N端缠绕而成,而未和JH结合的JHBP则处于“开门”结构.后续的机理研究认为其存在一种“门闩机制”,在结合JH后JHBP的α1片段通过极性作用与β2片段结合,其中JH的不饱和酯进一步稳定了这样的结构.

图5 不同结合形式下JHBP的晶体结构对比Fig.5 Comparison of crystal structures of JHBP in different forms
因保幼素类化学农药优异的杀虫特异性及对哺乳动物的安全性,继S-烯虫酯后,以保幼素受体为靶点的化学农药开发受到极大关注.双氧威(fenoxycarb,图4)又名苯醚威,1982年由R.Maag公司发现,作为针对白蚁的杀虫剂批准上市.其虽具有氨基甲酸酯的结构,但对害虫肌肉神经并无毒性,而对昆虫具有高效、广谱的类保幼激素活性,如对虫卵具有灭杀作用,可抑制幼虫的生长变态,造成幼虫后期或蛹期死亡,同时对成虫的翼肌组织具有分解作用,使其因性早熟丧失生育功能.日本Sumitomo化学公司也于20世纪80年代开始研究以天然保幼素受体为靶点的“生物合理”农药,受到双氧威的启发,在保留二苯醚结构的基础上成功开发出了蚊蝇醚(pyriproxyfen,图4),其对同翅目、双翅目、鳞翅目类害虫均具有高效的杀虫活性,且对鱼类毒性低,是一种具有发展潜力的杀虫剂[20].
1.4 其他基于已知靶标的活性天然产物发现及农药创制研究示例
除上述几个示例外,基于已知靶标由天然产物衍生而来的新农药还有很多.比如通过改造自然蜕皮抑制剂得到的杀虫剂虫酰肼,其作用于蜕皮激素受体(ecdysone receptor),可诱使幼虫蜕皮过多致死[21].鱼藤酮(retenone,图6)是早期人们从鱼藤属植物中分离得到的天然产物,对多数害虫均有毒杀作用,尤其对蚜螨类害虫活性较高.其作用靶点是昆虫体内的线粒体,通过抑制昆虫的呼吸作用,阻碍昆虫体内ATP(adenosine triphosphate)的形成,最终导致害虫得不到能量供应而行动迟缓、麻痹,直至死亡.后续发展的唑螨酯(fenpyroximate,图6)也是一类以虫体内线粒体为靶点的化学农药,然而该类药物易导致鱼类中毒[22].多杀菌素(spinosad,图6)是从多刺甘蔗多孢菌发酵液中提取得到的一种大环内酯类化合物,与同为大环内酯类农药的阿维菌素类似,其对目标害虫具有神经毒杀作用,是为数不多的双靶点化学农药.其可作用于神经内的烟酸乙酰胆碱受体,也可抑制γ-氨基丁酸受体使虫体神经紊乱,麻痹死亡.或因其多靶点的特性,目前还未发现对多杀菌素有抗性的害虫[23].
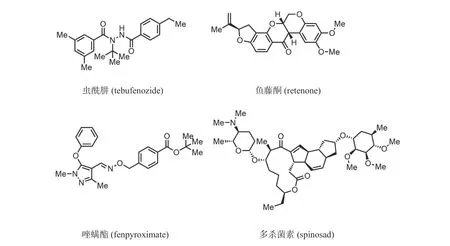
图6 部分基于生物靶标发现的化学农药Fig.6 Some pesticides discovered from biological targets
2 基于活性天然产物发现的新靶点及农药创制
2.1 基于鱼尼丁的靶标发现及农药研究进展
印第安人将一种灌木“尼亚那”(ryania speciosa)的汁液涂到箭头上用于捕猎,动物被射中后表现为抽搐直至死亡,后续的分离鉴定得到了一种名为“鱼尼丁”(ryanodine,图7)的化合物.药理研究发现其能高亲和性地与一种钙离子配体门控通道结合,该通道因而也被命名为鱼尼丁受体(ryanodine receptor,RyR)[24-25].鱼尼丁受体分布在细胞质内质网的网膜上,在与鱼尼丁作用后,该受体通道孔的有效直径会发生改变,在中低剂量时(10 nmol/L~1μmol/L),对鱼尼丁受体的离子传导具有激活作用,在高剂量下(100μmol/L),则会产生阻断作用.此外,鱼尼丁与鱼尼丁受体的结合作用还受到生物体内钙离子浓度的影响,这是由于鱼尼丁受体不同亲和部位间具有复杂的协同效应导致.昆虫的鱼尼丁受体在氨基酸序列上具有很高的同源性,而与哺乳动物之间有很大的差异.因此,选择性抑制鱼尼丁受体活性,不仅机制特殊且对非靶标哺乳动物相对安全,是一个理想的农药创制新策略.
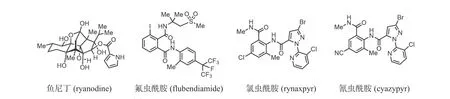
图7 以鱼尼丁受体为靶标的农药化学结构Fig.7 Chemical structures of pesticides targeted on ryanodine receptor
早在1920年人们就发现了鱼尼丁的杀虫活性,但其对哺乳动物和家畜都有较高的毒性,因而停止了使用.1989年日本大阪府立大学合成了一类吡嗪二酰胺类化合物,日本农药公司以其为模板筛选得到了一种邻苯二甲酰胺类化合物,发现这类化合物对鳞翅目类昆虫具有较好的杀虫活性.在此基础上进行一系列的修饰与改造,获得了上千个先导化合物,从中筛选得到了高活性杀虫剂氟虫酰胺(flubendiamide,图7),其对多种鳞翅目害虫的EC50在0.004~0.58 mg/L之间[26].机理研究发现,氟虫酰胺的作用靶点为鱼尼丁受体,但与鱼尼丁的作用不同的是,其与鱼尼丁受体的作用与钙离子浓度大小无关.
以昆虫鱼尼丁受体为靶标的农药的发展并没有因此而停滞,2001年杜邦公司基于日本农药公司氟虫酰胺的研究数据及后续的研究,开发出邻氨基苯甲酰胺类杀虫剂—氯虫酰胺(rynaxpyr)和氰虫酰胺(cyazypyr,图7).与氟虫酰胺相比,其更速效、残效时间更长,具有更广谱的杀虫活性,且与其他杀虫剂无交叉抗性.天津大学的尉迟之光团队,结合氯虫酰胺与鱼尼丁受体复合物晶体的结构阐明了它们之间的相互作用模式(图8,晶体数据来源于PDB数据库,code:7CF9、6M2W),氯虫酰胺与鱼尼丁受体的结合后引起R4563片段发生了约60°的偏移,且其结合后会引起鱼尼丁受体疏水端离子通道的直径从10.5(1=10—10m)增加至17.1因昆虫鱼尼丁受体杀虫剂表现出的优异性能,同类杀虫剂的研究至今依然是杀虫剂创制的热点.
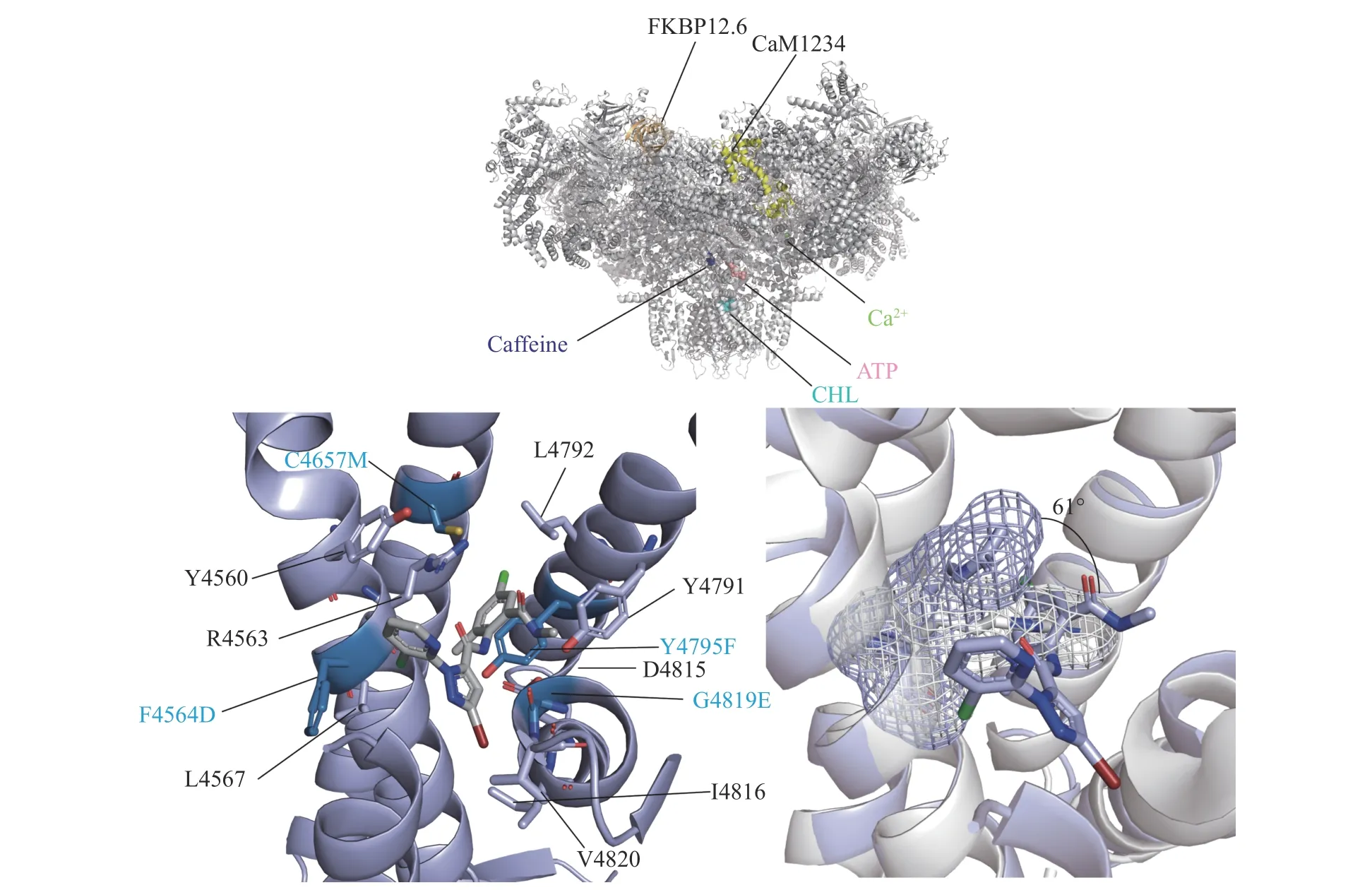
图8 氯虫酰胺与鱼尼丁受体复合物的晶体结构Fig.8 Crystal structures of RyRs in complex with rynaxypyr
2.2 基于赤霉素的靶标发现及农药研究进展
赤霉素(gibberellic acid,GA)是一种二萜类天然产物,广泛存在于植物生长茂盛部分,如茎端、嫩叶、果实种子等.赤霉素参与到大部分植物的生长过程中,最早于1926年,黑泽英一教授发现感染了赤霉菌的水稻会出现疯长的现象,至1938年住木谕介教授从赤霉菌的培养液中提取并鉴定了其活性化合物,命名为“赤霉酸”.迄今为止已有136种天然赤霉素被发现,以GA1至GA136命名,其中主要有4种赤霉素(GA1,GA3,GA4,GA7,图9)具有促进植物的生长功能,作为生长激素类农药使用.

图9 部分赤霉素的化学结构Fig.9 Chemical structures of some gibberellic acids
关于作用靶点与机制,早期部分学者认为,赤霉素与很多类固醇激素具有相似的药理,可以跨过植物的细胞膜直接作用于DNA或者RNA,影响转录和翻译.另一部分学者认为,一定存在一种赤霉素的结合蛋白,从而影响植物的生长.而此后一系列能与赤霉素结合的蛋白被发现,逐渐证实了这个观点,然而赤霉素的作用机制在当时仍未阐明.
现今,对于赤霉素的作用机制比较有说服力的论点则是GA-GID1-DELLA三聚体蛋白的形成(GA-binding protein,图10,晶体数据来源PDB数据库,code:2ZSH)[28].在细胞外GA浓度比较低时,GID1蛋白不予GA结合,此时DELLA蛋白会抑制GA应答基因的活性;而GA浓度较高时,GID1蛋白C端会与GA结合,形成疏水外围二聚体GA-GID1与DELLA结合形成三聚体,以此促进DELLA蛋白的水解.赤霉素在植物生长过程中与各类激素的协同作用表现为:赤霉素与乙烯的作用能促进作物顶端弯曲生长,与生长素和脱落酸的协同作用能促进根的向地性和种子萌发,与芸苔素内酯(一种常用的生长激素类农药)能促进作物的细胞分裂及细胞生长,促进其生长,与细胞分裂素的作用能促进作物的花青素积累与下胚轴伸张[29].

图10 GA3-GID1-DELLA复合物的晶体结构及其相互作用模型Fig.10 Crystal structure of the GA3-GID1-DELLA complex and a model of its interaction
2.3 基于章鱼胺研究的杀虫靶标的发现及相关杀虫剂研究
章鱼胺(octopamine,图11)是从章鱼的分泌物中提取得到的一种天然产物.后续证明在各类无脊柱动物体内都微量存在该胺类,并发现章鱼胺在昆虫体内扮演着类似肾上腺素的作用,负责昆虫的内分泌、代谢、兴奋等活动.其作用靶点也因而命名为“章鱼胺受体”,一种G蛋白偶联受体(G proteincoupled receptors,GPCRs).章鱼胺通过与其作用完成神经传导.该类受体在脊柱动物中尚未发现,因而,昆虫体内的章鱼胺受体近来也成为一种杀虫农药创制的重要靶标[30].
研究表明阿米曲士(amitraz,图11)是一种潜在的作用于章鱼胺受体的杀虫杀螨的农药.其能够影响昆虫的神经传导系统,导致昆虫过度兴奋死亡,但是由于其对蜜蜂具有毒性被禁止使用.不过,基于章鱼胺受体的农药发展仍然在继续[31].
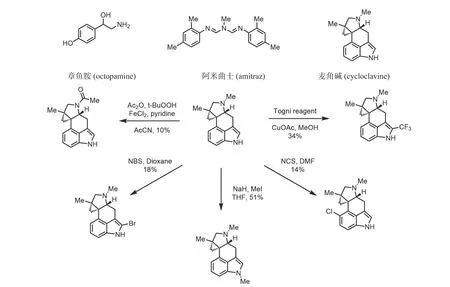
图11 针对章鱼胺受体的天然产物及其衍生物Fig.11 Natural products and derivatives targeting on octopamine receptors
麦角生物碱(cycloclavine)是由麦角菌侵害小麦、大麦等禾本科作物而产生的生物碱,作用于章鱼胺受体,具有一定的杀虫活性,但与市面主流杀虫剂相比,其活性不高.Netz等[32]对麦角生物碱的合成及衍生修饰开展了系统的研究工作:如对四氢吡咯环上N的酰化、吲哚苯环,以及吡咯环上卤代、三氟甲基化等,获得了系列结构新颖的麦角生物碱类似物(图11).然而,遗憾的是这些新化合物的杀虫活性均低于麦角生物碱本身,因此,基于麦角生物碱骨架,设计开发新的靶向章鱼胺受体的杀虫剂仍具有巨大的研究空间,同时也充满挑战.
3 总 结
天然产物因其来源多样性、结构多样性和功能多样性,源源不断地为农药创制研究带来新的机遇.天然产物不仅被用于已知农药靶标的确证或作用机制的研究,还为基于已知靶标的功能分子筛选提供了丰富的化合物库,从而得到新农药创制所需的活性分子或骨架.天然产物的重要性还在于,以它们为工具化合物的研究可能带来新农药靶标的发现,从而为全新作用机制的农药创制提供生物学基础.随着功能基因组学、蛋白组学和结构生物学的发展,天然产物仍将继续在农药靶标的发现或验证到农药创制之间发挥重要的桥梁和纽带作用.

