锰氧化物中氧空位的构建及其催化氧化苯系物作用机制研究进展
廖 伟, 陆继长, 张 迎, 刘江平, 罗永明,4, 朱文杰*
(1. 昆明理工大学 环境科学与工程学院, 云南 昆明650500; 2. 昆明理工大学 挥发性有机物污染防治与资源化省创新团队, 云南 昆明650500; 3. 云南省高校恶臭挥发性有机物控制重点实验室, 云南 昆明650500;4.昆明理工大学 化学工程学院,云南 昆明 650093)
苯系物, 即芳香族化合物(Monoaromatic Hydrocarbons), 因苯(benzene)、 甲苯(toluene)、 乙苯(ethylbenzene)、 二甲苯(xylene) 4 类为其中的代表性物质,在总挥发性有机物(total volatile organic components,TVOCs)中占据着重要的位置, 所以简称为BTEX.BTEX来源广泛[1-2], 且不同来源的组成、 特性及排放量差异较大. 释放到环境中的BTEX会在各环境介质间迁移、 富集, 进而对生态和人体健康产生众多不利影响[3]. 相关研究发现, BTEX具有神经毒性[4]、 免疫毒性[5]、 遗传毒性[6]等危害, 人体长期接触会导致患上贫血症和白血病[7], 此外, 许多BTEX具有刺激性气味, 能产生令人不愉快的感觉,对生态环境质量具有负面影响. 同时, BTEX会形成大气中光氧化剂(如O3[8]和PAN等)和二次有机气溶胶(Secondary organic aerosol, SOAs)等[9-10], 进而引发区域性环境问题.
当前, 苯系物的控制技术种类较多[11-13], 其中,热催化氧化以适用范围广、 能耗低、 二次污染少等优点被广泛应用于VOCs的治理, 而该技术的核心是高活性、 高稳定性、 高选择性的催化剂. 虽然贵金属催化剂的活性及稳定性较高, 但其价格昂贵、抗中毒性能差等缺点限制了其广泛应用. 因此, 具有价廉易得、 抗中毒性能优良、 不饱和d轨道等优点的过渡金属催化剂逐渐成为研究热点. 常见的过渡金属催化剂有Cu、 Mn、 Fe、 Co、 Ti等, 其中, 锰氧化物(MnOx)既具有非化学计量组成、 多晶型、 储氧/释氧能力强、 低成本和环境相容性等常规特点, 还具有不同的[MnO6]八面体单元三维堆积[14-15]及多晶型组合[16]、 化学缺陷的可调性、 优异的低温催化活性等重要特性, 从而在催化氧化VOCs领域具有极大的潜力.
氧空位(Oxygen Vacancy, OVs)是指金属氧化物或其他含氧化合物中, 晶格中的氧原子(氧离子)脱离, 形成的空位. 根据不同的空间位置可分为表面、次表面及体相氧空位. 研究发现, OVs能有效改善材料的物化特性, 包括对电子结构[17]、 几何结构、吸光能力[18-19]、 磁性[20-21]等特性的影响, 因而在电子、 能源、 传感器等领域倍受关注. 作为一种结构缺陷, OVs往往呈亚稳定状态, 其周围原子会通过重排来维持界面能最低的稳定态, 进而出现新的活性位点[22], 并有可能在OVs附近出现豫驰现象[23-24].通常, 锰基催化剂催化氧化VOCs遵循Marse-van Krevelen(MVK)机理, 而OVs的涌现及湮灭在整个机理中起着非常重要的作用. 其中, 带正电的OVs会引入不成对电子, 导致表面电子密度增强, 起到类似于贵金属的作用[25], 进而加快对活性氧物种的补充. 近年来, 富含OVs的锰氧化物在催化氧化VOCs领域引发了广泛的研究, 然而, 有关氧空位的构建及表征方法, 特别是锰氧化物中OVs在催化氧化BTEX中具体作用的综述论文较少. 因此, 我们总结了OVs常见的构建方法及表征技术, 阐释了锰氧化物中OVs在催化降解BTEX中的几种作用, 并对富氧空位锰氧化物在该领域的未来机遇与挑战提出了展望.
1 氧空位的构建
随着科学技术的不断发展, 有关OVs的构建方法日新月异. 目前, 催化剂中OVs的构建思路主要有掺杂异原子和去除氧原子(离子)两种.
1.1 还原法
还原法是脱除氧原子(离子)的典型方法. 气相还原主要是利用还原性气体(H2、 CO、 NH3等)处理材料, 通过控制处理浓度[26]、 处理温度[27]等参数实现不同浓度OVs的构建. 此外, 通过外加物质, 使其热解营造还原气氛[19], 也能起到类似的效果. Xu等[28]通过调节尿素和催化剂的质量比, 并在高温条件下煅烧, 既实现了铜锰复合氧化物中不同浓度OVs的构建, 又避免了尿素及其热解中间物对材料的影响. 同样的, 固相还原法是添加强还原剂(锂单质[29]、 硼氢化钠[30]等)夺取催化剂中的氧, 在室温下实现金属氧化物(MO)中不同浓度OVs的构建, 其反应机理如下:
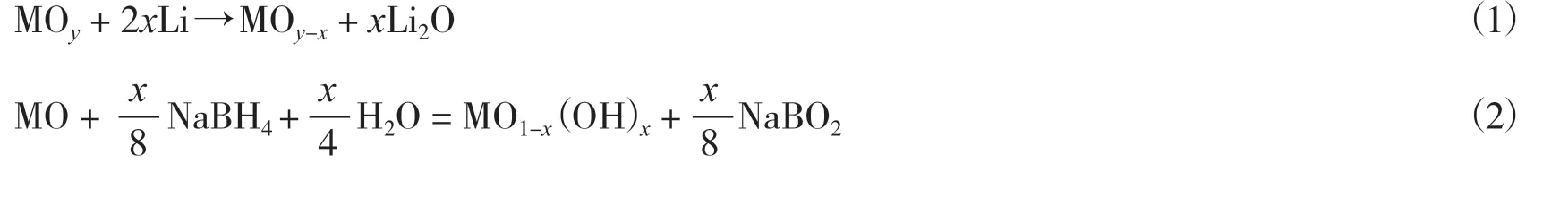
另外, 添加弱还原剂(碳粉[31]、 硫粉[32]、 抗坏血酸[33]等)并在高温条件煅烧也能夺取氧从而构建OVs. 溶剂热及水热法是液相还原法中代表性的方法, 其中, 醇类既是一种分散剂也是一种还原剂.Wu等[34]以乙二醇为还原剂, 通过溶剂-热还原方法制备了富氧空位MnO2纳米片(MnO2-PS), 其表现出最强的电子顺磁共振信号, 表明其具有最多的氧空位(图1). 与气相还原法类似, 调节反应时间[35]、 还原剂种类[36]等参数同样能实现不同浓度OVs的构建.
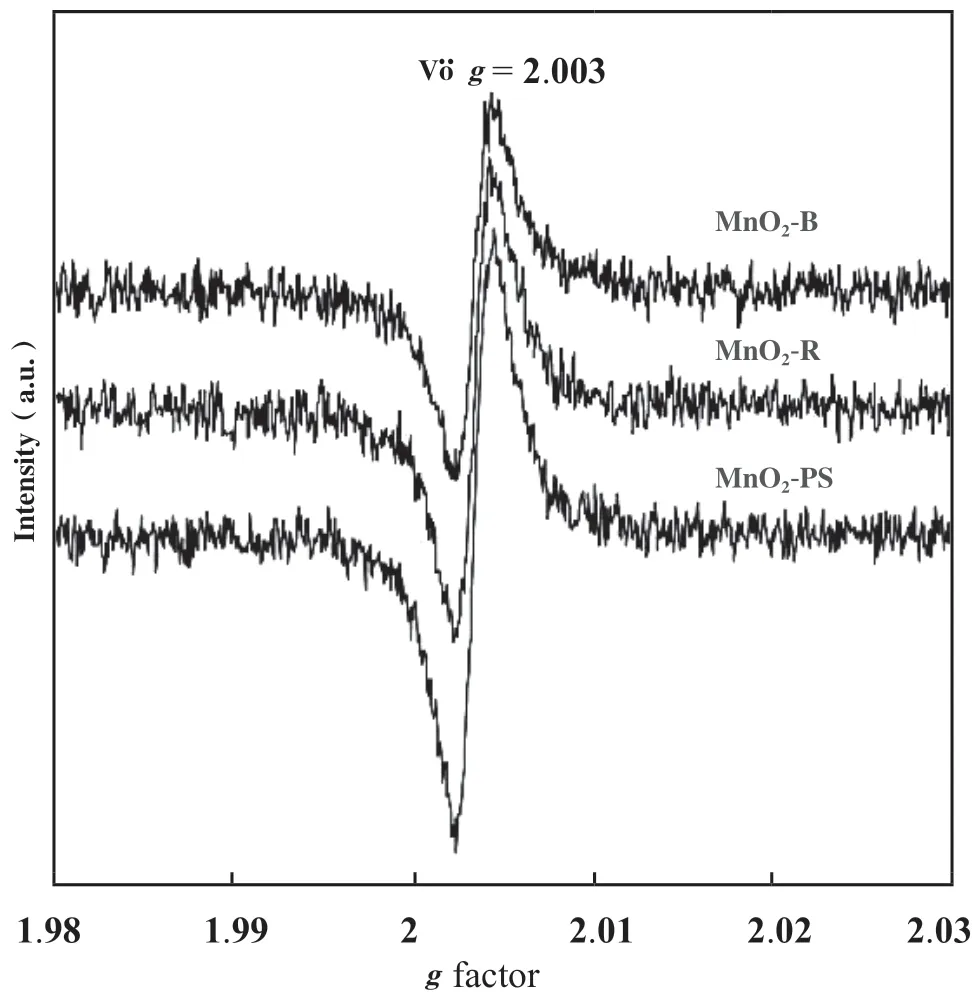
图1 MnO2-PS、 MnO2-R和MnO2-B催化剂g因子的低温EPR谱[34]Fig.1 Low-temperature EPR spectra of g factor for the MnO2-PS, MnO2-R and MnO2-B catalysts[34]
1.2 金属离子掺杂
大量的研究发现, 异金属离子掺杂不仅能增强金属间的相互作用, 促进电子转移, 还能造成晶格畸变[37-38], 打破材料的静电平衡, 促使OVs的产生[39]. Jia等[40]利用水热合成法将Fe掺入到MnO2晶格当中, 进而引入丰富的氧空位. 同样地, Gu等[41]将Ru掺杂到β-MnO2隧道结构中, 通过扩展X射线吸收精细结构发现锰价态的降低, 证明其氧配位数减少(图2), 并结合EPR证实了Ru的引入能促进β-MnO2中氧空位的产生. 虽然有研究发现OVs浓度与掺杂量呈正相关[42], 但Ren等[43]发现OVs浓度会随Ce3+掺杂量呈火山形趋势. 因此, 掺杂量和氧空位之间的相关性有待进一步证实, 但值得注意的是, OVs确实与催化性能间存在密不可分的联系[28,44].
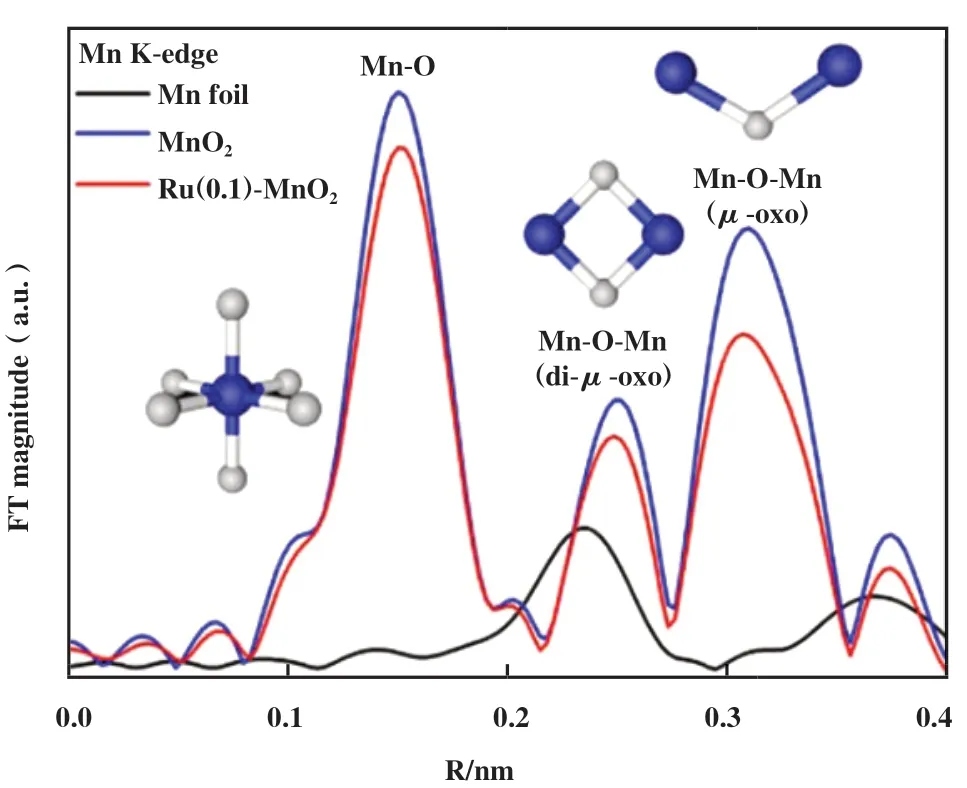
图2 Ru(0.1)-MnO2、 Mn箔和MnO2的傅里叶变换EXAFS光谱[41]Fig.2 Fourier-transform EXAFS spectra of Ru(0.1)-MnO2,Mn foil and MnO2[41]
1.3 氧分压调节
近年来, 科研人员通过调节煅烧气氛中氧分压来引入氧空位. Yang等[45]在空气、 N2和Ar气氛条件下煅烧后的锰氧化物具有不同含量的OVs. Lu等[46]通过调节不同百分比的氧分压实现了Mn3O4中的OVs浓度的调控. Fang等[47]对预煅烧样品进行二次真空煅烧, 成功地在α-MnO2中引入了氧空位. 整个过程可以用标准的Kröger-Vink符号来描述,OVs的产生及其浓度的定义方程如下[48]:

式中OL、 OVs、 CVO、 pO2、 K分别表示晶格氧、 氧空位、 OVs浓度、 氧分压和式(3)的平衡常数. 由式(4)可知, VO的浓度与O2压力呈负相关, 说明缺氧气氛下有利于VO的形成. 然而, 不同类型的惰性气氛却呈现不同的效果, 其中机理还没有得到明确的解释. 除了控制气相中的氧分压外, 营造低分压的介质也能促进OVs的形成. Wang等[49]以熔融盐法合成富氧空位的层状MnO2, 这主要是因为熔融态能提供较低的氧分压[50], 进而产生大量氧空位. 几种构建方法(还原法、 金属离子掺杂和氧分压调节)及其控制参数和优缺点, 如表1所示. 此外, 针对现有的OVs表征技术, 我们列举了扫描隧道显微镜、 X射线光电子能谱、 拉曼、 电子顺磁共振、 电子自旋共振、电子能量损失光谱、 X射线吸收精细结构、 X射线吸收近边光谱、 正电子湮灭寿命谱、 光致发光光谱的表征原理及优缺点, 如表2所示.

表1 氧空位构建方法及对比分析表Table 1 Oxygen vacancy construction method and comparative analysis table

表2 氧空位的表征技术对比分析表Table 2 Comparative analysis table of characterization techniques of OVs
2 氧空位在热催化氧化苯系物中的作用
作为一种重要的过渡金属, 锰氧化物不仅能通过上述方法构建OVs, 还能通过合成不同晶相、 不同混合晶相等方式实现各价态间的转变及OVs的引入, 进而对热催化氧化BTEX表现出积极的促进作用. 随着研究的深入, 研究人员发现锰氧化物中OVs可同时起到多种作用, 具体如下所示.
2.1 氧空位的吸附及活化作用
2.1.1 氧空位对O2的吸附及活化作用
在实际的工业应用中, 催化剂的稳定性是非常重要的一项指标, 但催化剂本身的氧物种十分有限,若没有O2的补充, 很难实现BTEX长时间的催化降解. 因此, O2的吸附及活化显得尤为重要. 相关研究发现, OVs不仅能提供O2的捕获位点, 还能促进电子转移[58]使O2活化成各类活性氧物种(Reactive oxygen species, ROS)[59-62]. 其中, 不同程度的电子转移能形成不同的氧物种[63-64], 如图3所示, 从O2到O2-再到O2-过程伴随着反应活性的不断增强. 因此, 催化剂的ROS数量与OVs浓度存在一定的关系[65], 即通过表面氧物种数量来间接判断氧空位的数量[29]. 同时, Liu等[33]和Chen等[66]通过DFT理论计算证明了OVs能降低O2的吸附能, 弱化O-O键, 进而促进其吸附及活化, 如图4(c)、( d)所示. 除此以外, Ma等[67]利用同位素氧交换和氧气程序升温脱附(O2-TPD)联合实验证明OVs不仅能促进O2形成ROS, 还能通过氧异交换反应(18O2(g)+16O(s)→16O18O(g)+18O(s))与晶格氧发生氧交换, 进而促进晶格氧物种的补充(图3). 同样地, Dong等[68]通过设计原位的程序升温实验证明了O2可以优先补充体相晶格氧, 说明OVs既能活化O2为吸附氧物种, 又能进一步活化为晶格氧物种. Huang等[69]合成了具有分级α@β晶相的纳米MnO2催化剂, 界面处丰富的OVs能有效促进O2的吸附及活化, 0.05%甲苯可在205 ℃实现完全催化氧化(图5).
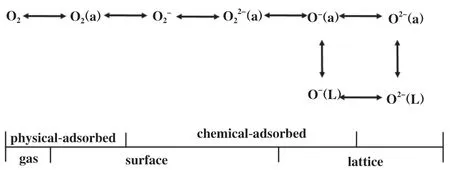
图3 氧气在锰氧化物表面的不同吸附形态[60]Fig.3 Different adsorption forms of oxygen on the surface of manganese oxide[60]

图4 α-MnO2中不含/含氧空位的晶格结构计算图[66]Fig.4 Calculation of lattice structure of α-MnO2 without/with oxygen vacancies[66]
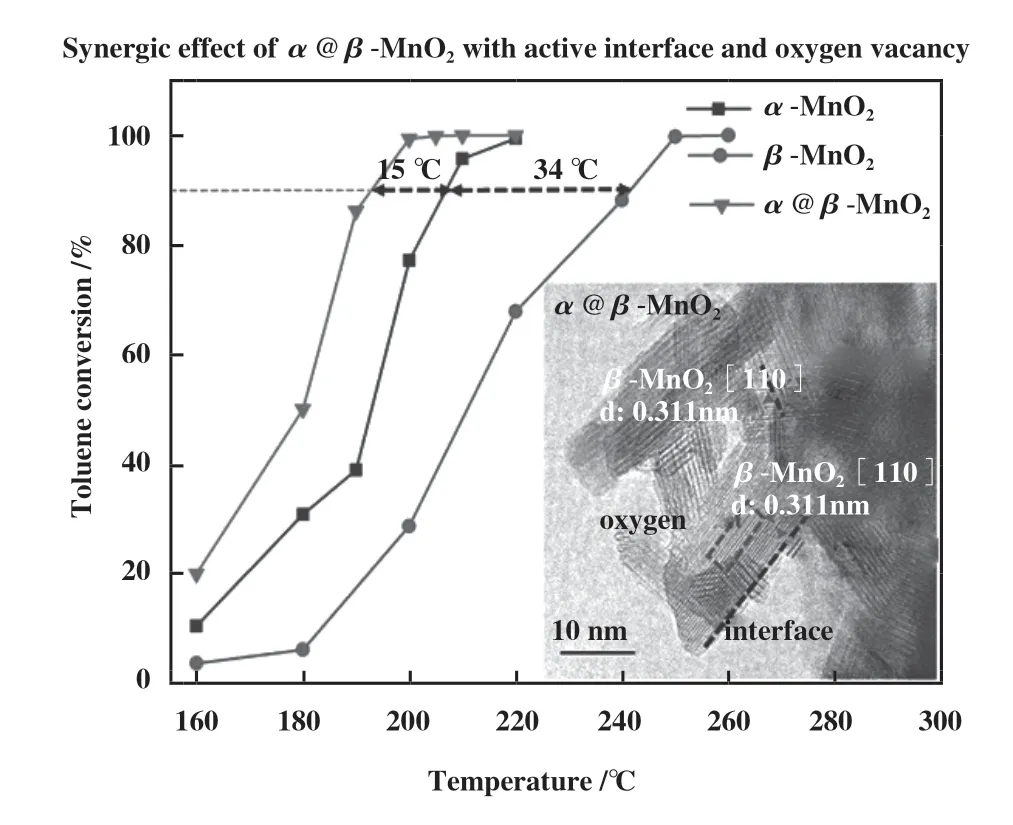
图5 3个样品甲苯氧化活性随温度变化的分布图[69]Fig.5 Activity profiles of the three samples for toluene oxidation as a function of temperature[69]
2.1.2 氧空位对水分子的吸附及活化作用
有研究发现, H2O也会被OVs活化, 形成羟基(·OH)等具有强氧化性的物种[30,70-71]. Schaub等[52]利用STM证实了在暴露于水前后, OVs和·OH存在明显关系, 说明水被OVs解离吸附, 并通过质子转移到相邻的桥接氧原子, 产生两个桥接羟基. Zhang等[72]通过H2O-TPD发现H2O能吸附到OVs上形成HOH活性位点, 并提出活性氧能和结合水形成·OH,进而促进氧化反应, 这说明H2O可以和OVs周围氧物种作用, 形成羟基. 此外, 吸附态的氧能通过氢转移反应(O2*+ H2O*→ OOH*+ OH*和 OOH*→O*+OH*)[73]形成·OH, 进而促进O2的活化. 为了探究水引入后对催化活性的影响, 他们结合原位漫反射傅里叶变换红外光谱(in-suit DRIFTS)、 C7H8-TPD、甲苯程序升温表面反应(C7H8-TPSR)、 DFT理论计算证明了水有利于O2的活化, 推动吸附氧向晶格氧的转化, 进而促进甲苯的矿化(图6). 虽然OVs活化H2O能在一定程度上提升催化剂的抗水性能, 甚至是促进催化反应, 但过量的H2O会与O2和苯系物之间存在竞争吸附[73], 进而引起催化剂失活.
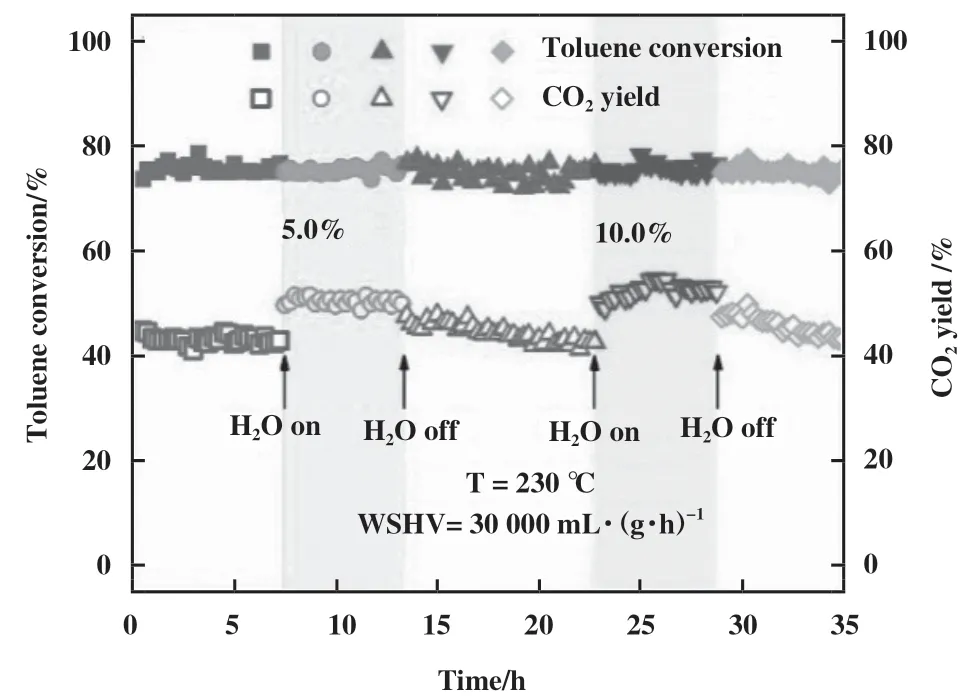
图6 230 ℃水蒸气对3Mn2Ce催化性能的影响[72]Fig.6 The effect of water vapor onto catalytic performance of 3Mn2Ce at 230 ℃[72]
2.1.3 氧空位对苯系物的吸附及活化作用
除了以上提到的两种作用外, OVs的存在还有助于BTEX的吸附[68]、 活化, 其中最合理的解释就是OVs促进ROS的形成, 并与苯系物相互作用来提升其吸附及活化性能[74]. Yang等[14]利用in-suit DRIFTS发现δ-MnO2上氧空位能吸附大量的ROS,这能促使甲苯上的甲基快速脱氢, 进而促进甲苯的吸附(图7). 同样地, Liu等[75]得出相同的结论, 在吸附及活化苯系物后, 通过不断地活化O2产生更多的活性氧物种, 促进更深度的反应, 减少中间副产物的生成, 甚至改变苯系物的降解路径[76], 最终有利于污染物的完全矿化.
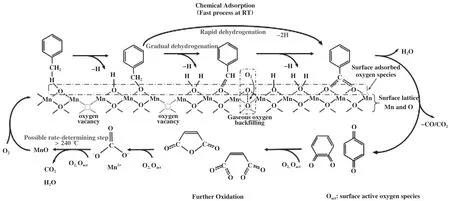
图7 甲苯在δ-MnO2上吸附和氧化的可能机理[14]Fig.7 The probable mechanisms of toluene adsorption and oxidation over δ-MnO2[14]
2.2 氧空位对晶格氧物种的活化及迁移作用
针对高分子量的BTEX, 仅利用锰氧化物的ROS能有效促进污染物的吸附及活化, 很难实现其完全矿化, 这主要是因为苯环具有相对稳定的结构, 其裂解需要严苛的条件. 同时, 从苯环裂解到实现完全催化氧化的过程中伴随着复杂的中间产物, 也因此成为了BTEX催化氧化过程中非常重要的速控步骤. 由于锰氧化物在催化氧化物VOCs的过程中遵循MVK机理, 因此充分利用晶格氧物种对BTEX的深度氧化至关重要[77-79]. MVK机理就是催化剂表面吸附的VOCs与晶格氧反应生成CO2和H2O, 同时催化剂被还原, 产生OVs, 随后气相氧补充OVs, 催化剂被氧化, 进而实现OVs的涌现-湮灭循环. 相关研究发现, OVs对晶格氧具有活化作用, 使其易于迁移至催化剂表面参与催化反应[80], 这主要是因为与OVs相邻的晶格氧可以被泵送以补充空位, 从而提高晶格氧物种的迁移率[81]. Ni等[82]证实在OMS-2中掺杂Sr2+会导致OVs的形成, 促进晶格氧的活化,进而提升对苯的催化性能, 随后利用同位素氧交换实验证实了整个反应遵循MVK机理. 随着相关研究的不断推进, 科研人员发现不同位置的OVs在催化氧化BTEX的过程中扮演着不同的角色. Su等[83]发现CeO2中表面OVs倾向于促进O2的活化和吸附氧的形成, 而体相OVs倾向于增强晶格氧物种的活性和迁移, 并在高温条件下参与污染物的进一步分解,这一点也被其它[77]研究证实, 即锰氧化物中晶格氧物种需要在高温条件下参与反应. Yang等[16]通过构建MnO2和Mn2O3的异质界面, 结合高角度环形暗场扫描透射电子显微镜(HAADF-STEM)和EELS技术对界面附近的锰原子柱间距、 锰配位(Ia/Ib)和价态(IL3/IL2)进行分析(图8), 发现界面处产生丰富的OVs, 进而提供大量吸附氧物种和冗余晶格氧. 结合in-suit DRIFTS分析反应机理, OVs吸附的活性氧物种促进甲苯的甲基脱氢和去甲基化, 形成重要的中间产物, 冗余配位晶格氧有助于增强苯环的断裂能力.
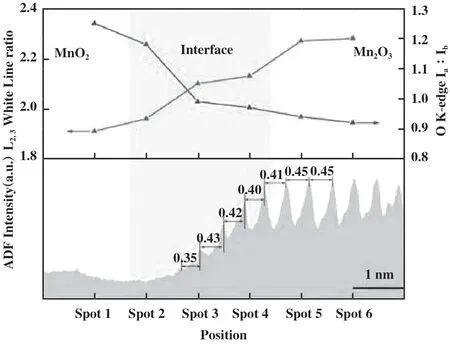
图8 O K边前峰的 Ia∶Ib和 Mn L2,3白线比与相应的 ADF 信号强度作为 T-0.5 上不同位置的函数及锰原子柱间距[16]Fig.8 Ia∶Ib of O K-edge prepeaks and Mn L2,3 white line ratio with corresponding ADF signal intensity as functions of different positions on T-0.5 and manganese column spacing[16]
2.3 氧空位调控材料价态结构的作用
由于氧元素的缺失, 催化剂整体电荷平衡被打破, 为了保持电荷平衡, 金属氧化物的价态往往会发生变化. 对于锰氧化物而言, 在光电子发射过程中, 三维电子与3s电子之间的平行自旋耦合导致Mn 3s光谱分裂, 通过测试Mn 3s多重态分裂能(ΔE), 最后根据公式(5)计算Mn的平均氧化态(Average Oxidation State, AOS). 通常情况下, 较高OVs浓度往往伴随着低价态锰物种占比的增加, 即更低的AOS, 这也间接成为氧空位构建成功的判断依据. Zhu等[84]通过向α-MnO2纳米线隧道中引入高浓度的K+, 实现了晶胞的扩张、 电荷平衡的破坏,进而导致AOS的降低及OVs的出现. 各价态锰物种的形成促进材料表面的电子转移, 提升热催化氧化性能[85-86], 同时, 更低的AOS会通过Jahn-Teller效应拉长Mn-O键, 弱化其强度[33], 如图9所示. 根据Raman的测试结果, 将638.9~655.9 cm-1范围内的拉曼位移代入胡克定律计算锰氧键合力常数, 并进一步计算平均Mn-O键长度[39], 公式如下:

图9 不同催化剂的拉曼光谱及基于胡克定律计算的Mn-O键力常数[33]Fig.9 Raman spectra of different catalysts and the calculated Mn-O bond force constant based on Hooke’s law[33]
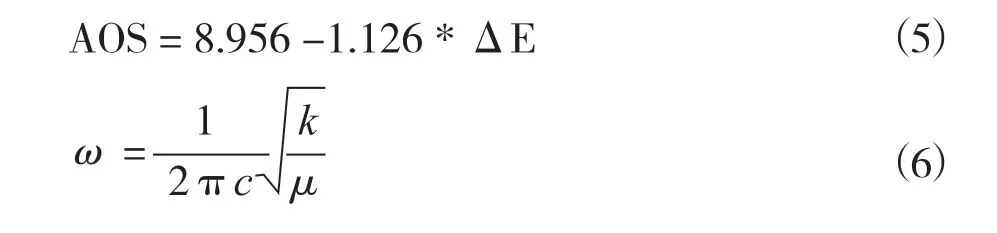

其中ω、c、μ、k、r分别代表拉曼位移、 光速、Mn-O键的有效质量、 Mn-O键常数和平均Mn-O键长度. 更弱的Mn-O键致使氧离子更容易解离和活化(图9(a), (b)), 最终导致更多的活性晶格氧参与反应[66].
综上所述, 锰氧化物种的OVs在催化氧化BTEX中起到不同的积极作用. 然而, OVs的作用可能远不止于此. 有研究提出OVs是活化的酸位点, 原子电负性的不平衡导致酸性增强[87], 进而有利于C-H键的断裂[88], 但关于锰氧化物中OVs对酸性的调节,进而影响BTEX催化氧化作用的机理还有待详细研究.
3 总结与展望
近年来, OVs被发现在催化氧化领域起到非常重要的作用, 我们虽综述了常见的OVs构建方法,包括还原法、 异金属离子掺杂、 调节氧分压等, 但OVs的具体的形成过程和部分形成机理尚未探明,仍需借助更有效的表征技术来探明, 同时, 研发更简单、 更可控的构建方法以及如何在众多方法中挑选出符合实际条件的构建方法仍需进一步探究.
锰氧化物中OVs在热催化氧化BTEX中的具体作用已有许多研究, 包括OVs对O2、 H2O、 BTEX的吸附及活化, 对晶格氧的活化及迁移, 对催化剂价态结构的影响. 然而, 锰氧化物中OVs的研究仍存在诸多机遇和挑战, 具体包括: (1) 提升催化剂的抗水性能是推进其工业应用的重要一步, 如何避免水蒸气对OVs的负面影响将会成为未来研究的热点之一; (2) 相关研究发现吸附氧物种也能促进BTEX的吸附, 而吸附氧物种并非完全由OVs产生, 因此, 不同吸附氧物种的来源及其在吸附和活化BTEX上起到的作用是否存在异同也势必存在争议; (3) 综上所述, 锰氧化物中OVs具有多种作用, 但有关众多作用之间相互关系的研究较少. 此外, 有研究发现OVs团簇的密度和大小对催化性能有直接影响, 但有关锰氧化物在此方面的研究较少; (4) 关于锰氧化物中OVs对催化剂酸性及其它特性的作用还缺乏相应的研究; (5) BTEX种类繁多, 实际工业废气也由多种VOCs组成, 而锰氧化物在协同去除多组分苯系物废气方面的研究鲜有报道, 这些都将成为未来的研究方向.

