HCN 消除反应机理的理论研究
彭国建, 杨 蒙, 王国微, 刘永军, 杨春晓, 张艳琨, 夏福婷
(云南民族大学 云南省高校民族地区资源清洁转化重点实验室, 云南 昆明 650500)
HCN是一种伴有苦杏仁味的无色液体, 极易挥发, 常温下为气态, 存在于含氰化工品的加工使用、煤的燃烧与热解、 生物质的高温热解、 废气脱硝以及矿热电炉尾气的排放等过程中, 对生态环境和人体健康具有极大的威胁[1-2]. HCN通过皮肤和呼吸系统进入人体, 阻止细胞呼吸链的电子传递, 导致细胞缺氧窒息, 严重时造成人体死亡[3-4]. 随着人们环保意识的提高和HCN排放标准的日益严格, HCN去除成为国内外科研工作者的研究热点, 关于HCN净化的实验研究和理论计算也越来越多, 脱除HCN的研究也愈加深入[5].
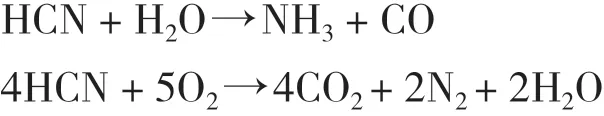
目前, 去除烟气中HCN的方法主要有吸收法[6]、吸附法[7-9]、 催化燃烧法[10]、 催化氧化法[11-12]、 催化水解法[13]等. 吸收法是工业领域中应用最广、 最成熟的技术手段, 但CN-的处理难度较大. 吸附法虽然对HCN去除非常有效, 但吸附过程存在二次污染, 且受吸附容量的影响, 限制其工业应用. 高温是燃烧法的必要条件, 需要消耗大量的能源, 增加了处理成本. 因此, 催化氧化法和催化水解法是去除HCN最有前景的方法. 催化水解法和催化氧化法净化HCN的原理如下所示:这两种方法将HCN转化为其它无毒或低毒物质, 从而净化HCN. Miyadera等[14]探究了在氧气过量的条件下, 负载了Rh、 Pd和Pt的TiO2催化剂对HCN的还原情况. 结果表明, HCN在高温下容易转化为NOx,N2产率最高为37%. 有研究证明, MnOx/TiO2-Al2O3催化剂表面吸附的H2O和羟基氧在HCN去除过程中起着重要作用[15]. 气相中水和氧气共存时, Cu-ZSM-5的HCN转化率和N2产率有了显著提高[16]. Wang课题组[17]考察了在10%相对湿度和1%氧气条件下, LaxCuy/TiO2催化剂上HCN的催化氧化和水解.研究发现, 当反应温度为150 ℃时, La1Cu9/TiO2的HCN转化率接近100%, N2选择性为62.24%, 无副产物NOx. 可见HCN的水解和氧化产生了协同效应提高了HCN转化率和N2产率. 此外, 经Cu(CH3COO)2溶液改性后的活性炭对HCN有很好的吸附性能是因为改性后得到CuO有利于形成更多的活性氧, 促进HCN的氧化-水解反应[18]. 因此, 越来越多的研究开始关注HCN氧化和水解的协同作用, 但关于HCN氧化和水解协同作用的反应机理尚不明确.与实验研究相比, 去除HCN的理论研究也越来越多[19-22]. 胡建明等[19]利用簇模型探究了HCN和HNC在Cu催化剂表面的吸附方式和成键情况. 过渡金属Fe改变了HCN的电荷分布, 加速HCN解离反应的发生[20]. 根据前人研究, HCN水解主要通过氢转移、 中间体分解等过程完成[21-22]. 然而, 目前关于HCN氧化和水解同时发生的理论研究并不多.因此, 我们采用簇模型研究了HCN的氧化和水解,并探讨了催化剂对HCN水解反应机理的影响, 以期为开发高效、 绿色的催化剂起指导作用.
1 计算方法
在B3LYP/6-31++G(d, p)水平下, 对反应体系中反应复合物(RC)、 过渡态(TS)、 中间体(INT)和产物复合物(PC)构型进行优化, Cu原子采用包含相对论校正的LANL2DZ赝势基组, H、 C、 N、 O等非金属原子采用6-31++G(d, p)基组. 以分离化合物的能量之和为零点, 对反应路径上的各驻点进行频率分析, 全实频的是稳定点, 有唯一虚频的是过渡态, 在相同水平下通过内禀反应坐标(IRC)计算,证实过渡态与反应物、 中间体和产物之间的关联性. 为获取精确的能量, 对总能量的零点能、 焓和吉布斯自由能在温度为25 ℃、 压力为0.1 MPa时进行校正. 其中△Ee表示电子能量, △E0表示零点振动能, △ETRV=△Ee+转动能, △H表示焓变, △S表示熵变, △G表示吉布斯自由能, △G≠表示吉布斯自由能垒. 上述计算全部由Gaussian03程序包完成.
2 结果与讨论
为了评估计算方法和参数的可靠性, 在B3LYP/LANL2DZ/6-31++G(d, p)水 平 下 优 化CuO、 HCN、H2O和O2的几何构型. 计算结果如图1所示. CuO中Cu-O键的键长为0.1707 nm; HCN的H-C键和CN键的键长分别为0.1070、 0.1158 nm; H2O中HO键的键长均为0.0965 nm; O2键长为0.1215 nm. 根据前人研究[23-25], 发现HCN中C-H键和C-N键的键长分别为0.1065±0.0004 nm和0.1153±0.0003 nm, H2O中O-H键的键长为0.0961±0.0005 nm, O2的键长为0.1210 nm, Cu-O键的键长为0.1789 nm.计算结果与前人研究相差不大, 表明所选的计算方法和参数是可靠的, 满足了后续的计算要求.
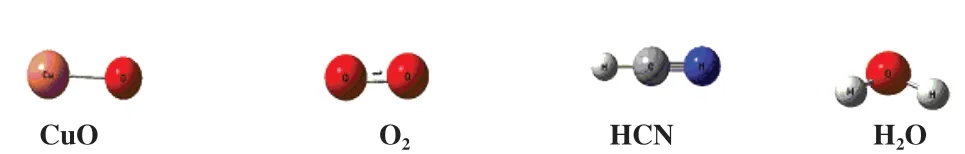
图1 CuO、 HCN、 H2O和O2在B3LYP/LANL2DZ/6-31++G(d,p)水平下几何构型Fig.1 The geometric configurations of CuO, HCN, H2O and O2 optimized at the level of B3LYP/LANL2DZ/6-31++G(d, p)
2.1 HCN直接消除反应
反应复合物(RC1)的△H为-70.67 kJ/mol, 表明HCN与O2形成反应复合物为放热过程. 在HCN的脱除过程中, HCN分子首先被氧化为HNCO, 根据HNCO所处环境的不同分为:

2.1.1 途径Ⅰ如图2 所示, O2中的两个O原子分别连接在HCN分子的N原子和C原子上, 形成能量为-29.25 kJ/mol的反应复合物RC1. 随后RC1翻越过渡态TS1,得到中间体HNCO和游离O原子. 过渡态TS1所对应的虚频值为-1455.08i cm-1, 结构特征对应着H原子朝N原子转移. 在RC1到INT1过程中, C原子与H原子之间距离从0.1080伸长至0.1298 nm; N原子与H原子之间的距离从0.2188缩短为TS1的0.1316 nm, 直至NIT1 中的0.1013 nm; N-O键从0.1415 伸长至0.1443 nm. 表明该过程发生了C-H键、 N-H键的形成和N-O键的断裂, 并伴随着133.05 kJ/mol能量的释放. 随后以HNCO为反应底物加入1分子O2优化得到INT2, 其能量为16.36 kJ/mol, 如图3所示.INT2翻越过渡态TS2得到INT3. 过渡态TS2的自由能垒为185.85 kJ/mol, 由过渡态TS2 进行频率振动分析可知, 反应过程中存在唯一虚频, 值为-504.33i cm-1. 其振动模式对应O2分子的双键变为单键, O1原子进攻C原子, O2原子进攻N原子. 根据过渡态TS2的Mulliken电荷密度可知, N原子和C原子所带电荷量分别为-0.381 e 和0.463 e, O1 原子和O2 原子电荷量分别为-0.032 e和0.036 e, C-O1 和NO2 两原子之间距离分别为0.1604 和0.2227 nm. 由库仑相互作用强度公式可知, F(C-O1)=0.005 758 k >F(N-O2)=0.002 765 k ,故C-O1 原子之间静电作用强于N-O2 原子. 在INT2 到INT3 的过程中, CO1 两原子之间的距离从0.4110 缩短为TS2 中的0.1604 nm, 当缩短为INT3 中的0.1382 nm时, 形成C-O1键; N-O2两原子之间距离从0.3722缩短为TS2中的0.2227 nm. 紧接着, INT3中游离的O2原子受静电作用力的影响朝N原子移动, 克服自由能垒为62.38 kJ/mol的过渡态TS3, 并释放出335.02 kJ/mol的能量形成结构更稳定的产物PC1. 过渡态TS3所对应的唯一虚频值为-644.63i cm-1, 结构特征为O2原子迁移到N原子上. 在INT3到PC1的过程中,N-O2 键缩短了0.0157 nm, N-H键伸长了0.0033 nm, C-N键伸长了0.1703 nm. 这些变化表明产物PC1在形成过程中, 发生了C-N键的断裂和N-O2键的形成, 且N-H键变弱.
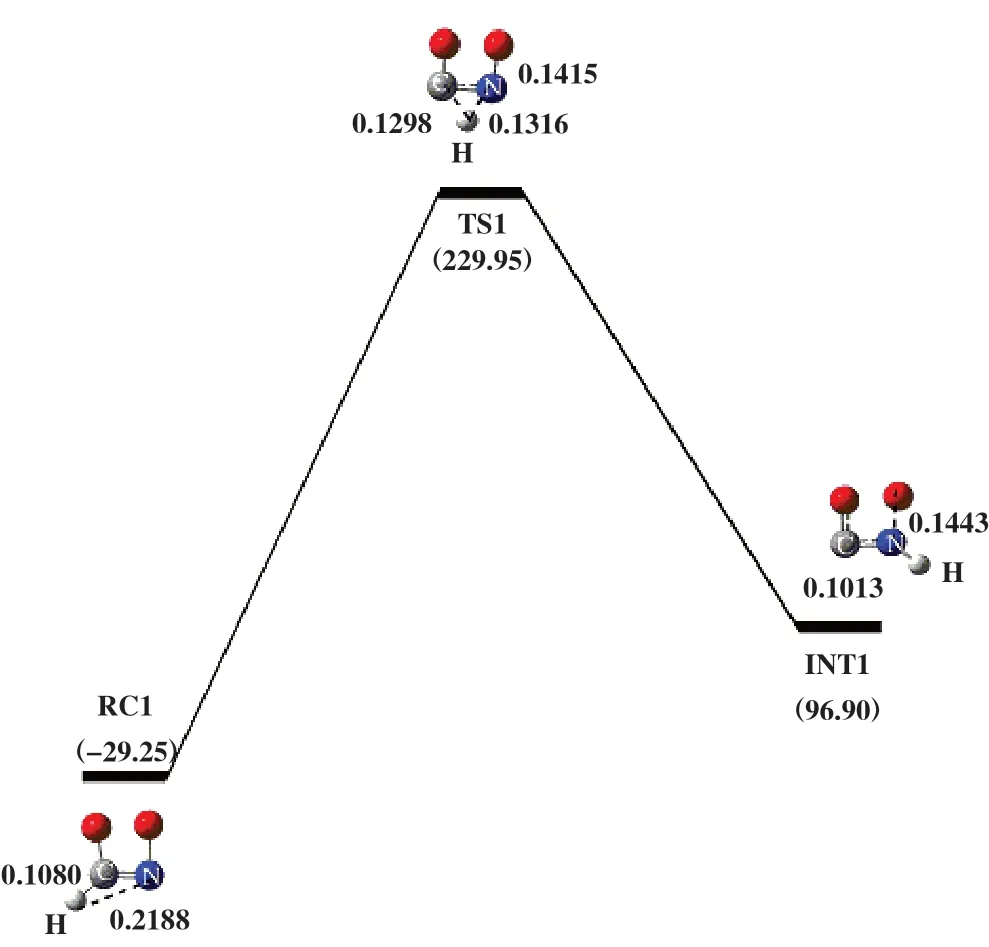
图2 在B3LYP/6-31++G(d, p)水平下计算得到的HCN+O2反应势能面图Fig.2 Potential energy surface gained at the level of B3LYP/6-31++G(d, p) for HCN+O2
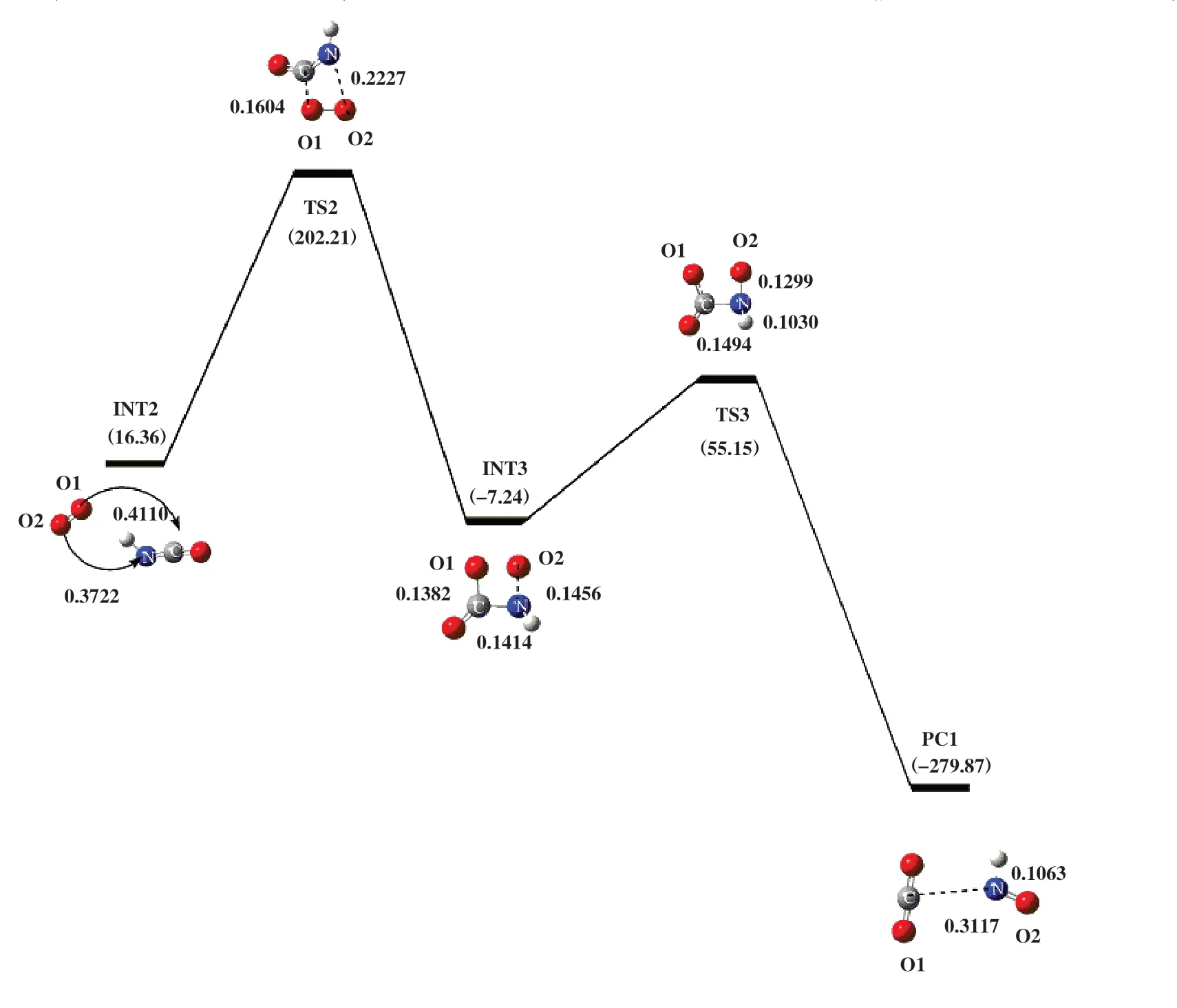
图3 在B3LYP/6-31++G(d, p)水平下计算得到的HNCO+O2反应势能面图Fig.3 Potential energy surface gained at the level of B3LYP/6-31++G(d, p) for HNCO+O2
2.1.2 途径Ⅱ
首 先, 1 分 子HCN 和1 分 子 的O2反 应 得 到HNCO, 如图2所示. 随后以HNCO为反应底物加入1分子H2O优化得到INT4, 能量为14.64 kJ/mol, 如图4所示. INT4翻越过渡态TS4得到中间体INT5, 过渡态TS4的自由能垒为169.66 kJ/mol, 所对应的唯一虚频值为-1625.13i cm-1, 其结构特征对应着O原子进攻C原子, H1原子进攻N原子. 在INT4到TS4过程中,N原子与H1 原子之间距离由0.2119 缩短至0.1301 nm, C原子和O原子之间距离由0.4060 缩至0.1742 nm. 在INT5 之后, 出现了一个连接INT5和INT6的过渡态TS5, 其虚频值为-468.95i cm-1, 振动模式对应着H2原子朝N原子的扭转. 紧接着, H2原子继续朝N原子迁移, 克服自由能垒为138.70 kJ/mol的过渡态TS6. 由过渡态TS6进行频率振动分析可知, 反应过程中存在唯一虚频, 值为-1705.46i cm-1, 结构特征为H2原子转移到N原子. 由于过渡态TS6不稳定, 释放出196.02 kJ/mol的能量得到PC2. 在INT6到PC2过程中, C-N键的键长伸长了0.1528 nm; N原子与H2原子之间的距离缩短了0.1073 nm. 这表明产物PC2的形成对应于C-N的断裂和N-H2键的形成.
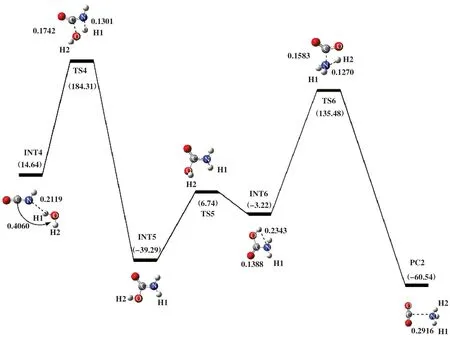
图4 在B3LYP/6-31++G(d,p)水平下计算得到的HNCO+H2O反应势能面图Fig.4 Potential energy surface gained at the level of B3LYP/6-31++G(d, p) for HNCO+H2O
如表1 所示, 途径Ⅰ的反应物RC1 的吉布斯自由能△G为-29.25 kJ/mol、 过渡态TS1 的△G为229.95 kJ/mol, INT1的△G为96.90 kJ/mol, 该步骤所对应的活化吉布斯自由能垒△G≠为259.20 kJ/mol.引入1分子的O2后发生了HNCO氧化, 这一过程分为两个步骤, 每个步骤所对应的活化吉布斯自由能垒△G≠为185.85和62.38 kJ/mol. 在途径Ⅱ中, 第一步与途径Ⅰ中的第一步完全相同, 因此该步骤所对应的活化吉布斯自由能垒为259.20 kJ/mol. 引入1分子的H2O后发生了HNCO水解, 这一过程分为3个步骤, 每个步骤所对应的活化吉布斯自由能垒△G≠分别为169.66、 46.02 和138.70 kJ/mol. 通过途径Ⅰ和途径Ⅱ的△G≠可知, 两条途径中的第一步所对应的活化自由能垒最高, 为HCN直接消除途径的速控步骤. 此外, HNCO水解所克服的活化自由能垒△G≠(169.66 kJ/mol)低于HNCO氧化所克服的活化自由能垒△G≠(185.85 kJ/mol), 可见HNCO 水解比HNCO氧化更容易.

表1 为 B3LYP/6-31++G(d, p)水平下HCN直接消除反应各驻点在气相中相对于分离反应物的能量(kJ/mol)Table 1 The energy of each stagnation point of HCN direct elimination reaction at the level of B3LYP/6-31++G (d, p)in gas phase relative to separated reactants (kJ/mol)
2.2 CuO催化HCN消除反应
据上述研究发现, HNCO的水解反应比HNCO氧化反应更容易发生. 因此, 本部分探究了CuO上HNCO水解. 同时, 为了更好地揭示HCN消除反应的过程, 本部分还研究了CuO上HCN的水解.
CuO催化HNCO水解(途径Ⅲ) :
CuO催化HCN水解(途径Ⅳ):
2.2.1 途径Ⅲ
如图5 所示, 1 分子的HCN被吸附在CuO催化剂表面, 形成吸附能为-113.43 kJ/mol的复合物RC2. RC2 翻越过渡态TS7, 得到中间体INT7. 过渡态TS7(-298.34i cm-1)所对应的自由能垒为119.45 kJ/mol, 其虚频结构特征为C原子进攻O原子, Cu原子进攻N原子. 在TS7中, C-O键长为0.2167 nm ,Cu-N键长为0.2107 nm. 与RC2比, C-O键缩短了0.2539 nm, 即C原子与O原子间相互作用大大加强.紧接着, H原子朝N原子移动, 经过渡态TS8, 得到中间体HNCO和游离的Cu原子. 这一过程需克服的自由能垒为121.96 kJ/mol. 由过渡态TS8频率振动分析可知, 其虚频值为-1540.91i cm-1, 振动模式对应于C-H键的伸长和N-H键的缩短. 随后加入1分子H2O, 以H2O和HNCO为反应底物优化得到INT9,然后出现一个连接INT9与INT10的过渡态TS9, 其虚频值为-855.61i cm-1, 结构特征为H1 原子进攻N原子和H2O分子中的O原子进攻C原子. 在INT9到TS9 的过程中, 所需克服的自由能垒为147.40 kJ/mol, H1-N两原子之间的距离从0.1924 缩短至0.1114 nm, H2O分子中的O原子到C原子的距离由0.3856缩短至0.2215 nm. 然后INT10中的H2原子发生迁移得到INT11, 其间经历具有唯一虚频且虚频值为-1817.94i cm-1的过渡态的TS10, 其结构特征对应着H2-O键的断裂. 随后INT11异构为INT12,此反应过程中存在具有唯一虚频的过渡态TS11.过渡态TS11 的自由能垒为40.84 kJ/mol, 虚频值为454.49i cm-1, 振动模式对应着H2原子的扭转. 随着H2原子朝N原子移动, 出现一个连接INT12和PC3的过渡态TS12. 对过渡态TS12进行频率振动分析可知, 反应过程中存在唯一虚频, 值为-1737.04i cm-1.在INT12到TS12的过程中, 所需克服的活化能垒为157.32 kJ/mol, H2原子到N原子的距离从0.2409 缩短至0.1.289 nm, C-N的键长由0.1352 伸长至0.1527 nm, 表明产物形成过程中, 发生的是N-H键的形成和C-N键的断裂.
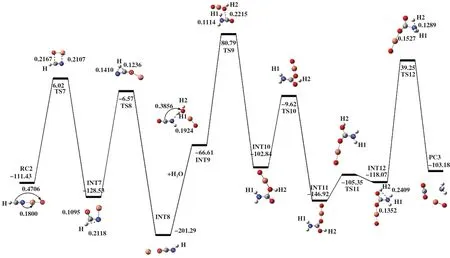
图5 在B3LYP/LANL2DZ/6-31++G(d, p)水平下计算得到的HNCO+H2O在CuO上的反应势能面图Fig.5 Potential energy surface gained at the level of B3LYP/LANL2DZ/6-31++G(d, p) for HNCO+H2O on CuO
如表2所示, 途径Ⅲ中反应复合物RC2的△G为-113.43 kJ/mol, 过 渡 态TS7 的△G 为6.02 kJ/mol, 故这一步所需的活化吉布斯自由能垒△G≠是119.45 kJ/mol. 过渡态TS8的△G为-6.57 kJ/mol, 与INT7的△G差值121.96 kJ/mol为该步骤所需的活化吉布斯自由能垒. 随后引入1分子H2O后在CuO上发生了HNCO水解, 该过程所需的活化吉布斯自由能垒△G≠分别为147.40、 93.22、 40.84和157.32 kJ/mol. 比较△G≠可知, 最后一步所对应的自由能垒最高, 为该途径的速控步骤. 通过途径Ⅲ和途径Ⅱ的△G和△G≠可知, 该途径的速控步骤的吉布斯自由能垒降低, 说明CuO的加入可以有效地降低反应所需的活化能, 对HCN净化有很好的促进作用.此外, INT9 的△G(-66.61 kJ/mol)低于INT4 的△G(14.64 kJ/mol), 表明CuO的加入有利于反应复合物(HNCO+H2O)的生成.

表2 为B3LYP/LANL2DZ/6-31++G(d, p)水平下CuO催化HNCO水解反应各驻点在气相中相对于分离反应物的能量(kJ/mol)Table 2 The energy of each stagnation point of HNCO hydrolysis reaction on CuO relative to the separated reactants inthe gas phase at the level of B3LYP/LANL2DZ/6-31++G (d, p) (kJ/mol)
2.2.2 途径Ⅳ
如图6 所示, 1 分子的HCN和1 分子H2O优化得到反应复合物RC3, 吸附能为-126.94 kJ/mol, 其中C-H键长为0.1071 nm, N-H两原子之间的距离为0.2225 nm. 随着H原子朝N原子移动, 出现一个连接RC3和INT13的过渡态TS13. 过渡态TS13的自由能垒为196.94 kJ/mol, 所对应的虚频值为-979.26i cm-1, 其结构特征对应着C-H键的断裂. 在RC3到TS13中, N-H两原子的距离缩短了0.0685 nm, CH两原子之间的距离伸长了0.0097 nm. 表明在此反应历程中没有H2O参与反应, 仅发生HCN上的异构化. 随后INT13中的O1-H1键断裂, 断裂后的H1原子和-O1H2基团分别朝HNC上的N原子和C原子移动, 形成H1-N键和O1-C键. 在该反应过程中,出现了一个有唯一虚频的过渡态TS14. 过渡态TS14的自由能垒为221.12 kJ/mol, 其虚频值为-1617.37i cm-1. 在INT13 到TS14 的过程中, O1 原子与C原子的距离由0.4565 缩短至0.1558 nm, H1 原子与N原子的距离由0.6486缩短到0.1378 nm. 紧接着, H2原子移动到靠近N原子一侧, 此反应过程存在具有唯一虚频的过渡态TS15, 其虚频值为-616.93i cm-1,振动模式对应着H2 原子的扭转. 然后H2 原子继续向N原子转移, 翻越过渡态TS16, 得到产物NH3和CO. 在该反应过程中, 过渡态TS16 的唯一虚频值为-1728.45i cm-1, 自由能垒为150.88 kJ/mol. 在INT15到TS16的过程, H2原子和O1原子之间的距离由0.0977 伸长为0.1273 nm; C-N键从0.1332 伸长为0.1524 nm. 表明在产物的形成过程中发生了C-N键的断裂和N-H键的形成.
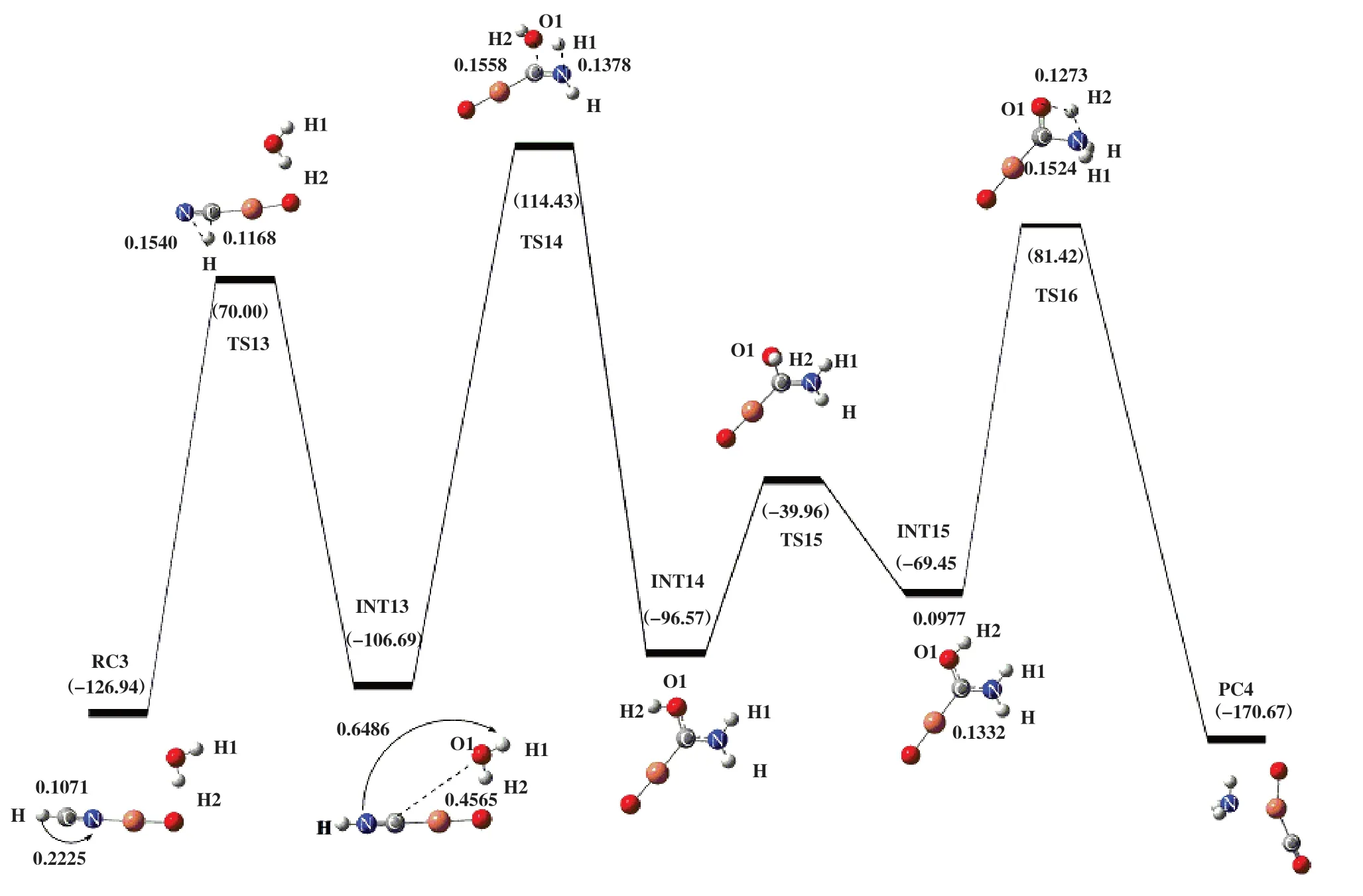
图6 在B3LYP/LANL2DZ/6-31++G(d, p)水平下计算得到的HCN+H2O在CuO上的反应势能面图Fig.6 Potential energy surface gained at the level of B3LYP/LANL2DZ/6-31++G(d, p) for HNCO+H2O on CuO
如表3 所示, 途径Ⅳ中的反应复合物RC3 的△G为-126.94 kJ/mol, 过渡态TS13的△G为70.00 kJ/mol , 中间体INT13 的△G为-106.69 kJ/mol, 该步骤所需的活化吉布斯自由能垒△G≠为196.94 kJ/mol. 后面三步所对应的活化吉布斯自由能垒为221.12、 56.61和150.88 kJ/mol. 由途径Ⅳ中的△G≠可知, 第二步所对应的吉布斯自由能垒最高, 为该途径的速控步骤. 与途径Ⅲ相比, 速控步骤的活化吉布斯自由能垒明显增加, 表明HNCO是HCN消除过程中的重要中间体.

表3 为B3LYP/LANL2DZ/6-31++G(d, p)水平下CuO催化HCN水解反应各驻点在气相中相对于分离反应物的能量(kJ/mol)Table 3 The energy of each stagnation point of HCN hydrolysis reaction on CuO relative to the separated reactants at the level of B3LYP/LANL2DZ/6-31++G (d, p) in the gas phase (kJ/mol)
3 结论
采用密度泛函理论研究了HCN消除反应机理,并探究了CuO对HCN消除机理的影响. 通过反应过程中各驻点的能量、 键长以及分子振动状态可知,途径Ⅲ的速控步骤自由能垒最低, 比HNCO直接水解(169.66 kJ/mol)和CuO上HCN水解(221.12 kJ/mol)低了12.34、 63.8 kJ/mol. 说明HNCO是HCN净化过程中的重要中间体, CuO的加入有效地降低了反应活化能垒, 有利于HCN的消除, 将为HCN消除反应高效催化剂的寻找和开发奠定理论基础.

