甲泼尼龙、盐酸氮芥冲击疗法治疗IgA肾病的临床效果及安全性评价*
傅奕 马伟 李鑫 魏林 宗海涛 吴兆东 陈帮明 付义 伍宏泽
免疫球蛋白A(immunoglobulin A,IgA)肾病是以IgA 沉积在肾小球系膜区为主要特征,常伴内皮增生和足细胞损伤的自身免疫疾病。据统计,中国IgA 肾病发病率约为原发性肾小球肾损害的32%~54%,约四成患者在病程20 年左右进入终末期肾病[1]。当前,IgA 肾病治疗仍旧以控制血压、降尿蛋白、给予激素及免疫抑制剂等为主,虽可延缓疾病进展,但药物不良反应也限制了其临床疗效[2]。
江西省中医肾病临床医学研究中心/九江市中医院肾病中心团队通过潜心研究IgA 肾病的免疫机制,独创甲泼尼龙、盐酸氮芥方案进行治疗。前期研究证实该方案对于慢性肾小球肾炎[3]、狼疮性肾炎[4]、难治性肾病综合征[5-6]均有明显效果,为推广其临床应用并进一步探索该方案对于IgA 肾病的作用机制,本研究拟采用随机、平行、对照方法,系统评价甲泼尼龙、盐酸氮芥冲击疗法治疗IgA 肾病的临床效果与安全性,为其临床应用提供科学的试验依据。
1 资料与方法
1.1 一般资料 选择2019 年1 月-2020 年2 月在江西省中医肾病临床医学研究中心住院的120 例IgA 肾病患者。IgA 肾病诊断标准:IgA 肾病的诊断标准参考文献[7]《肾脏病学》,IgA 肾病是指肾小球系膜区以IgA 或IgA 沉积为主的原发性肾小球疾病,排除肝病、过敏性紫癜等继发性IgA 沉积的疾病。慢性肾脏病分类标准参照KDIGO 指南[8]。纳入标准:(1)符合IgA 肾病及慢性肾脏病(chronic kidney disease,CKD)Ⅰ、Ⅱ期的西医诊断;(2)年龄18~60 岁;(3)近3 个月未使用类固醇类激素及免疫抑制剂类药物;(4)经过血管紧张素Ⅱ受体拮抗剂(ARB)/血管紧张素转换酶抑制剂(ACEI)类药物治疗6 个月后24 小时尿蛋白定量>1.5 g。排除标准:(1)合并严重原发性疾病,影响试验疗效;(2)试验前6 个月内应用过其他细胞毒性药物治疗;(3)伴有严重感染、活动期结核、恶性肿瘤、人类免疫缺陷病毒感染、乙型病毒性肝炎病毒HBsAg、HBeAg 和抗HBcAg 阳性或HBsAg、HBeAb、抗HBcAg 阳性;(4)免疫功能低下,血WBC 计数<4.0×109/L;(5)妊娠期、哺乳期妇女。中止与终止试验标准:(1)试验中发生严重不良事件,应及时中止试验;(2)试验中出现短期血清肌酐快速上升;(3)试验中患者进入肾脏替代治疗。随机分配为治疗组(60 例)和对照组(60 例)。本研究方案经医院医学伦理委员会审核通过,患者自愿参与且签署知情同意书。
1.2 方法 基础治疗:包括低盐饮食,同时给予血管紧张素转换酶抑制剂类药物,口服奥美沙坦酯(生产厂家:南京正大天晴制药有限公司,批准文号:国药准字H20140054,规格:20 mg)20 mg/次,1 次/d 降压,降尿蛋白,保护肾功能,防止感染,护肝,防止并发症,支持对症治疗。
对照组在基础治疗上给予醋酸泼尼松(生产厂家:安徽金太阳生化药业有限公司,批准文号:国药准字H34021846,规格:5 mg)1 mg/(kg·d),清晨口服,2 个月后减量,每周递减0.1~0.4 mg/(kg·d)时,不再减量,共用药12 个月。
治疗组在对照组的基础上施予甲泼尼龙、盐酸氮芥冲击治疗方案。甲泼尼龙(生产厂家:Pfizer Manufacturing Belgium NV,注册证号:国药准字HJ20170199,规格:500 mg)4 mg/(kg·d),不超过500 mg/d,加入5%葡萄糖注射液200 mL 中静滴,1 次/d,共4 d;盐酸氮芥(生产厂家:上海旭东海普药业有限公司,批准文号:国家准字H31020897,规格:1 mL∶5 mg)0.08 mg/(kg·d),不超过5 mg/d(白细胞小于4×109/L 则暂缓使用)静脉推注,1 次/d,共4 d;降纤酶(生产厂家:北京赛升药业股份有限公司,批准文号:国家准字H11022187,规格:5 IU)0.05~0.1 IU/(kg·d),不超过5 IU/d,加入10%葡萄糖200 mL 静滴,1 次/d,共4 d;配合止吐、升白细胞、补钙等对症治疗。连续4 d 为1 个疗程,常规使用2 个疗程,疗程间隔8~14 d。2 个疗程之间、之后予甲泼尼龙(生产厂家:天津天药药业有限公司,批准文号:国家准字H20020224,规格:4 mg/片)20 mg,1 次/d,维持同时逐渐减量。如果病情缓解,则依次间隔1、3、6 个月再巩固治疗3 次,每次治疗1 个疗程即可,疗程间期以甲泼尼龙片维持(第1 周4 片/d,以后每周减服1 片)4 周后停服。共用药12 个月。
1.3 观察指标与判定标准(1)检测并记录两组治疗前后24 小时尿蛋白、尿素氮(BUN)、血清肌酐(Scr)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、血清白蛋白、纤维蛋白原(fibrinogen,FIB)、白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)。(2)血常规(白细胞计数)、肝功能(谷草转氨酶、谷丙转氨酶)、CD4+、CD8+、CD4+/CD8+,每月检测1 次,记录服药情况及不良反应发生情况。(3)疗效标准。显效:24 小时尿蛋白降低≥50%;有效:30%≤24 小时尿蛋白<50%;无效:24 小时尿蛋白下降<30%或持续升高[9]。总有效=显效+有效。
1.4 统计学处理 采用SPSS 25.0 统计软件包进行统计学处理和分析,计量资料采用(),组间比较采用独立样本t 检验,组内比较采用配对t 检验;计数资料以率(%)表示,比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较 治疗组Ⅰ期18 例,Ⅱ期42 例;男36 例,女24 例;年龄(47.2±16.7)岁;病程1 年~10 年,平均(8.3±3.2)年。对照组Ⅰ期16 例,Ⅱ期44 例;男40 例,女20 例;年龄(45.6±16.7)岁;病程1.1 年~11 年,平均(8.4±3.6)年。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组24 小时尿蛋白、BUN、Scr 比较 治疗前,两组24 小时尿蛋白、BUN、Scr 比较,差异均无统计学意义(P>0.05)。治疗后,两组24 小时尿蛋白、BUN 均较治疗前降低,且治疗组较对照组低(P<0.05)。治疗组治疗后Scr 低于治疗前,对照组治疗后Scr 高于治疗前(P<0.05)。见表1。
表1 两组24小时尿蛋白、BUN、Scr比较()

表1 两组24小时尿蛋白、BUN、Scr比较()
*与对照组比较,P<0.05;#与治疗前比较,P<0.05。
2.3 两组血清白蛋白、TG 及TC 比较 治疗前,两组血清白蛋白、TG 及TC 比较,差异均无统计学意义(P>0.05);治疗后,两组TG 及TC 均较治疗前降低,且治疗组较对照组更低;两组血清白蛋白均较治疗前升高,且治疗组较对照组更高(P<0.05)。见表2。
表2 两组血清白蛋白、TG及TC比较()
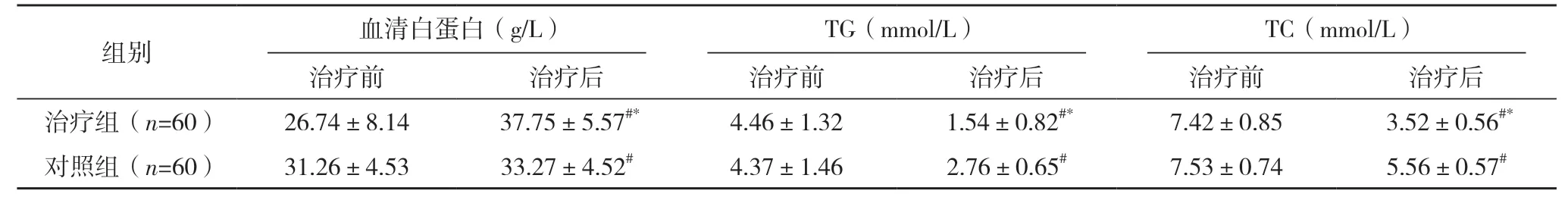
表2 两组血清白蛋白、TG及TC比较()
*与对照组比较,P<0.05;#与治疗前比较,P<0.05。
2.4 两组IL-6、TNF-α、FIB 比较 两组IL-6、TNF-α、FIB 比较,差异均无统计学意义(P>0.05);治疗后,两组IL-6、TNF-α、FIB 均较治疗前降低,且治疗组均较对照组更低(P<0.05)。见表3。
表3 两组IL-6、TNF-α、FIB比较()

表3 两组IL-6、TNF-α、FIB比较()
*与对照组比较,P<0.05;#与治疗前比较,P<0.05。
2.5 两组白细胞计数、肝功能比较 治疗前,两组白细胞计数、谷草转氨酶、谷丙转氨酶比较,差异均无统计学意义(P>0.05);治疗后,治疗组白细胞计数较对照组高,谷丙转氨酶及谷草转氨酶均较对照组低(P<0.05)。见表4。
表4 两组白细胞计数、肝功能比较()

表4 两组白细胞计数、肝功能比较()
*与对照组比较,P<0.05。
2.6 两组CD4+、CD8+及CD4+/CD8+比较 治疗前,两组CD4+、CD4+/CD8+、CD8+比较,差异均无统计学意义(P>0.05);治疗后,治疗组CD4+、CD4+/CD8+均较对照组高,CD8+均较对照组低(P<0.05)。见表5。
表5 两组CD4+、CD8+及CD4+/CD8+比较()

表5 两组CD4+、CD8+及CD4+/CD8+比较()
*与对照组比较,P<0.05。
2.7 两组疗效比较 治疗组总有效率为88.33%,对照组总有效率为68.33%,治疗组总有效率高于对照组(χ2=7.07,P<0.05),见表6。

表6 两组疗效比较[例(%)]
2.8 两组不良反应发生情况比较 治疗组6 例出现恶心呕吐,2 例出现感染,不良反应发生率为13.33%(8/60);对照组2 例出现头晕不适,5 例出现感染,不良反应发生率为11.67%(7/60)。两组不良反应发生率对比,差异无统计学意义(χ2=0.08,P>0.05),两组发生不良反应患者经对症治疗后均好转。
3 讨论
甲泼尼龙、盐酸氮芥冲击疗法是江西省肾病研究中心/九江市中医院肾病中心治疗免疫性肾脏疾病常用治疗方案。甲泼尼龙是常用糖皮质激素,短期大剂量使用可迅速发挥抗炎、免疫作用[10]。盐酸氮芥是细胞毒性药物,常用于慢性肾病治疗,但其具有较强的局部组织刺激性,易导致药源性血管炎、胃肠道反应及骨髓抑制等不良反应而限制了其临床应用[11]。有研究显示,大剂量糖皮质激素联合盐酸氮芥短程冲击治疗慢性肾炎后,给予小剂量激素维持,可显著减少激素和盐酸氮芥的不良反应,减少病情反复,缩短疗程[3]。尿蛋白作为IgA肾病病情进展的危险因素,对于24 小时尿蛋白>1 g的患者推荐使用类固醇激素和免疫抑制剂治疗,可有效减少24 小时尿蛋白并改善肾功能[12-13]。本研究治疗前患者24 小时尿蛋白>1.5 g,提示患者处于中等至大量水平[4]。经甲泼尼龙、盐酸氮芥治疗12 个月后,患者24 小时尿蛋白为较对照组显著下降,且血清白蛋白也显著上升,提示甲泼尼龙、盐酸氮芥冲击疗法可有效控制24 小时尿蛋白。BUN、Scr 是常见的评估肾损伤程度的重要指标,也是评价肾功能修复的核心指标。本研究显示,治疗组BUN、Scr 均低于对照组(P<0.05),提示甲泼尼龙、盐酸氮芥冲击疗法具有保护IgA 肾病肾功能的作用。
IL-6 可启动炎症和免疫反应,刺激免疫复合物和补体成分沉积,致系膜基质增生、足细胞损伤[14]。TNF-α 由单核细胞/巨噬细胞分泌,在黏膜组织中发挥促炎作用,破坏血管内皮,促进肾小球系膜细胞增殖[15]。研究结果显示,两组治疗后IL-6、TNF-α 水平均有下降,治疗组较对照组更低,提示甲泼尼龙、盐酸氮芥冲击疗法可有效抑制炎症。IgA 肾病持续漏出尿蛋白,刺激系膜增厚、基底膜通透性增加,可诱发高脂血症[16];TG 可作为IgA 肾病疾病进展的独立危险因素[17];TC 可损伤足细胞,加重尿蛋白[16]。两组治疗后TC、TG 均有下降,治疗组TC、TG 水平明显低于对照组,提示冲击治疗可有效调节IgA 肾病血脂代谢。FIB 参与了系膜增生、肾小球硬化等,与IgA 肾病进展息息相关[18]。经治疗后,两组FIB 均较治疗前显著降低,且治疗组较对照组降低更显著,提示,冲击治疗可显著改善FIB。综上,提示甲泼尼龙、盐酸氮芥可通过调节免疫、抑制炎症、调节血脂、改善高凝等从而治疗IgA 肾病。
IgA 肾病作为免疫复合物介导的肾小球肾炎,临床上对于中等量及以上尿蛋白患者治疗多采用类固醇激素长期口服(大于6 个月),然而长期口服激素显著增加了严重风险发生率,特别是重症感染[19]。Meta 分析表明,激素类药物联合免疫抑制剂疗效更好,安全性更佳[20]。本研究安全性评价显示,治疗组白细胞计数、CD4+、CD4+/CD8+较对照组高,AST、ALT、CD8+均较对照组低,提示甲泼尼龙、盐酸氮芥不仅可以调节T 淋巴细胞亚群,且对自身免疫系统的抑制作用较对照组弱。研究结果表明,两组不良反应发生率对比,差异无统计学意义(P>0.05),提示间歇使用冲击治疗不仅可提高临床疗效,且不增加毒副作用。
综上所述,甲泼尼龙、盐酸氮芥冲击治疗IgA 肾病具有较好的临床效果,且远期的不良反应低于常规口服激素治疗,然而,其作用机制有待进一步研究。

