罗望子种仁球蛋白-EGCG共价复合物的制备及其在乳化香肠中的应用
杨 杨,王梦桔,王 悦,边 鑫,范 婧,马春敏,石彦国,李笑梅,张 娜
(哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150028)
罗望子(Tamarindus indicaL.)又名酸角、酸梅,属豆科,原产于非洲,目前在我国四川、海南、云南、广东、广西、福建、台湾等省均有引种和栽培[1]。罗望子种仁是罗望子果肉加工副产物,主要由多糖和蛋白质组成。目前已有大量研究者从罗望子种仁中提取多糖,并将其作为稳定剂、增稠剂、增黏剂、乳化剂、凝胶剂等应用于食品和医药工业[2]。罗望子种仁球蛋白(tamarind seed globulin,TSG)是从罗望子种仁中提取的一种蛋白质,TSG中含有18 种氨基酸,其蛋氨酸和赖氨酸的含量高于豆科类植物,被认为是一种待开发利用的优质蛋白质[3]。研究发现TSG在pH 4.0~10.0条件下的溶解性优于大豆分离蛋白,但其乳化性及凝胶性均低于大豆分离蛋白[4]。尽管TSG具有一定的溶解性、乳化性、凝胶性及起泡性等功能性质,但是其乳化和胶凝性能仍然不能满足现代食品生产和加工特性的要求,这将限制其在食品工业中的广泛应用。因此需要对TSG进行改性处理,以期获得更加优良的乳化性及凝胶性。常用的蛋白质改性方法有物理改性、酶法改性和化学改性[5],其中化学改性的效果较为明显,操作简单,应用广泛[6]。
蛋白质与植物多酚的结合是常见的化学改性方法,其特点是反应过程简单,能有效提升蛋白质的溶解性、乳化性、凝胶性及起泡性[7]。表没食子儿茶素没食子酸酯((-)-epigallocatechin-3-gallate,EGCG)是茶多酚的主要组成成分,含有8 个酚羟基,EGCG在碱性条件下易氧化生成醌,从而与蛋白质等生物大分子发生共价复合反应[8]。蛋白质与多酚发生相互作用后,理论上蛋白质分子结构中引入了酚羟基,水合作用增强更能促进网络结构的形成,从而使蛋白质的功能性质得以改善[9]。多酚与蛋白质之间主要包含共价结合和非共价结合形式,赵思明等[10]研究了不同质量比的蛋白与EGCG复合物在热处理条件下复合体系相互作用的改变,发现蛋白与EGCG通过非共价疏水相互作用结合,EGCG的加入增加了蛋白质的稳定性。Kanakis等[11]研究发现β-乳球蛋白与EGCG和表儿茶素没食子酸酯之间的结合力较强且对其构象改变明显,且多酚与蛋白共价相互作用有利于提高蛋白质的乳化性、凝胶性等功能性质,但关于不同结合率下由蛋白质结构改变所引起的功能性变化还不够明确。
本研究以提取TSG为原料,利用EGCG与TSG发生共价复合,控制碱法处理的反应条件,考察共价复合反应条件及因素对TSG与EGCG结合率的影响。通过复合物在乳化香肠中的应用验证改性后TSG功能性发生的良好变化,为蛋白质-多酚共价复合物在功能食品领域的应用提供科学依据和重要理论基础。
1 材料与方法
1.1 材料与试剂
罗望子种仁废料 云南猫哆哩集团食品有限责任公司;肠衣(长14 m,直径16~17 mm) 广西梧州神冠蛋白肠衣有限公司;EGCG 北京北实纵横科技发展有限公司;盐酸、硼酸、浓硫酸、硫酸铜、氢氧化钠 天津市大陆化学试剂厂;邻苯二甲醛(o-phthalaldehyde,OPA)北京新光化工试剂厂;十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 天津市天力化学试剂有限公司;巯基乙醇 天津市致远化学试剂有限公司;甘氨酸、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA) 美国Sigma-Aldrich公司;尿素 天津市大茂化学试剂厂。
1.2 仪器与设备
pHS-2F pH计 上海仪电科学仪器股份有限公司;KQ-250E超声清洗器 昆山市超声仪器有限公司;TDL-4A离心机 上海菲恰尔分析仪器有限公司;722分光光度计、722紫外分光光度计 上海光谱仪器有限公司;KDY-9820凯氏定氮仪 北京通润源机电技术有限公司;SCIENTZ-12N冷冻干燥机 宁波新芝生物科技股份有限公司;TA.new plus质构仪 上海瑞玢国际贸易有限公司;NR200色差仪 深圳市业冠仪器设备有限公司。
1.3 方法
1.3.1 TSG的提取
将罗望子种仁废料粉末按照1∶40(g/mL)的比例溶于Tris-HCl缓冲液中,调节溶液pH 12.5,在65 ℃下磁力搅拌90 min,取出碱提液超声1 h,4000×g离心15 min,保留上清液备用。重复两遍上述操作,合并上清液。调节上清液pH值至4.6静置30 min,8000×g离心10 min,所得沉淀即为TSG。
1.3.2 TSG-EGCG共价复合物的制备
在Tao Fei等[12]研究方法的基础上进行适当修改。将1 g TSG粉末溶解于100 mL超纯水中,调节溶液pH值分别至8.0、8.5、9.0、9.5、10.0,磁力搅拌3 h后,分别加入适量EGCG使TSG与EGCG质量比为1∶0.0167、1∶0.025、1∶0.05、1∶0.1、1∶1,混合均匀,分别在20、25、30、35、40 ℃下磁力搅拌24 h,调节pH值至7.0。为了消除以上反应体系中的游离酚类化合物,将复合物在室温下透析24 h(截止分子质量5.0 kDa)。最后,对透析袋中的蛋白质样品进行冷冻干燥,得到TSG-EGCG共价复合物粉末。同时,相同碱性条件下培养的不添加EGCG的TSG为对照样品。
1.3.3 结合率的测定
参考Yang Chen等[13]的方法稍作修改,利用福林-酚法测定复合物中TSG结合的EGCG含量。将1 mL不同浓度的EGCG标准溶液与5 mL 0.2 mol/L福林-酚试剂均匀混合后于室温下避光反应5 min,加入4 mL Na2CO3溶液(7.5 g/100 mL),振荡30 s混匀后,在室温下避光反应2 h。空白对照为相同处理后的水溶液,利用紫外分光光度计检测其在760 nm处的吸光度,根据吸光度绘制标准曲线。采用式(1)计算TSG与EGCG共价结合率:
1.3.4 自由氨基含量的测定
通过邻苯二甲醛法进行测定[14]。将200 μL样品溶液混合于4 mL OPA试剂,35 ℃下振荡30 s静置2 min,在340 nm波长处测定吸光度,根据标准曲线计算样品的自由氨基含量。
1.3.5 巯基含量的测定
通过Ellman试剂法测定[15]。称取10 mg样品溶于5 mL Tris-Gly缓冲溶液中,加入50 μL Ellman试剂振荡30 s后静置1 h,在412 nm波长处测定吸光度(A412nm),以不加Ellman试剂的样品作为对照,采用式(2)计算巯基含量:
式中:n为稀释系数;C为样品的蛋白终浓度。
1.3.6 乳化香肠的制备
参照周杰[16]和施帅[17]等的方法略作修改。以下所有百分比均按总肉质量计。将猪后腿剔除表面可见筋膜,与猪背脂按质量比8∶2混合,用绞肉机分别绞碎。在猪后腿肉加入0.01%亚硝酸盐、0.05%异抗坏血酸钠、0.4%复合磷酸钠、1.5%糖、3%盐。肥肉中只加3%的盐,搅拌均匀,覆盖保鲜膜,置于冰箱0~4 ℃冷藏,腌制12 h以上。将猪后腿肉、30%冰水、10%木薯淀粉、不同添加量的TSG及TSG-EGCG共价复合物(0%、1%、2%、4%、6%、8%)、0.6%卡拉胶和0.3%味精在斩拌机上斩拌1 min后,加入猪肥膘和冰水继续斩拌5 min,进行灌肠后蒸煮30 min,冷却至室温备用。
1.3.7 乳化香肠品质测定
1.3.7.1 乳化香肠蒸煮损失率测定
参考Pietrasik[18]的方法略加修改。将乳化香肠煮熟后,擦去表面水分后进行测定。采用式(3)计算蒸煮损失率:
式中:m1为样品经蒸煮损失过程减少的质量/g;m2为蒸煮之前样品的质量/g。
1.3.7.2 乳化香肠保水性测定
参照封小龙[19]的方法进行测定。将乳化香肠切成大约3 mm厚的切片,称质量,放入恒温干燥箱中(60 ℃),热烘2 h,计算总单位质量的失水量。采用式(4)计算保水率:
式中:m1为样品放入恒温干燥箱前的质量/g;m2为样品放入恒温干燥箱热烘1 h的质量/g。
1.3.7.3 乳化香肠色泽测定
将乳化香肠切成3 cm的圆柱体,测定其色度,结果用亮度(L*)、红度(a*)、黄度(b*)表示。每根乳化香肠样品在不同部位测定3 个平行样,取3 次测定的平均值。
1.3.7.4 乳化香肠质构测定
根据刘迪迪[20]的方法进行质地剖面分析(texture profile analysis,TPA)。将乳化香肠剥去肠衣,切成约为20 mm×20 mm×20 mm的正方体。选用P/50 探头,测试前速率2 mm/s,测试速率1 mm/s,测试后速率1 mm/s,压缩比为50%,感应力5 g,每个样品分别测定5 次。
1.3.7.5 扫描电子显微镜观察乳化香肠样品
选取乳化香肠中无气泡阶段,切成2 mm×1 mm块状后用0.2 mol/L磷酸盐缓冲液冲洗,加入戊二醛溶液固定10 h。继续用磷酸盐溶液反复冲洗3 次,分别用50%、70%、80%、90%乙醇溶液梯度脱水各15 min,100%乙醇脱水3 次,每次30 min;用叔丁醇置换3 次,每次30 min。用冷冻干燥仪干燥样品5 h以上;用离子溅射仪给样品镀10 nm金膜,观察乳化香肠的组织微观结构。
1.4 数据处理与分析
所有实验进行3 次平行。采用SPSS 17.0软件进行数据分析,P<0.05,差异显著,采用Origin 8.5软件作图。
2 结果与分析
2.1 TSG与EGCG共价结合优化
由图1A可知,随着EGCG添加量的增多,TSG与EGCG 的结合率显著增高(P<0.05);当达到质量比1∶0.1 时,结合率达到最大值,其最大值为(63.56±0.61)%;继续添加EGCG至质量比1∶1,结合率无显著变化。这可能是由于TSG与EGCG质量比达到1∶0.1时,TSG上的结合位点均被EGCG所占据,已达到饱和状态,因此再增加EGCG,结合率几乎不变。Rodriguez等[21]发现随着茶多酚质量的增加,乳清分离蛋白与茶多酚的结合率也出现了先增加后不变的现象,这与本实验趋势相似。在蛋白质与多酚的共价相互作用中,蛋白质上结合位点与多酚结合位点(酚羟基氧化生成的醌)的数目一定,只有两者质量比合适,即两者结合位点的总数大体相等时,结合率才能达到最大[22]。
由1B可知,TSG与EGCG的结合率随着反应pH值增大而增大;直到反应pH值为9.5时,结合率达到最大值,其最大值为(69.63±1.19)%;当继续增大pH值至10.0时,结合率则呈显著降低趋势(P<0.05)。蛋白质与多酚的共价相互作用中,pH值会对蛋白质构象或多酚结构产生影响;随着反应pH值增大,蛋白质结构更加松散,暴露了更多自由氨基及巯基,同时多酚的酚羟基更易于氧化生成醌,而碱性过强时会导致蛋白质一级结构可能遭到破坏,基团改变、肽键断裂,从而不利于蛋白质与多酚共价结合[23]。因此,反应pH值进一步增加会导致TSG与EGCG结合率的下降。
由1C可知,TSG与EGCG的结合率随着反应温度增大而增高;直到反应温度为30 ℃时,结合率达到了最大值,最大值为(78.69±1.21)%;温度继续升高时,结合率则出现显著下降趋势(P<0.05)。蛋白与多酚共价相互作用中,到达一定反应温度之前,随着温度升高蛋白质结构变得更加松散,使其更易与多酚发生共价复合;而超过特定温度可能会造成多酚水解或降解[24],使多酚结合位点数小于蛋白结合位点数,因而温度继续升高TSG与EGCG共价结合率反而下降。Tao Fei等[12]发现温度对大豆分离蛋白与EGCG共价复合影响显著,当温度为30 ℃时,大豆分离蛋白与EGCG结合程度最大,温度继续升高会降低复合物的结合程度。这与本研究温度对共价复合的影响趋势一致。
2.2 TSG与EGCG的结合率差异显著性分析
将2.1节中测得的不同反应条件下制备的TSG-EGCG共价复合物的结合率进行差异显著性分析,当结合率为48.20%、56.41%、59.71%、63.56%、67.58%、73.79%、78.69%时具有显著差异(P<0.05)(图2),进而选取具有显著差异的结合率进行自由氨基、巯基的测定。
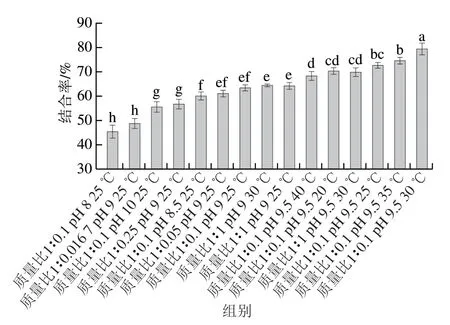
图2 不同反应条件下TSG与EGCG结合率Fig.2 Binding rates between TSG and EGCG under different reaction conditions
2.3 不同结合率下TSG自由氨基及巯基含量分析
由表1可知,随着结合率增加,TSG自由氨基及游离巯基含量呈显著降低趋势(P<0.05);结合率为78.69%时,自由氨基含量及巯基含量分别降至最低。尿素和SDS的加入破坏了蛋白质与多酚之间的非共价复合。研究发现,EGCG被氧化后会先生成醌[25]。因此,推断本实验中TSG与EGCG的结合是由于EGCG先氧化生成醌,生成的醌进一步与蛋白质的氨基及巯基发生共价结合。结合程度越大证明有越多的自由氨基及巯基参与了反应,因此自由氨基及巯基的含量随结合率的增大而降低。刘英杰等[26]在对大豆分离蛋白与花青素的共价结合中发现,随着花青素添加量增加,其结合率不断上升,自由氨基及巯基呈显著降低趋势,当其含量降至最低时,共价结合程度最大。

表1 不同结合率下TSG巯基和自由氨基含量变化Table 1 Changes in the contents of sulfhydryl and free amino groups in TSG under different binding rates
2.4 TSG-EGCG共价复合物添加对乳化香肠品质的影响
为了考察TSG与EGCG共价复合在实际产品中应用的效果,将结合率为78.69%的TSG-EGCG共价复合物加入到乳化香肠中,并以TSG为对照,研究TSG-EGCG共价复合物和TSG添加量对乳化香肠蒸煮损失、保水性的影响,采用色差计和质构分析仪对其色泽和质构特性进行测评。
2.4.1 TSG-EGCG共价复合物添加对乳化香肠蒸煮损失率的影响
由图3可知,与未添加TSG组相比,添加了复合物的乳化香肠蒸煮损失率降低。当两组添加量分别达到8%时,蒸煮损失率达到组内最低,复合物组显著低于TSG组(P<0.05)。这是由于TSG与EGCG共价复合后,在TSG表面引入了亲水的酚羟基,增强了TSG凝胶的水合能力,其在溶解过程中会吸收大量水分,可以将多余的部分游离水吸收形成稳定凝胶网状结构,同时利用该凝胶网状结构吸收脂肪并将其包裹[27]。由于复合物具有更好的乳化性,能够在脂肪微粒表面形成均匀、稳定的蛋白分子膜,防止脂肪微粒间的聚集。因此,复合物更有助于维持乳化香肠体系中的水分和脂肪,从而将低了其蒸煮损失。Jailson等[28]发现在乳化香肠中添加2%、4%和6%的米粉蛋白可使其形成稳定的乳化体系,显著降低蒸煮损失,这与本实验结论相似。
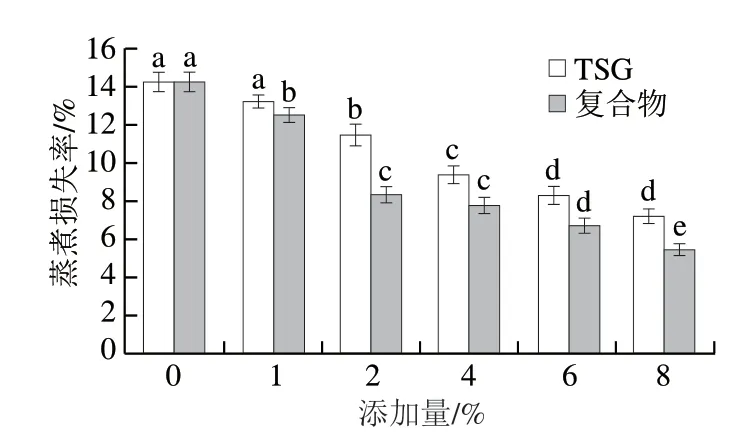
图3 不同添加量TSG与复合物乳化香肠蒸煮损失率Fig.3 Cooking loss of emulsified sausages added with different amounts of TSG and TSG-EGCG complex
2.4.2 TSG-EGCG共价复合物添加对乳化香肠保水性的影响
由图4可知,添加复合物组乳化香肠的保水率明显高于TSG组。当添加量为2%和4%时,乳化香肠的保水率达到最高,较不添加TSG的乳化香肠相比分别提高了2.89%、5.33%。这是由于TSG与EGCG共价复合后,在TSG表面引入了亲水的羟基,增强了TSG亲水性,从而结合了更多水[29];另一方面,TSG与EGCG共价复合后,乳化性提高,使脂肪和复合物充分乳化形成结构紧密的分子结构,使其结构变得更致密、空隙变少,从而阻止水分子析出[30]。因此,添加复合物组乳化香肠的保水率明显高于TSG组。
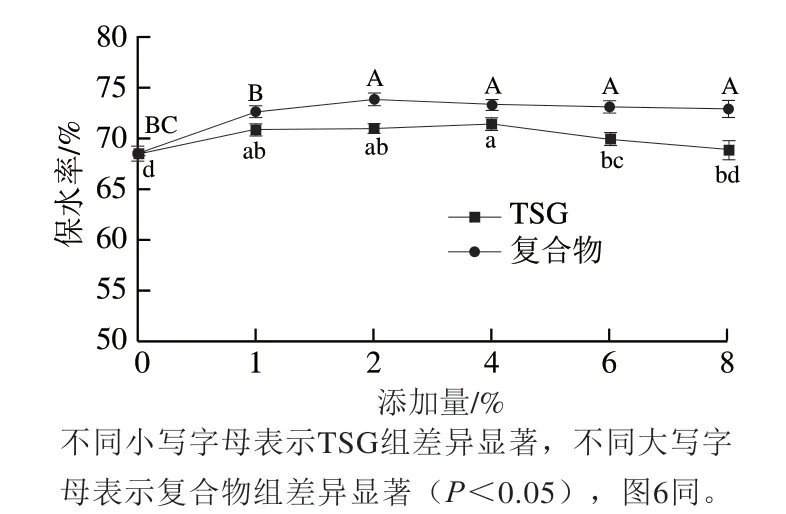
图4 不同添加量TSG与复合物乳化香肠保水率Fig.4 Water-holding capacity of emulsified sausages added with different amounts of TSG and TSG-EGCG complex
2.4.3 TSG-EGCG共价复合物添加对乳化香肠色泽的影响
如图5所示,TSG及复合物的添加使乳化香肠的色泽发生了一定程度变化。由表2可知,随着TSG组与复合物组添加量增加,L*和a*均呈逐渐下降趋势,添加量对其L*和a*影响较大。复合物组添加量在1%~2%之间时,乳化香肠的L*值并无显著差异(P>0.05),但随着添加量继续增大,L*值显著减小(P<0.05);在此过程中a*值并没有发生显著变化(P>0.05),直到复合物组添加量增加至8%。TSG组添加量大于4%时,与未添加相比,乳化香肠的L*、a*和b*发生显著变化(P<0.05)。Gnanasambandam等[31]的研究表明,在法兰克福乳化香肠中添加5%和7%的大豆分离蛋白,其a*明显降低,而b*出现上升趋势[31]。这是可能是由于肌肉蛋白和NaNO2发生化学反应形成亚硝基肌红蛋白和亚硝基血红蛋白,经过蒸煮变成稳定的粉红色,使肉呈现鲜艳的色泽。随着蛋白添加量增加,瘦肉和NaNO2相对含量减少,导致乳化香肠a*降低,b*增加。同时复合物本身颜色发褐黄,导致复合物组与TSG组乳化香肠相比,其a*较低,b*较高。
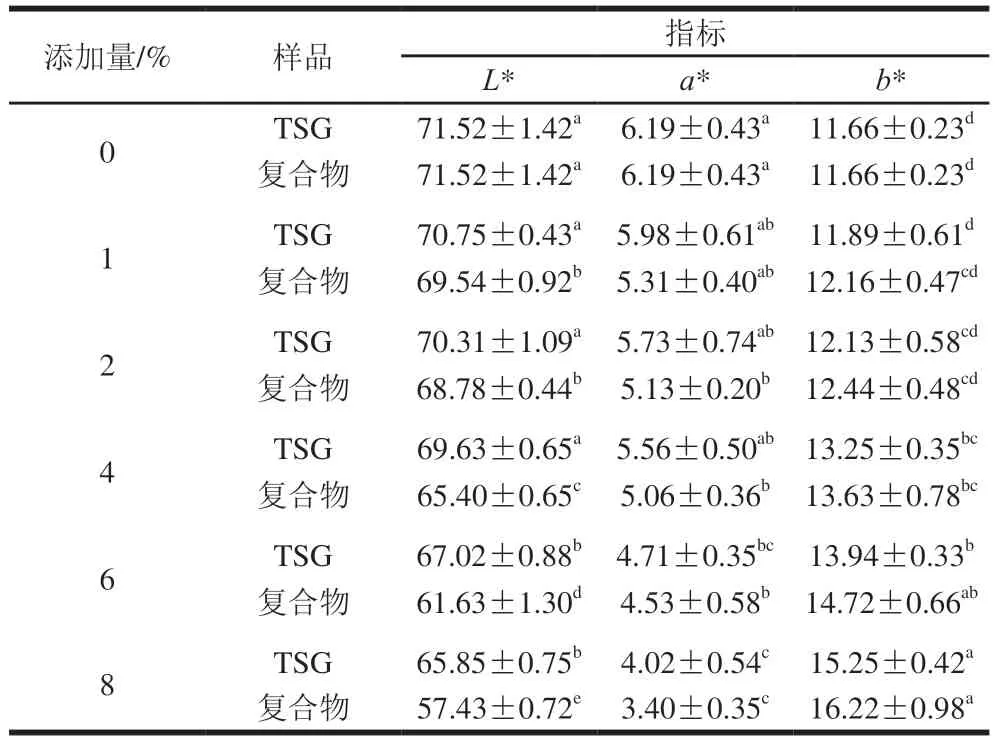
表2 不同添加量的TSG与复合物乳化香肠色泽Table 2 Color parameters of emulsified sausages added with different amounts TSG and TSG-EGCG complex
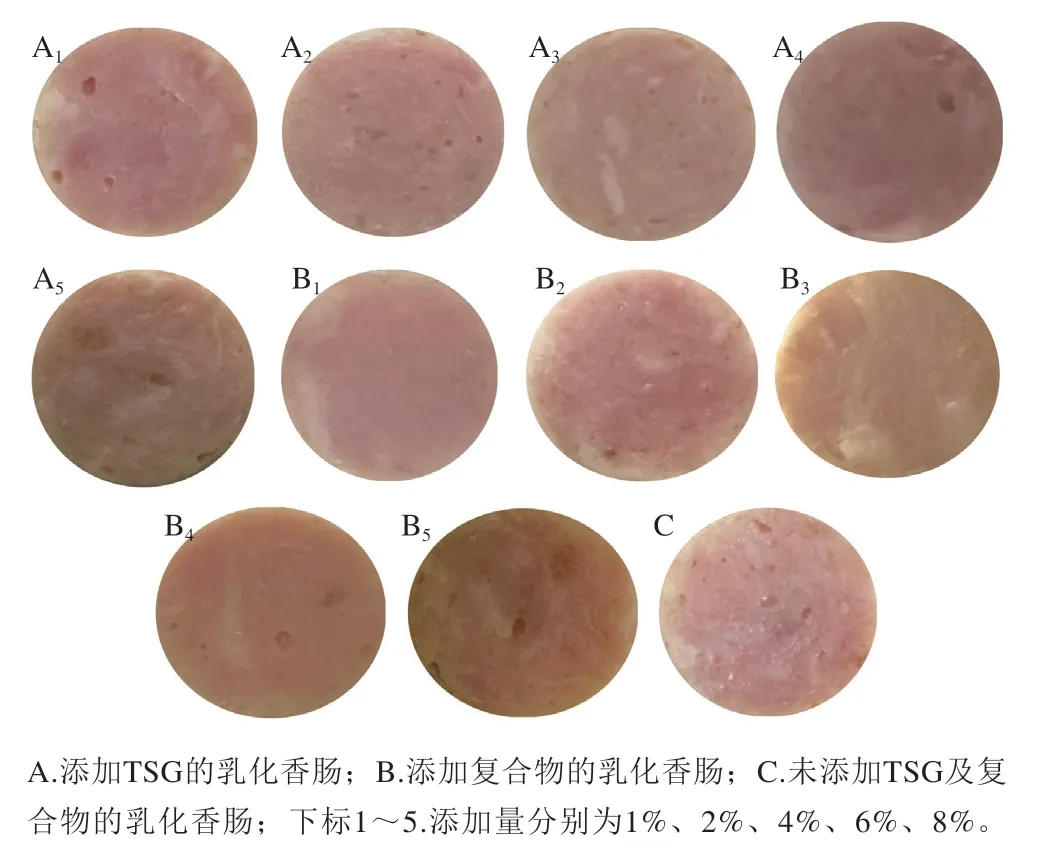
图5 不同添加量的TSG与复合物乳化香肠切面图Fig.5 Cross-sectional view of emulsified sausages added with different amounts TSG and TSG-EGCG complex
2.4.4 TSG-EGCG共价复合物添加对乳化香肠TPA的影响
如图6所示,随着TSG与复合物添加量的增加,乳化香肠的硬度、弹性、黏聚性及咀嚼性都呈先增大后减小趋势。当TSG添加量达到2%时,乳化香肠的硬度、弹性及咀嚼性达到了峰值,分别为5683.33 g、0.86、3376.14 g;当添加量达到4%时,其黏聚性达到了峰值,为0.64。当复合物添加量达到2%时,乳化香肠的硬度、弹性及咀嚼性达到了峰值,分别为6137.33 g、0.90、3880.62 g;当复合物添加量达到4%时,黏聚性达到了峰值,为0.66。复合物组乳化香肠硬度、弹性、咀嚼性及黏聚性的峰值均显著高于TSG组和未添加TSG的乳化香肠组(P<0.05)。研究表明,适当添加植物蛋白能够与肉糜中的水分、脂肪、肌原纤维蛋白等形成稳定的凝胶网状结构,从而改善乳化香肠的品质[32];但过量添加可能造成复合物与肌原纤维蛋白交联程度更加密集,从而使乳化香肠的质构变差[33]。因此,添加量为6%~8%时,质构特性有降低趋势。


图6 不同添加量的TSG与复合物乳化香肠的TPAFig.6 TPA properties of emulsified sausages added with different amounts of TSG and TSG-EGCG complex
2.4.5 TSG-EGCG共价复合物对乳化香肠微观结构的影响
当TSG及复合物添加量为2%时,乳化香肠具有良好保水性、色泽及质构,因此选取该添加量下的样品进行微观结构分析,并以未添加TSG的样品作为对照。由图5、7可知,添加TSG及复合物的样品较未添加TSG的切面更加紧密、空隙减少。其中,添加复合物的样品切面最为细腻,凝胶立体网状结构更均匀清晰。这可能是由于TSG与EGCG共价复合后,在TSG的表面引入了亲水的酚羟基—OH,并使得TSG二级结构和三级结构发生改变,增强了TSG凝胶性及乳化性,因此使得乳化香肠结构变得更致密、空隙变少。这与乳化香肠质构结果一致。简华君等[34]研究发现,在乳化香肠中加入具有良好乳化性及凝胶性的大豆分离蛋白可溶性聚集体可以使乳化香肠微观结构更加均匀致密,减少了空隙,这与本实验结果一致。

图7 未添加TSG(A)、添加2%TSG(B)及添加2%复合物(C)乳化香肠的扫描电镜图Fig.7 Scanning electron micrographs of emulsified sausages without TSG (A),2% of TSG (B) and 2% of TSG-EGCG complex (C)
3 结论
以实验室自制的TSG与EGCG为研究原料,通过碱处理法制备TSG-EGCG复合体系,TSG与EGCG的结合率最高为78.69%,自由氨基及巯基含量的变化分析显示,TSG与EGCG之间主要通过EGCG侧链酚羟基的氧化与TSG的自由氨基及巯基反应发生共价复合。以TSG组作对照,探究结合率为78.69%的复合物添加量对乳化香肠品质的影响:当TSG组和复合物组添加量达到2%和4%时,两组保水率分别达到最高值,为73.76%、71.32%,较未添加TSG组分别提高了2.89%、5.33%,其硬度、弹性、咀嚼性达到了最佳。扫描电子显微镜结果表明,加入TSG及复合物后会使乳化香肠的微观结构变得更加紧密,且添加复合物的乳化香肠立体凝胶网络更加均匀清晰。整体而言,TSG及复合物的添加量为2%时,乳化香肠的品质得到明显提高,添加复合物乳化香肠的各项指标明显高于添加TSG组。

