拮抗细菌KRS022的鉴定及对大丽轮枝菌的抑制效果
罗万珍,王丹,齐宏玥,王彤,刘政,田李,戴小枫,陈捷胤✉,麦合木提江·米吉提
1新疆农业大学农学院/农业农村部西北荒漠绿洲农林外来入侵生物防控重点实验室,乌鲁木齐 830052;2 中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京100193;3中国农业科学院西部农业研究中心,新疆昌吉831100;4牡丹江师范学院生命科学与技术学院,黑龙江牡丹江 157012;5石河子大学农学院,新疆石河子 832000;6曲阜师范大学生命科学学院,山东曲阜 273165;7新疆慧尔农业集团股份有限公司,新疆昌吉 831199
0 引言
【研究意义】作物黄萎病(Verticilliumwilt)是由大丽轮枝菌(Verticillium dahliae)引起的植物土传维管束真菌病害。大丽轮枝菌具有寄主范围广、变异快和致病机理复杂等特点,引起的作物黄萎病难以防治,造成世界范围内经济作物产量的巨大损失[1]。目前作物黄萎病的防治手段包括抗病品种选育、物理防治和化学药剂处理等。抗病品种选育具有育种周期长、易产生品种退化导致的抗病性丧失、其他病原菌发展为优势种群等问题,物理防治不能从根本上防治黄萎病的发生,化学药剂长期使用会导致病原菌抗药性增强、土壤有益微生物减少等[2]。因此,开发安全、高效的生物防治产品可能是防治作物黄萎病的新途径。【前人研究进展】丰富的功能微生物资源是生物防治措施研发的关键,目前报道的生防微生物资源包括芽孢杆菌(Bacillusspp.)、链霉菌(Streptomycesspp.)、木霉(Trichodermaspp.)和假单胞菌(Pseudomonasspp.)等[3]。芽孢杆菌因其对叶面、土壤传播和采后真菌病害的拮抗作用已被广泛应用[4]。假单胞菌对多种植物病原菌具有很好的抑制作用,具有诱导植物抗性[5]、产生多种具有抑菌活性的次级代谢物[6]、产生生长素和铁载体促进植物生长发育等特性[7-8],适合防治土传病害。张煜琦等[9]研究表明,假单胞菌PSB-06处理番茄植株后能够抑制其褪绿病的传播,通过提高番茄茉莉酸(JA)、水杨酸(SA)防御途径激发抗病功能并促进其生长;BIESSY等[10]研究发现,假单胞菌产生的吩嗪、铁载体能有效抑制马铃薯晚疫病、疮痂病以及黄萎病的病原菌。在过去的20年中,假单胞菌属的许多细菌已被证明是黄萎病菌的有效拮抗菌[11-12]。BERG等[13]发现在对黄萎病菌具有拮抗作用的560株分离菌中,假单胞菌占77%;LIU等[14]采用平板抑菌试验发现假单胞菌GWSMS-1粗提物中的几丁质酶能显著抑制大丽轮枝菌菌丝生长。铜绿假单胞菌(P.aeruginosa)、荧光假单胞菌(P.fluorescens)作为黄萎病菌的拮抗菌已有很多报道[15-16]。【本研究切入点】本实验室对分离自健康棉田根际土壤的细菌进行了抑菌活性筛选,其中一株细菌KRS022对大丽轮枝菌具有较强拮抗功能,该菌株具有繁殖速度快、易培养等特点,16S rDNA序列分析初步明确该菌株属于假单胞菌,其防治效果及抑菌机理还需进一步探究。【拟解决的关键问题】通过明确拮抗菌株KRS022的分类地位、测定其对病原真菌的抑制作用、对由大丽轮枝菌引起的棉花和烟草黄萎病的防治效果以及检测植物抗性相关基因的表达,为该菌株生防菌剂的开发和应用提供理论依据。
1 材料与方法
试验于2021年9月至2022年9月在中国农业科学院植物保护研究所完成。
1.1 材料
供试菌株:大丽轮枝菌Vd991、尖镰孢(Fusarium oxysporum)、禾谷镰孢(Fusarium graminearum)、稻瘟病菌(Magnaporthe oryzae)、灰葡萄孢(Botrytis cinerea)、胶孢炭疽菌(Colletotrichum gloeosprioides)、果生炭疽菌(Colletotrichum fructicola);贝莱斯芽孢杆菌(Bacillus velezensis)Bv17、大肠杆菌(Escherichia coli)DH5α、生防细菌KRS022均由本实验室保存。
供试植物:烟草(Nicotiana benthamianaLAB)、棉花(Gossypium hirsutumcv.Junmian No.1,品种为军棉1号)在25℃温室培育,光照16 h,暗处理8 h。
供试培养基:马铃薯葡萄糖琼脂培养基(PDA)、完全培养基(CM)、细菌基础培养基(LB)、酪素培养基、淀粉酶培养基、明胶培养基、嗜铁素检测固体培养基(CAS)[17]、解磷菌无机磷固体培养基(PVK)、硅酸盐细菌培养基(SB)、阿须贝氏无氮培养基(Ashby)[18]、葡萄糖蛋白胨水培养基(MR-VP)、吲哚培养基(IM)、克氏柠檬酸盐培养基、利夫森二氏培养基(HL)[19]、血琼脂平板(BAP)。
1.2 KRS022菌液及大丽轮枝菌孢子悬浮液的制备
将实验室分离筛选所得KRS022原始菌株从平板上用挑针挑取单菌落,接种于含25 mL LB液体培养基的50 mL离心管进行液体发酵,进行种子液的制备,28℃,200 r/min恒温摇床振荡培养24 h。为进一步纯化培养,将得到的KRS022种子液体按2%的接种量接种至含有200 mL LB液体培养基的500 mL锥形瓶中,于同样的发酵条件继续培养24 h,得到KRS022菌液(OD600约为3.0)。
将在 PDA平板上生长的大丽轮枝菌切成小块放入CM培养液,25℃振荡培养4 d,用灭菌纱布过滤掉带菌丝的培养基,倒入50 mL离心管,4 000 r/min高速离心10 min,去上清留菌体,加无菌水重悬,得到孢子悬浮液,将浓度调为1×107个/mL。
1.3 KRS022菌株显微形态鉴定
划线接种细菌于LB固体培养基,28℃培养,观察并记录24 h和72 h菌落大小、颜色及形态特征,并用革兰氏染色试剂盒(购自北京酷来搏科技有限公司)对该生防菌进行革兰氏染色。
1.4 KRS022菌株生理生化特征及其功能鉴定
对KRS022进行明胶水解、柠檬酸盐利用、甲基红试验、吲哚试验、厌氧试验、葡萄糖酵解试验以及血平板试验的生理生化测定,生理生化试验参照《常见细菌系统鉴定手册》[20]和《伯杰细菌鉴定手册》[21]。对KRS022的产铁载体、解磷、解钾、固氮以及蛋白酶、淀粉酶、过氧化氢酶活能力进行测定[22]。
甲基红试验、吲哚试验以及柠檬酸盐利用试验:从 LB平板挑取 KRS022菌体分别接入 MR-VP、IM以及柠檬酸盐培养基,28℃振荡培养2 d后滴加甲基红、吲哚、溴麝香草酚蓝指示剂,观察颜色变化;过氧化氢酶试验:透明试管配置 3%过氧化氢水溶液,从LB平板挑取KRS022菌体放入试管中观察是否产生大量气泡;厌氧试验、明胶试验以及葡萄糖酵解试验是从LB平板挑取KRS022菌体分别穿刺进PDA、明胶以及HL培养基,28℃培养2 d后分别观察菌体在培养基内是否生长、菌体周围液化情况以及培养基颜色变化;血平板试验:蘸取KRS022菌液划线于BAP平板,12 h后观察是否生长及菌体颜色。铁载体、解磷、解钾、固氮、蛋白酶、淀粉酶试验:取10 μL的KRS022发酵原液分别滴于CAS、PVK、SB、Ashby、酪素及淀粉酶培养基平板中央,28℃培养4 d后分别观察平板是否有黄红色菌落、产生透明光圈、出现油状菌落、菌落周围出现透明圈、滴加卢哥氏碘液菌落为棕色来鉴定其能力。
1.5 KRS022菌株分子鉴定
以KRS022基因组DNA为模板,利用16S rDNA特异性引物 Primer-27F(5′-GAAGAGTTTGATCCTG GCTCAG-3′)和 Primer-1540R(5′-CTACGGCTACCTT GTTACGA-3′)与gyrB特异性引物 UP2F(5′-GAA GTCATGACCGTTCTGCAYGCNGGNGGNAARTTY GA-3′)和 UP2R(5′-AGCAGGGTACGGATG TGCGA GCCRTCNACRTCNACRTCNGCRTCNGTCAT-3′)进行PCR,将得到的扩增片段送至生工生物工程(上海)股份有限公司进行测序。将16S rDNA与gyrB测序结果串联在NCBI数据库中的Blast进行序列比对,获得同源性最高的典型菌株序列。利用MEGA 6.0,ClustalW比对,采用比邻法构建系统发育树,自展值为1 000。
1.6 KRS022抑菌活性测定
采用对峙培养法和对扣熏蒸法测定KRS022对大丽轮枝菌、尖镰孢、禾谷镰孢、稻瘟病菌、灰葡萄孢、胶孢炭疽菌和果生炭疽菌7种病原真菌的抑菌活性。对峙培养法:接种直径为 6 mm的真菌菌饼于 PDA平板中央,在菌饼上/下方2 cm的位置用KRS022发酵原液划线为处理组,划线空白LB为对照组;对扣熏蒸法:取100 μL的KRS022发酵原液涂布LB平板,将接种真菌的PDA平板同涂布KRS022的LB平板对扣密封为处理组,涂布空白LB液体密封为对照组。每个处理设置5个重复,25℃根据其生长情况培养4—10 d后取出观察。真菌生长抑制率(%)=[(对照组菌落直径-处理组菌落直径)]/对照组菌落直径×100。
1.7 KRS022对大丽轮枝菌孢子萌发及菌丝生长的影响
采用发酵菌液平板法、涂布法以及对扣熏蒸法明确KRS022对大丽轮枝菌的抑制效果。发酵菌液平板法:将直径6 mm大丽轮枝菌Vd991接种于KRS022菌液与PDA按1∶9比例混合的平板中央;涂布法:将直径6 mm的Vd991接种于表面涂有KRS022菌液的PDA平板。每处理3个重复,25℃培养10 d后观察KRS022对大丽轮枝菌抑制情况。
KRS022无细胞上清液与大丽轮枝菌孢子悬浮液(1×107个/mL)等比例混合培养进行孢子萌发试验,LB液体混合孢子悬浮液为对照,每处理15个重复,25℃培养48 h后在光学显微镜下观察孢子萌发及菌丝生长情况;取 200 μL Vd991孢子悬浮液(1×107个/mL)涂布于贴有无菌微孔滤膜的PDA平板,并与涂布KRS022发酵原液的LB平板对扣熏蒸10 d后观察菌丝生长情况。
1.8 KRS022菌液室内防治效果测定
待棉花长至3周龄、烟草长至4周龄,用KRS022菌液(OD600=1.0)对其灌根处理,以清水灌根的植株为对照。2 d后分别接种大丽轮枝菌 Vd991(1×107个/mL),每盆灌根30 mL,进行4个重复,定期统一浇水。30 d后观察植株发病情况,剖茎观察各处理组维管束是否被侵染使其褪绿变色。
1.9 定量PCR检测大丽轮枝菌繁殖量
室内防治效果试验30 d观察发病情况时,使用天根DNAsecure新型植物基因组DNA提取试剂盒提取棉花和烟草根部DNA,利用定量PCR(qPCR)检测大丽轮枝菌Vd991在棉花和烟草植株茎基部的相对繁殖量。以大丽轮枝菌的延伸因子Verticillium dahliaeelongation factor 1-α(VdEF1-α)在棉花和烟草茎基部的相对拷贝数来衡量大丽轮枝菌的相对生物量,棉花和烟草的内参基因均为 18S rRNA和延伸因子elongation factor 1-α(EF1-α)。试验过程中定量引物序列为 18S-F(5′-CGGCTACCACATCCAAGGAA-3′)和 18S-R(5′-TGTCACTACCTCCCCGTGTCA-3′);NbEF-F(5′-AGGATACAACCCTGACAAGA-3′)和NbEF-R(5′-GTGGGACCAAAAGTAACAAC-3′);VdEF-α-F(5′-TGAGTTCGAGGCTGGTATCT-3′)和VdEF-α-R(5′-CACTTGGTGGTGTCCATCTT-3′),反应体系及条件参考文献[23],数据分析方法采用 2-∆∆CT[24],目的基因相对表达量=2-ΔΔCT,ΔΔCT=(CT目的基因-CT管家基因)试验组-(CT目的基因-CT管家基因)对照组。
DNAsecure新型植物基因组DNA提取试剂盒方法:处理30 d后棉花和烟草剪取根部基材,金属水浴锅85℃预热TE,全程使用去RNA酶离心管,离心机转速12 000 r/min。每100 mg的根部组织放入研钵加液氮充分碾磨直至成粉末状;离心管分别加入400 μL缓冲液 LP1 和 6 μL RNaseA(mg·mL-1),将粉末倒入离心管,漩涡振荡1 min,室温放置10 min;加入130 μL缓冲液 LP2,混匀后立即漩涡振荡1 min,离心5 min,取上清液放入新的离心管;在新的离心管中加入750 μL等体积缓冲液LP3混匀,用移液枪分两次吸出,加入吸附柱CB3离心30 s,去废液;加入600 μL漂洗液PW漂洗,离心30 s,去废液,再漂洗一次,空转离心2 min;将吸附柱CB3转入一个干净的2 mL收集管中,开盖晾20 min;向吸附柱CB3中间垂直悬空滴加70 μL TE,室温放置5 min,离心2 min,将溶液收集到离心管中,得到棉花及烟草根部组织 DNA。
1.10 KRS022激发植物抗性免疫
待棉花长至3周龄,分别灌根清水、KRS022菌液(OD600=1.0),2 d后分别接种大丽轮枝菌Vd991孢子悬浮液(1×107个/mL),每盆灌根30 mL,设置灌根清水、KRS022菌液、Vd991孢子悬浮液、KRS022+Vd991孢子悬浮液4个试验组,进行3个重复,3 d后取棉花根部。烟草长至4周龄,同一叶片分别注射空白 LB液体和 KRS022无细胞上清液(KRS022菌液通过高速离心机,25℃、12 000 r/min离心10 min后取上清,无菌注射器吸取发酵上清液,插上0.22 μm微孔滤膜过滤装置,过滤得到无细胞上清液),6 h后剪取注射部位的叶片。RNA 的提取使用EASYspin Plus植物RNA快速提取试剂盒(艾德莱),利用TransScript Ⅱ One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒(全式金)进行cDNA的合成。RT-qPCR在QuantStudioTM5 System上进行,以棉花及烟草的管家基因GhUB7、NbEF-1α为内参,测定防御相关基因的表达量,棉花及烟草防御基因引物[25-28]见表1。反应体系:2×TransStart Top GreenqPCR superMix(全式金)10 μL,ddH2O 7.6 μL,正向和反向引物各 0.6 μL,cDNA 1.2 μL。反应程序:95℃预变性3 min,95℃变性15 s,60℃退火30 s,72℃延伸20 s,40个循环。反应结束后取Ct值,采用2-ΔΔCT法计算目的基因相对表达量[24]。

表1 棉花及烟草防御相关基因表达检测引物Table 1 Specific primers for defense-related genes of cotton and tobacco
1.11 数据分析
试验数据采用Excel 2016计算平均值、标准差,并完成单因素方差分析和t检验。
2 结果
2.1 KRS022菌株形态鉴定
KRS022在LB平板上生长良好。菌落颜色为深黄色,单菌落近圆形,菌落边缘整齐、表面光滑,稍微向上突起,质地较为黏稠,呈油膜状发亮;随着培养时间的增长,菌落从中间到边缘会有黄色到透明黄色渐变的油状分泌物,逐渐向平板扩散开;直至培养5 d后,平板未生长菌株的位置也会逐渐染成油状浅黄色,与培养基融为一体不易挑出。革兰氏染色结果显示该菌株为紫红色短杆状,鉴定为革兰氏阴性细菌(图1)。

图1 菌落形态及革兰氏染色结果Fig.1 Colony morphology and gram staining results
2.2 KRS022生理生化特性及其功能测定
如表2所示,KRS022菌株甲基红试验为阴性,能够利用柠檬酸盐产生吲哚,能够使明胶液化;KRS022为好氧细菌,须在有氧条件下进行培养发酵;能够产生植物所需的氮、磷、钾元素以及合成细胞色素和酶类所需的铁载体,具有蛋白酶、淀粉酶、过氧化氢酶活性;葡萄糖氧化发酵试验结果表明 KRS022为产碱型细菌;在血平板上形成光滑、湿润、边缘整齐的灰色菌落,无溶血性;经天然抗生素测定KRS022菌株对氨苄青霉素具有天然抗性,能够在25、50、100 μg·mL-1氨苄青霉素LB平板上生长,根据《常见细菌系统鉴定手册》[20]对比,并参考石中全等[29-31]对产碱假单胞菌(Pseudomonas alcaligenes)生理生化特征的描述,发现菌株KRS022符合产碱假单胞菌生物学特征。
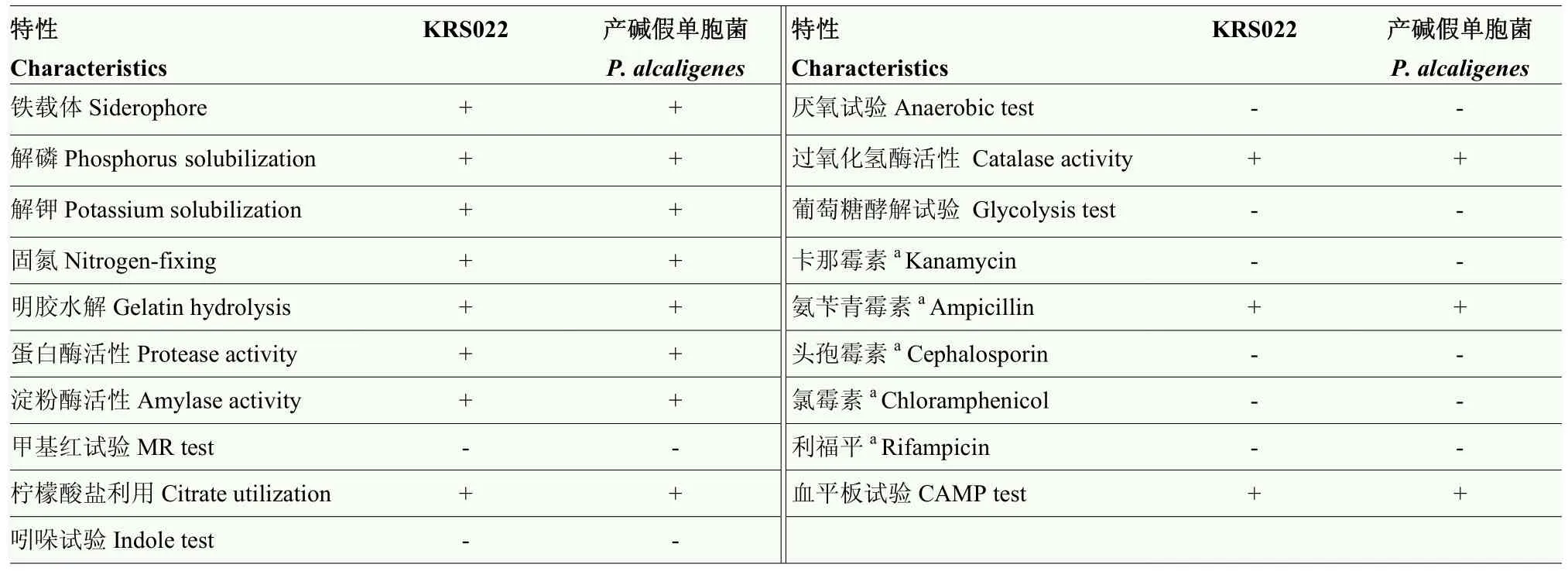
表2 KRS022生理生化特性测定Table 2 Physiological and biochemical characteristics of KRS022
2.3 KRS022分子序列鉴定及系统发育树分析
以KRS022菌株DNA为模板进行PCR扩增,16S rDNA和gyrB扩增分别得到1 467和1 125 bp的片段,测序后在NCBI数据库中进行BLAST同源性比对,并上传GenBank数据库,16S rDNA和gyrB序列ID号分别为OQ167785、OQ184953。结果表明,其与产碱假单胞菌R1-96(序列ID:JQ659530.1)16S rDNA序列一致性为99.59%,gyrase subunit B基因(gyrB)测序结果与GenBank数据库中产碱假单胞菌MSSRFD254的gyrB序列(序列ID:KF111014.1)一致性高达 97%;分别将KRS022的16S rDNA核酸序列和gyrB核酸序列串联,使用 MEGA 6.0 软件构建系统发育树,对菌株的16S rDNA-gyrB基因串联序列数据集进行聚类分析,结果表明KRS022与产碱假单胞菌聚为一支(图2),结合形态学特征初步鉴定为产碱假单胞菌。

图2 采用比邻法构建序列系统发育树Fig.2 Phylogenetic tree analysis derived by neighbor joining method
2.4 KRS022对病原真菌的抑制作用
KRS022与稻瘟病菌和大丽轮枝菌两种真菌对峙培养10 d,与其余真菌培养5 d,结果表明,KRS022对胶孢炭疽菌、禾谷镰孢、尖镰孢、果生炭疽菌、稻瘟病菌、灰葡萄孢和大丽轮枝菌均有不同程度的抑制作用(图3-A),抑制率分别为(54.96±2.52)%、(56.61± 2.57)%、(66.57±1.67)%、(61.73±4.31)%、(56.08±1.82)%、(72.12±3.05)%和(75.19± 0.50)%(图 3-B)。
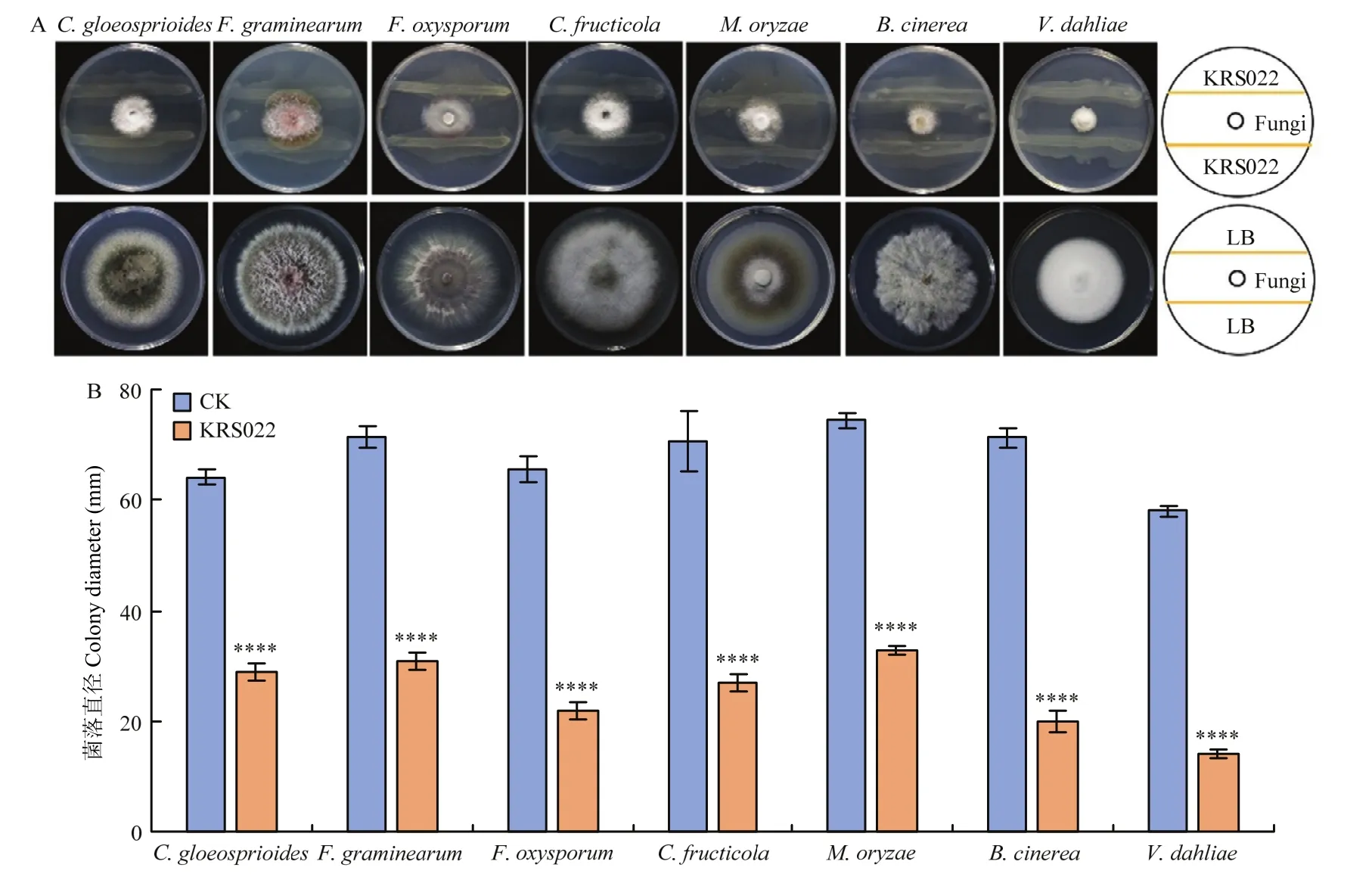
图3 平板对峙法测定KRS022对病原真菌生长的广谱抑制作用Fig.3 The broad-spectrum inhibitory effect of KRS022 on pathogenic fungi growth determined by plate confrontation test
KRS022与稻瘟病菌和大丽轮枝菌两种真菌对扣熏蒸培养 10 d,与其余真菌培养 4 d,结果表明,KRS022对禾谷镰孢和尖镰孢的抑制效果较差,抑制率仅为(27.21±2.34)%和(60.83±1.77)%;对其余测试真菌的抑制率均在80%以上,其中对大丽轮枝菌的抑制效果最佳,抑制率为(99.78±0.16)%,稻瘟病菌和灰葡萄孢次之,抑制率分别为(98.60±0.41)%和(97.14±1.13)%(图 4)。以上结果表明,KRS022挥发性代谢产物对各病原真菌的生长具有不同的抑制作用。

图4 KRS022挥发性代谢产物对病原真菌生长的广谱抑制作用Fig.4 The broad-spectrum inhibitory effect of KRS022 volatile metabolites on pathogenic fungi growth
2.5 KRS022对大丽轮枝菌孢子萌发及菌丝生长的影响
如图5-A所示,通过将KRS022菌液混入PDA培养基、涂布KRS022和对扣熏蒸方法培养大丽轮枝菌,10 d后进行观察,结果表明,3种处理方法的抑制率分别为(96.21±1.20)%、(99.72±0.07)%和(99.44±0.16)%(图5-B),说明KRS022对大丽轮枝菌Vd991的生长具有良好的抑制效果;KRS022无细胞上清液处理48 h后,Vd991孢子未见萌发,而对照组空白LB处理可见大量的孢子萌发(图 5-C)。此外,KRS022菌液对扣熏蒸孢子液培养10 d后观察到孢子萌发形成的菌丝膨大、变粗(图5-D)。

图5 KRS022对大丽轮枝菌孢子萌发及菌丝生长的影响Fig.5 Effects of KRS022 on conidia germination and hyphae development of V.dahliae
2.6 KRS022对棉花和烟草黄萎病的室内防治效果
室内防治效果显示,仅接种Vd991的棉苗植株矮小,叶片黄化萎蔫甚至脱落,维管束褐化,严重时甚至整株死亡;与之相比,经 KRS022处理后再接种Vd991的棉苗生长茂盛,维管束组织无褐化现象,同水处理对照相比无显著差异(图 6-A)。烟草室内防治效果显示,Vd991处理的烟草生长矮小,叶片黄化萎蔫,维管束组织严重褐化;而经KRS022菌液处理后,烟草植株依然保持健康,与水处理对照相比无显著差异;此外,与水处理对照相比,KRS022菌液处理的烟草植株生长更为茂密,叶面积也更宽大(图6-B),清水处理的烟草盆栽叶维度及单叶面积分别为(17.56±1.33)mm、(26.50±6.06)cm2,KRS022菌液处理的烟草盆栽叶维度及单叶面积分别为(29.09±2.93)mm、(65.30±12.00)cm2,与清水处理的烟草盆栽相比施用KRS022菌液烟草盆栽的叶维度及单叶面积增幅分别达65.7%和146.4%。以上结果表明,KRS022能够有效防治作物黄萎病,并对植物具有一定的促生效果。
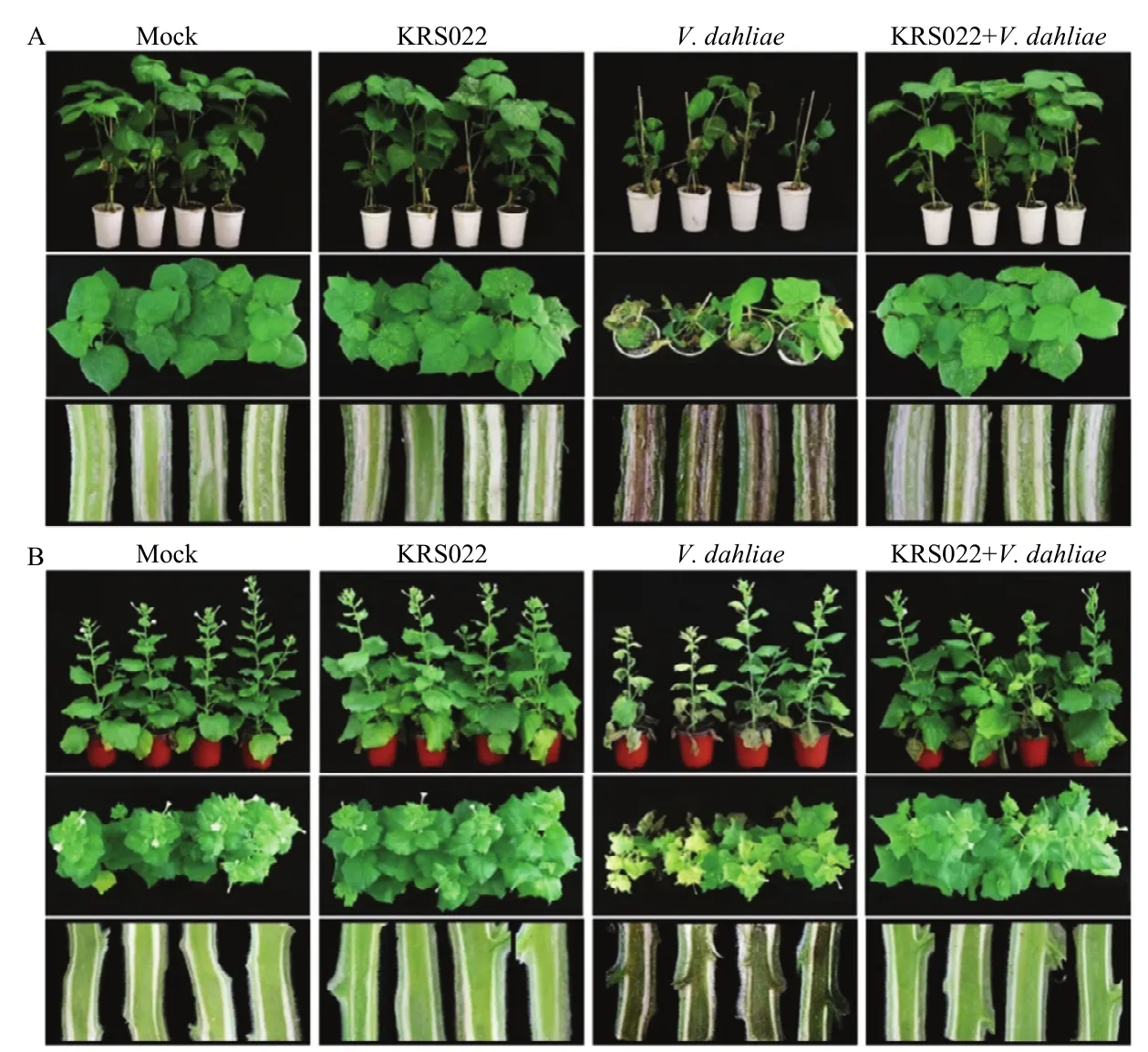
图6 KRS022菌液对棉花和烟草植株黄萎病的防治效果Fig.6 The control efficacy of KRS022 on cotton and tobacco plants Verticillium wilt
2.7 定量PCR检测大丽轮枝菌繁殖量
通过定量 PCR测定被侵染植物中病原菌的生物量,结果表明,单独接种Vd991的烟草和棉花茎基部中的真菌生物量显著高于 KRS022菌液处理后再接种Vd991的处理组,棉花和烟草对照组(单独接种Vd991)中大丽轮枝菌的生物量分别是处理组(KRS022+Vd991)的1.75和2.57倍(图7),说明KRS022能够有效抑制大丽轮枝菌对作物的侵染和繁殖。
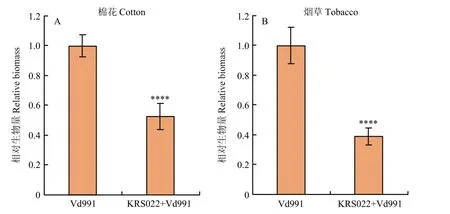
图7 棉花和烟草茎基部中大丽轮枝菌的相对生物量检测Fig.7 Detection of relative biomass of V.dahliae in cotton and tobacco stem basal tissue
2.8 KRS022激发植物免疫反应
利用RT-qPCR对KRS022菌液灌根处理后的棉花根部及注射KRS022无细胞上清液的烟草叶片防御相关标记基因的表达进行分析。结果表明,相较于清水处理的棉花植株,经KRS022处理的棉花植株中水杨酸通路标记基因GhPR1、茉莉酸通路标记基因GhAOC4和乙烯(ET)通路标记基因GhEIN2均上调表达,上调倍数分别为7.23、1.69和15.05倍,其中GhPR1和GhEIN2显著上调表达。相较于大丽轮枝菌孢子悬浮液单独处理的棉花植株,经KRS022菌液处理后再接种大丽轮枝菌,GhAOC4和GhEIN2被显著诱导表达,上调倍数分别为68.09和11.87倍(图8-A)。同样地,检测了KRS022无细胞上清液处理条件下烟草植株中HR反应标记基因(NbHIN1、NbHSR203)、水杨酸信号通路标记基因(NbPR1、NbPR2、NbPR5)以及ROS反应标记基因(NbRbohA、NbRbohB)的表达水平。结果显示,相较于空白LB液体处理的烟草植株,经KRS022菌液处理后NbHSR203、NbHIN1、NbPR1、NbPR2、NbPR5、NbRbohA、NbRbohB上调表达倍数分别为1.98、2.79、2.52、1.25、1.70、3.28、3.44倍,均显著上调。
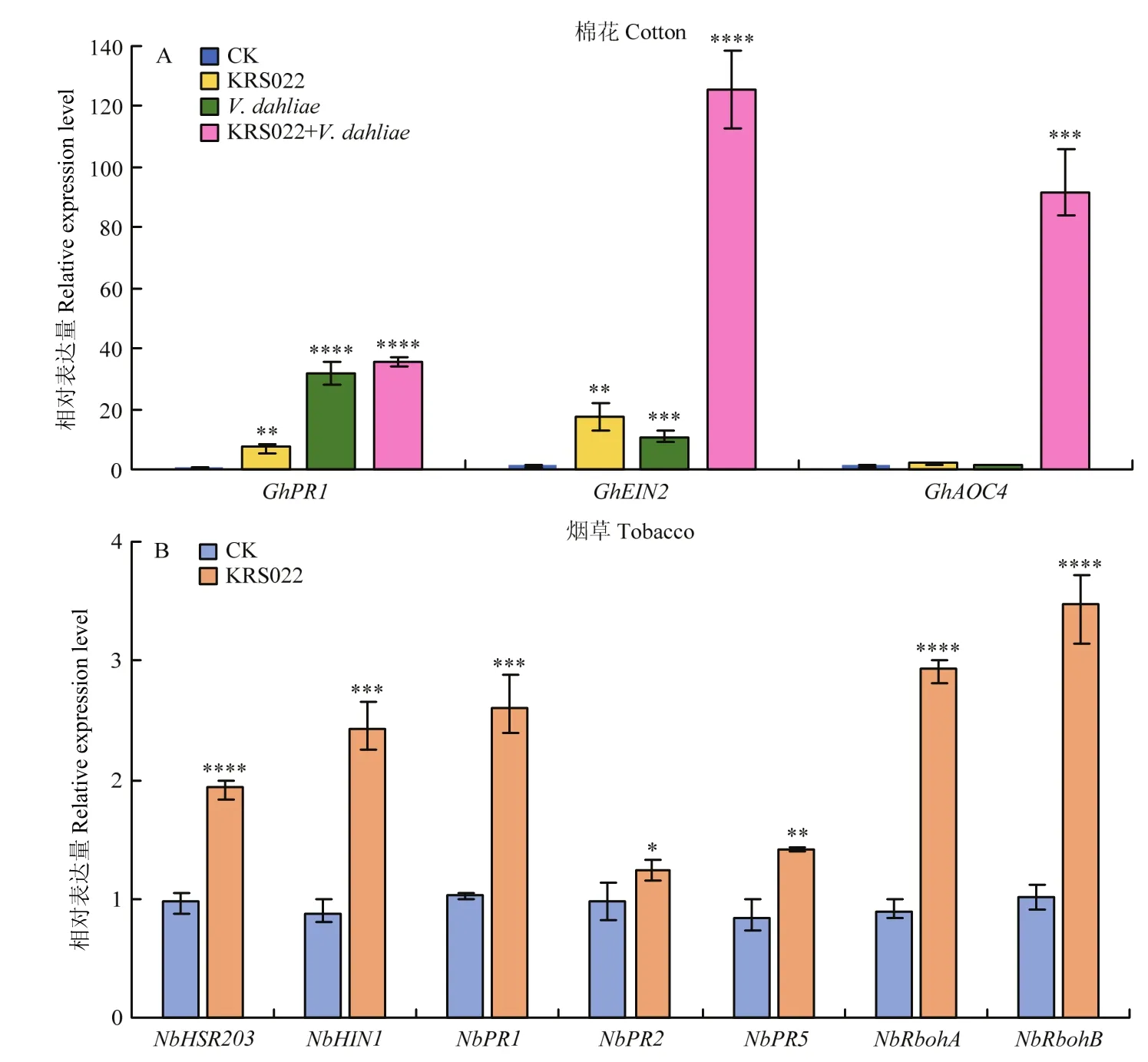
图8 KRS022诱导防御相关基因的表达Fig.8 KRS022 induces the expression of defense-related genes
3 讨论
3.1 KRS022细菌的分类地位及功能特性
假单胞菌属的不同种之间亲缘关系极为相近,16S rDNA分辨率有限,因而很多菌株只能鉴定到属水平,在种的分类上仍然需要借助其他手段加以辅助分析[32],gyrB因其进化速率快且不易发生水平转移,具有良好的分辨率,适用于区分亲缘关系较近的菌株[33]。ZHOU等[34]为明确BR-01的分类地位,使用16S rDNA和gyrB分别构建系统发育树,序列分析结果 BR-01的16S rDNA和gyrB序列与Bacillus velezensis聚集成一个分支,鉴定BR-01为贝莱斯芽孢杆菌。本研究通过形态观察并结合16S rDNA与gyrB序列串联分析,将一株拮抗细菌KRS022鉴定为产碱假单胞菌。
目前,对作物黄萎病病原大丽轮枝菌具有防治效果的拮抗微生物以芽孢杆菌居多,但对其具有拮抗活性的产碱假单胞菌相关研究和报道非常少。在筛选生防菌的过程中筛到一株产碱假单胞菌 KRS022,发现其易培养并且菌体在培养基上易扩散甚至与其融合,具有一定特殊性,笔者认为这一现象更易拮抗病原菌。为了丰富功能微生物资源,将筛选到的KRS022进一步研究,发现其对多种病原真菌具有良好的抑制作用,其中挥发性代谢产物对大丽轮枝菌的抑制效果最为突出,在作物黄萎病的防治上具有较强的研究价值。嗜铁素、吩嗪-1-羧酸、蛋白酶和2,4-二乙酰基间苯三酚等代谢产物是假单胞菌产生的较为常见的抗菌类物质[35],如荧光假单胞菌VSMKU3054产生的氰化氢、铁载体、吲哚乙酸、水解酶和2,4-二乙酰基间苯三酚对青枯菌具有抑制作用,有效抑制了番茄细菌性枯萎病的发生[36];还有部分菌株具有解磷、解钾、固氮、分泌IAA等特性,对植物生长具有促进作用[37],如铜绿假单胞菌CQ-40可以溶解磷、固定氮,并产生纤维素酶、蛋白酶、嗜铁蛋白和其他抗菌代谢物促进番茄生长并有效防治番茄灰霉病[38]。产碱假单胞菌KRS022可以产生嗜铁素以及多种类型的酶(如蛋白酶、淀粉酶和过氧化氢酶),另外还具有解磷、解钾、固氮的功能,具有促进植物生长的潜力。
3.2 KRS022的拮抗作用及诱导植物产生防御反应
拮抗微生物的预防作用一般大于治疗作用,拮抗菌能在病原菌侵染作物之前抑制病原菌是其发挥抑菌功能的关键。研究发现,拮抗菌产生的挥发性代谢产物(volatile organic compound,VOC)具有极强的抑菌活性,部分菌株的VOC对植物还具有促生效果[39],如荧光假单胞菌 UM240产生的甲硫醇和二甲基硫醚等挥发性含硫化合物对灰葡萄孢具有极强的抑制作用[40],而荧光假单胞菌ALEB7B产生挥发性含氮化合物对苍术具有促生作用[41];绿针假单胞菌(P.chlororaphis)XF10的挥发性物质对烟草黑胫病菌菌丝发育具有抑制作用[42];假单胞菌属Bt851产生的VOC具有抗菌活性,显著降低了甜菜软腐病致病因子的毒力性状,对软腐病发生表现出更高的递减效果[43]。本研究中产碱假单胞菌KRS022对大丽轮枝菌等7种病原真菌菌落生长具有明显的抑制作用,产生的挥发性物质抑菌效果也极为显著,其中挥发性物质对大丽轮枝菌菌落生长的抑制率高达 99.78%,表明挥发性物质是KRS022菌株发挥防治作用的主要抗菌活性物质之一,这为探究KRS022抑菌机理提供了线索,后续将通过气相色谱-质谱(GC-MS)、顶空固相微萃取(HSSPME)等手段对挥发性化合物成分进行鉴定,以期找到关键活性物质,为生防制剂研发提供理论依据。
假单胞菌属对作物黄萎病病原大丽轮枝菌具有良好的抑制作用。BERG等[44]从马铃薯、油菜、草莓根系及植株根际土壤中分离出抗黄萎病的生防菌,发现其中1/2的菌株为假单胞菌属,超过1/3的菌株被鉴定为恶臭假单胞菌(P.putida)。本研究通过平板对峙和对扣熏蒸试验测定了产碱假单胞菌KRS022的抑菌活性,对大丽轮枝菌抑菌效果最为显著。拮抗细菌通常能够抑制病原真菌孢子萌发和菌丝发育,如赵君洁等[45]研究发现两株拮抗芽孢杆菌与大丽轮枝菌孢子共孵育后,菌丝发生断裂或发育受损,孢子畸形或不萌发。本研究也表明KRS022能够显著抑制孢子萌发使其不萌发芽管及菌丝,导致菌丝发育畸变,说明KRS022可能通过抑制孢子萌发及菌丝生长来发挥抑菌功能。
近年来,拮抗微生物在室内盆栽及田间小区的病害防治应用中已取得了良好的效果。DUAN等[46]研究发现拮抗细菌解淀粉芽孢杆菌(B.amyloliquefaciens)QSB-6处理能够显著改善马蹄莲的生长,QSB-6菌液能够有效防止尖镰孢对根系的损害;定量PCR检测表明,QSB-6菌株处理后显著降低了土壤中尖镰孢的丰度。绿针假单胞菌YS05对盆栽番茄匍柄霉叶斑病的防治效果可达61.27%[47];从水稻叶片中分离得到的内生菌——嗜碱假单胞菌(P.alcaliphila)Ej2对水稻叶瘟和穗颈瘟的田间防治效果分别高达 83.67%和75.09%[48]。本研究发现棉花和烟草幼苗经KRS022菌液灌根处理后能够显著抑制黄萎病的发生,且能够显著抑制茎基部维管束的褐化,大丽轮枝菌在茎基部的生物量也显著降低;同时还发现仅经过KRS022菌液处理的烟草植株长势茂密且叶片宽大,株高和茎粗较水处理组也有一定程度的改善。后续将在细胞学水平、生理生化验证及基因表达水平对KRS022在植物促生方面的作用进行更详细的探究。
自然界中,植物在有害病原微生物的胁迫下会进化出不同的防御机制。拮抗微生物除了能够产生抑菌活性物质外,还能够通过诱导植物的系统性防御反应来减少或抑制病原的侵染和繁殖,如ROS响应、胼胝质沉积、HR相关基因表达、防御相关酶活性水平上升、水杨酸和茉莉酸信号通路激活、气孔关闭等[49]。本研究发现,产碱假单胞菌KRS022菌液灌根到棉花根部,棉花水杨酸通路标记基因GhPR1、茉莉酸通路标记基因GhAOC4和乙烯通路标记基因GhEIN2防御相关基因均被诱导表达;KRS022菌液无细胞上清注射到烟草叶片后,烟草HR反应标记基因(NbHlN1、NbHSR203)、水杨酸信号通路标记基因(NbPR1、NbPR2、NbPR5)以及ROS反应标记基因(NbRbohA、NbRbohB)均被诱导表达,说明KRS022可能是通过多种作用机制协同作用来发挥抑菌和促生功能,未来可对深层次的激发植物抗性机理及信号传导途径进一步挖掘。
4 结论
拮抗细菌KRS022鉴定为产碱假单胞菌,具有解磷、解钾、固氮、产铁载体的能力;对多种病原真菌具有较好的抑制效果,其中对大丽轮枝菌孢子萌发和菌丝生长具有良好的抑制作用;室内防治试验表明KRS022能够有效抑制棉花和烟草黄萎病的发生,对植物具有一定的促生作用。此外,KRS022能够显著诱导棉花和烟草中防御相关基因的上调表达,以激发植物抗性抵御大丽轮枝菌的侵染。因此,产碱假单胞菌KRS022通过直接抑制病原菌生长和诱导植物产生防御反应,抵御病原菌在植株体内侵染和扩展,从而达到防治黄萎病的目的,可作为潜在的生物防治菌剂和植物促生剂进行开发和利用。

