缺氧状态下AH患儿通过调节DC功能加重AR免疫反应及机制研究*
林超萍 雷旭艳 唐隽 仇颖妍 王凯
变应性鼻炎(allergic rhinitis,AR)是最常见的慢性上呼吸道过敏性疾病之一,由于机体接触变应原IgE 介导的鼻黏膜非感染性慢性炎性疾病,我国患病率为8%~21.4%,该疾病的大流行给患者和社会带来了沉重的负担,并影响其生活质量[1]。腺样体为咽扁桃体,位于鼻咽顶后壁的淋巴组织,参与咽淋巴环,是呼吸道的一道重要的免疫防御门户,在婴幼儿早期参与机体的免疫调节反应,一般10 岁以后开始逐渐退化萎缩,而腺样体肥大(adenoid hypertrophy,AH)可堵塞鼻咽部,引起鼻窦炎、中耳炎、心肺功能改变等临床症状,甚至影响儿童的额面部骨骼发育、性格形成和智力发育等[2]。研究表明AR 是AH 的主要原因[2-3],而缺氧状态下AH是否能够加重AR 免疫反应及机制尚不清楚。树突状细胞(dendritic cell,DC)是功能最强的抗原提呈细胞,在免疫应答中发挥着重要作用,可分为髓样DC 和浆细胞样DC 等不同特异性DC 亚群,参与维持气道炎症、调节T 细胞免疫应答和免疫耐受等作用,诱发气道变应性炎症反应和免疫反应,而白细胞介素-17 受体B(human interleukin-17 receptor B,IL-17RB)、白细胞介素-33(human interleukin-33,IL-33)及其受体(ST2)、胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)的受体(TSLPR)的表达可反映DC 的功能[4-5]。目前已有研究表明低氧诱导因子-1α(hypoxia inducible factor-1,HIF-1α)可激活DC 功能而加重AR 的Th2 介导的免疫反应,Th2 细胞分泌白细胞介素-4(IL-4)、白细胞介素-5(IL-5)和白细胞介素-17(IL-17)等细胞因子,促进嗜酸性粒细胞反应和IgE 分泌,并产生抗炎作用,可诱导免疫反应[6-7]。因此,本研究拟分析AH 患儿及AH 合并AR 患儿HIF-1α 表达、DC 功能(IL-17RB、ST2 和TSLPR)、Th2 相关因子(IL-4、IL-5和IL-17)表达,并探讨AH 合并AR 患儿HIF-1α与Th2 相关因子的相关性,为指导AR 的诊断及治疗提供重要的基础试验证据。
1 资料与方法
1.1 一 般资料 选择2018 年1 月-2020 年12 月佛山市第一人民医院鼻科诊治的100 例AH 患儿进行前瞻性研究。纳入标准:(1)AH 患儿符合睡眠时出现响亮的鼾声,伴有呼吸暂停、憋气等症状,经纤维鼻咽镜检测为AH,其中腺样体/鼻腔比值>0.6;(2)AR 诊断符合2 项及以上临床症状:鼻塞、清水样涕、喷嚏、鼻痒症等,且每天累计1 h 以上或症状持续性,皮肤点刺试验阳性,血清IgE>0.35 kU/L。排除标准:(1)鼻腔狭窄、鼻中隔偏曲、药物性鼻炎、感染性鼻炎;(2)患有免疫功能低下的疾病,如先天性免疫球蛋白缺陷等。根据是否伴有AR 将患儿分为AH 组40 例(单纯性AH 患儿),AH 合并AR 组60 例(AH 合并AR 患儿),同期选择对照组50 例(健康对照儿童)。所有AH 患儿均在全麻下进行腺样体切除术,留取鼻腔黏膜腺样体部分标本,抽取所有研究对象血液标本待用。对照组儿童在鼻内镜下检查时钳取少许鼻咽淋巴组织标本。本研究通过本院医学伦理委员会批准,所有研究对象家属均签署知情同意书。
1.2 方法
1.2.1 仪器与试剂 采用美国BD FACSAria Ⅲ流式细胞仪,全自动多功能酶标仪购自德国BMG 公司,HIF-1α 试剂盒购自美国R&D 公司(货号:RDC3272);IL-4、IL-5 和IL-17 试剂盒购自美国R&D 公司,货号分别为D4050、D5000B 和D1700。IL-17RB、ST2 和TSLPR 抗体购自美国R&D 公司货号分别为AF1207、AF523 和FAB5461P。
1.2.2 酶联免疫吸附试验(ELISA)将鼻腔黏膜组织腺样体标本切碎,匀浆后,稀释离心取上清液,提取蛋白;血液标本离心后留取血清液待测量。采用ELISA 法检测三组腺样体组织匀浆后的上清标本和血清中HIF-1α 和Th2 相关因子(IL-4、IL-5 和IL-17)表达。
1.2.3 流式分析术 采用密度梯度离心法分离出外周血单核细胞(PBMCs),采用CD14 免疫磁珠筛选单核细胞,将其置于含有重组人单核细胞集落刺激因子和IL-4 的培养基中培养,取细胞置于悬液中,PE 标记的IL-17RB、APC 标记的ST2 和Alexa Fluor 700 标记TSLPR 抗体孵育30 min,PBS 漂洗后加入相应二抗孵育,加入流式悬液,于流式细胞仪检测髓系DC 中IL-17RB、ST2 和TSLPR 的表达水平。
1.3 统计学处理 采用SPSS 21.0 软件进行统计学分析,计数资料采用()表示,多组间比较采用单因素方差分析,两组间比较采用Bonferroni 法;采用Pearson 分析HIF-1α 与Th2 相关因子的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 AH 合并AR 组、AH 组和对照组一般资料比 较 AH 合并AR 组男35 例,女25 例;年龄5~9 岁,平均(7.48±1.37)岁。AH 组男20 例,女20 例,年龄6~9 岁,平均(7.27±1.53)岁。对照组男27 例,女23 例;年龄6~11 岁,平均(7.87±2.72)岁。三组一般资料比较,差异均无统计学意义(P>0.05)。
2.2 三组HIF-1α 表达水平比较 AH 合并AR 组、AH 组血液和鼻黏膜中的HIF-1α 水平均高于对照组,且AH 合 并AR 组均高 于AH 组(P<0.001),见表1。
表1 三组HIF-1α表达水平比较[pg/mL,()]

表1 三组HIF-1α表达水平比较[pg/mL,()]
*与对照组比较,P<0.05;#与AH 组比较,P<0.05。
2.3 三组IL-17RB、ST2 和TSLPR 比较 与对照组比较,AH 合并AR 组、AH 组DC 中IL-17RB、ST2和TSLPR 的表达均明显升高,且AH 合并AR 组均高于AH 组(P<0.05),见表2。
表2 三组IL-17RB、ST2和TSLPR比较[%,()]

表2 三组IL-17RB、ST2和TSLPR比较[%,()]
*与对照组比较,P<0.05;#与AH 组比较,P<0.05。
2.4 三组Th2 相关因子比较 与对照组比较,AH 合并AR 组、AH 组血液和鼻黏膜Th2 相关因子(IL-4、IL-5 和IL-17)的表达均明显升高,与AH 组比较,AH 合并AR 组均较高(P<0.001),见表3。
表3 三组Th2相关因子比较[pg/mL,()]
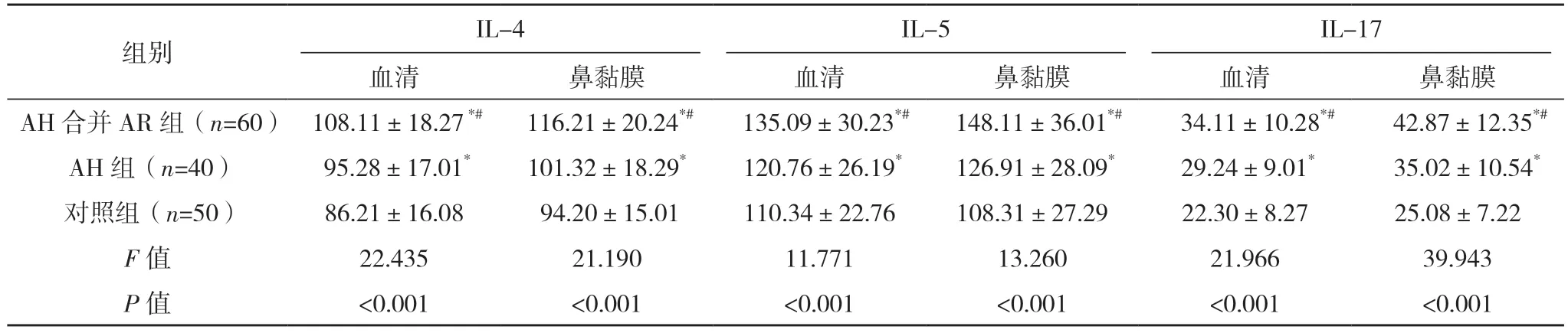
表3 三组Th2相关因子比较[pg/mL,()]
*与对照组比较,P<0.05;#与AH 组比较,P<0.05。
2.5 AH合并AR患儿HIF-1α 的表达水平与Th2 相关因子的相关性分析 血清和鼻黏膜的HIF-1α 与IL-4、IL-5 和IL-17 均呈正相关(P<0.05),见表4。

表4 AH合并AR患儿HIF-1α的表达水平与Th2相关因子的相关性分析
3 讨论
AR 是特应性个体接触变应原后,由免疫球蛋白IgE 介导,多种免疫活性细胞参与的鼻黏膜非感染性慢性炎症性疾病。AH 可阻塞呼吸道,表现为口呼吸、流鼻涕、打鼾、睡眠呼吸暂停和低鼻音等症状,手术切除是治疗该病的重要方式。AH 和AR是儿童常见病和多发病,两者可能同时存在,并可能引起相似的临床症状[8-10]。研究表明AR 是AH增生的主要因素,而在缺氧状态下AH 能否加重AR 的免疫反应尚缺乏充足的证据。阐明AH 缺氧状态对DC 功能的影响及其在AR 发病中的变应性炎症机制的作用,研究针对靶向DC 亚群细胞的治疗新策略是具有重要意义的。
HIF-1α 是一种反映机体缺氧状态的敏感性因子,在缺氧状态下,HIF-1α 的表达升高[11-12]。另有研究探讨AR 患儿存在细胞凋亡,其机制与Ras激活MAPK-HIF-1α 通路有关,但目前尚无系统性研究探讨AH 合并AR 患儿的HIF-1α 与Th2 相关因子的相关性[13]。本研究发现,与对照组比较,AH 组和AH 合并AR 组的HIF-1α 水平均明显升高,且AH 合并AR 组升高更为明显,表明AH 为慢性状态,可持续较长时间,常伴有部分或完全的鼻功能损害,导致口腔呼吸绕过鼻咽部有限的空气通道,造成慢性间歇性缺氧,同时AH 伴随AR 患儿缺氧更为明显。
白细胞介素-25(IL-25)、IL-33 和TSLP 是Th2 免疫反应发展过程中上皮细胞和DC 之间联系的基础,通过激活DC 成熟分化,刺激Th2 细胞活化,从而增强Th2 免疫应答[5,14-15]。另外,既往研究提示AR 患者骨髓DC 表达较高水平的IL-17RB、ST2 和TSLPR,与其介导的嗜酸性粒细胞性炎症反应有关[4-5],并与AR 疾病严重程度相关,与Th2 水平呈正相关[4],但上述研究尚未分析AH 患儿的缺氧指标变化及其合并AR 患者DC 功能指标变化。本研究发现,与对照组比较,AH 患儿和AH 合并AR 患儿的IL-17RB、ST2 和TSLPR 水平明显升高,且AH 合并AR 患儿升高更为明显,表明AH 患儿或AH 合并AR 患儿触发IL-17RB、ST2 和TSLPR信号通路从而激活DC 的功能在免疫应答中发挥着重要的作用。
Th2 免疫反应在AH 合并AR 患儿中发挥着重要作用,其可能通过释放IL-4、IL-5 和IL-17 等细胞因子触发免疫反应[16-18]。本研究中,与对照组比较,AH 组和AH 合并AR 组的IL-4、IL-5 和IL-17水平明显升高,且AH 合并AR 组升高更为明显;相关性分析提示,AH 合并AR 患儿HIF-1α 水平与IL-4、IL-5 和IL-17 均呈正相关。基于上述研究结果,笔者推测AH 患儿导致慢性缺氧症状,其鼻黏膜组织中HIF-1α 升高,诱发AR 的Th2 介导的免疫反应,主要机制是变应原刺激上皮细胞激活DC,释放趋化因子,募集血管内单核细胞进入气道上皮,从而分化为炎症性DC,同时DC 可调节T细胞活化,向Th2 和Th17 分化,促进B 细胞分化及合成IgE,可产生Th2 细胞因子(IL-4、IL-5 和IL-17)和趋化因子,导致气道嗜酸性粒细胞、肥大细胞和Th2 细胞浸润。研究提示,AH 合并AR患儿的病理机制可能与优势组织嗜酸性粒细胞增多和Th2 介导的炎症反应有关,但尚未探讨其与DC 功能的相关性[19-20],而本研究考虑其可能机制为DC 介导T 细胞活化,为该病的机制研究提供了更为全面的证据。本研究为单中心小样本量的研究,且本研究仅为AH 及AH 合并AR 患儿缺氧指标、免疫相关指标检测及相关性分析,尚未进行功能性试验验证其具体机制,今后需进一步多中心、扩大样本量的研究,且在相应的细胞模型进行功能性实验。
综上,AH 患儿和AH 合并AR 患儿,存在HIF-1α、IL-17RB、ST2、TSLPR、IL-4、IL-5 和IL-17 的升高,且AH 合并AR 患儿HIF-1α 水平与IL-4、IL-5 和IL-17 均呈正相关,提示AH 患儿存在缺氧状态,可能引起DC 功能激活,触发Th2介导的免疫反应。在临床上,对AH 患儿,应积极治疗腺样体的肥大和增生,改善其缺氧状态,从而减轻AR 的Th2 免疫应答反应,可达到改善AR 的过敏免疫反应。

