问题情境视角下的大单元教学设计*
——以“氧化还原反应”为例
钟国华|广东广雅中学
一、教学主题内容及现状分析
(一)教学主题内容的功能分析
人教版普通高中教科书《化学》必修第一册中的“氧化还原反应”内容,包括氧化还原反应概念建立、常见氧化剂和还原剂的认识、氧化还原反应的应用与表征、氧化还原反应的基本规律等内容。
“氧化还原反应”的教学功能不是指向具体的事实性知识的掌握,而是建立根据元素化合价能否升降判断物质是否具有氧化性或还原性的认识角度,深化结合化合价是否稳定价态去预测陌生物质氧化性或还原性是否明显的认识思路,从而习得在陌生情境推测未知物质能否反应并判断最合适产物的自主化认识路径。
(二)教学现状及学生学习障碍分析
笔者以“氧化还原反应”为检索词,发现中国知网近十年收录的新授课论文基本是单课时设计,只有朱鹏飞等人有1 篇涉及3 课时的教学设计,但没有彰显教学的工具化、功能化[1]。
受传统概念教学照本宣科、死记硬背等教学行为影响,学生长期处于被动记忆状态,对“氧化还原反应”的学习存在如下障碍:难以梳理概念之间的逻辑关系,无法自觉透过现象(元素化合价)看本质(氧化性和还原性)。例如,SO2在不同层次学生大脑中的反映(详见图1)完全不同,其思维的肤浅与深邃一目了然。
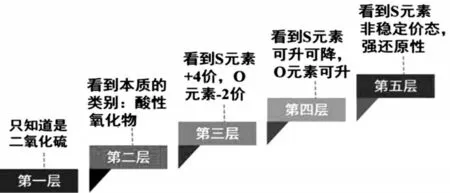
图1 SO2在不同层次学生大脑中的反映
基于以上分析,笔者以问题情境为视角,尝试对“氧化还原反应”进行大单元教学设计。
二、教学设计原则
(一)以单元设计统领教学
“氧化还原反应”4课时大单元教学设计,连续性、逻辑性、系统性更强。该设计由浅入深、环环相扣、前后呼应,由简单到复杂、由定性到定量地建构基于元素化合价变化的认知模型(详见图2),引导学生逐步形成基于元素化合价进行判断的化学视角。

图2 基于元素化合价变化的认知模型
(二)基于情境引领意义生成
崔允漷提出只有在真实情境下运用多种知识完成特定的任务,才能评估关键能力、必备品格和价值观念[2]。笔者每课时创设2个问题情境,并将各问题情境分解成多个问题片段,以此呈现知识脉络,让学生在参与中发现知识、体验方法。这4个课时的问题情境在情境层次、思考层次、活动层次、认识方式上遵循如下进阶原则。
情境层次:熟悉原型—简单变式—复杂陌生—复杂陌生。
思考层次:给定角度—提示角度—自主运用—多角度系统。
活动层次:A3-说明论证—B2-推论预测、B3-简单设计—C1-复杂推理—C3-创新思维。
认识方式:认识角度建立—认识角度建立、认识思路形成—认识思路形成、认识方式自主化—认识方式自主化。
(三)基于问题情境实现从知识到能力再到素养的发展
在学科大概念的指引下,笔者提出基于问题情境实现从知识到能力再到素养发展的教学流程“任务驱动—总结经验—形成程序—建立模型—迁移应用—深化认知”,并结合系列学科能力活动,引导学生逐步实现素养发展。
三、教学目标
高一阶段的“氧化还原反应”所呈现的内容,是对初三阶段从得失氧角度孤立地看待氧化反应或还原反应这一内容的提升,是对本质的进一步探讨。学习前,学生只有最表层的氧化反应和还原反应的概念,相对割裂与静止。学习中,学生要从化合价的角度重新审视氧化还原反应的相关概念,判断物质转化的可能性,进而形成基于氧化还原反应视角分析和解决相关问题的思路方法,最终从反应的定性判断上升至定量研究物质的数量关系。这是实现知识的结构化和功能化,促进知识向能力和素养转化的重要途径。基于学情,笔者确定如下教学目标。
第一课时:(1)通过课本“思考与讨论”栏目的分析,建立和发展从化合价判断氧化还原反应相关概念的认识角度;(2)通过在四大基本反应类型中尝试找出一个氧化还原反应并判断基本概念,建立四大基本反应类型与氧化还原反应的关系,诊断并发展学生对化学反应分类的认识。
第二课时:(1)通过预测H2S、H2O2是否有氧化性或还原性、性质是否明显,建立通过元素是否稳定价态判断明显氧化性或还原性的模型,诊断并发展学生证据推理和科学探究的水平;(2)通过设计实验验证H2O2既具有氧化性又具有还原性,以及回顾初三关于酸碱性的证明方法,建立证明氧化性、还原性的实验设计模型,诊断并发展学生使用模型、方案设计和科学探究的水平。
第三课时:(1)通过预测浓硫酸与镁能否反应,巩固从氧化还原分析物质变化的认识角度;通过浓硫酸对应产物的判断,建立通过化合价分析产物的思维模型,诊断并发展学生对物质及其转化思路的认识水平,从静态到动态、从定性到定量;(2)通过改编课后练习,充分挖掘化合价的功能,养成主动从化合价认识化学反应,初步建立基于电子得失守恒的定量思想。
第四课时:(1)通过KMnO4、MnO2、Cl2氧化性强弱的判断,建立根据方程式“以强制弱”或者反应物相同时根据反应条件推断的模型;(2)通过Mg、Fe、Cu 还原性强弱的判断,建立根据金属活动性顺序表、反应剧烈程度、相互置换等进行判断的认识角度,进而推断出金属阳离子氧化性的强弱顺序,诊断并发展学生“以强制弱”的转化观,发展学生对氧化还原反应先后问题的认识水平。
四、教学过程
(一)第一课时
1.任务驱动
师:请根据初中学过的氧化反应和还原反应的知识,分析课本第20 页“思考与讨论”中的反应并填写表格。
(学生填写表格并发表意见)
师:从上述分析可知氧化反应与还原反应同时发生,故统称氧化还原反应。请标出各物质所含元素的化合价,比较反应前后价态有无变化,并简单归纳氧化反应或还原反应与元素化合价升降的关系。
(学生应能得出:物质所含元素化合价升高时,该物质发生氧化反应;物质所含元素化合价降低时,该物质发生还原反应)
【设计意图】通过对比与归纳,在初三的基础上进一步拓展氧化还原反应的概念。
2.总结经验
师:写出金属钠和Cl2的反应,分析哪种物质发生氧化反应。
(学生应能得出:钠元素化合价升高,金属钠被氧化,发生氧化反应)
师:(板书)使用双线桥的基本方法呈现分析过程。
【设计意图】通过金属钠和Cl2的反应,强化从化合价判断的过程。
3.形成程序
师:画出Na和Cl的原子结构示意图,分析Na、Cl元素化合价的变化原因。
(学生应能得出:Na最外层只有1个电子,容易失去1个电子,Cl最外层有7个电子,容易得到1 个电子,由此二者分别形成稳定的离子,从而组成物质)
师:H2和Cl2的反应呢?都容易形成离子吗?
(学生应能得出:Cl 的情况跟上面一样,而H虽然最外层只有1个电子,但它希望变成最外层是2个电子的稳定结构,所以它们都趋向得到电子)
师:这种情况下H 和Cl 形成一对共用电子对,使得每个原子都是稳定结构。
【设计意图】通过分析原子结构示意图,实现从宏观辨识到微观探析的转变,形成结构决定性质的结构观。
4.建立模型
师:从Zn、Ag、HCl、CuO 中选择合适反应物组成氧化还原反应,用双线桥表示电子转移方向和数目,判断发生氧化反应的物质。
(学生书写与表达)
师:总是用“发生氧化反应”来描述Zn 不够方便,我们可使用“还原剂”来定义失电子的反应物,它生成的产物叫“氧化产物”。同理,我们可用“氧化剂”来定义得电子的反应物,它生成的产物叫“还原产物”。
【设计意图】通过具体的反应,建立起“化合价升高,失电子,做还原剂,被氧化,发生氧化反应,转化成氧化产物;化合价降低,得电子,做氧化剂,被还原,发生还原反应,转化成还原产物”的思维分析模型。
5.迁移应用
师:尝试在四大基本反应类型的每类反应中找到一个氧化还原反应,指出氧化剂、还原剂、氧化产物、还原产物。若找不到,请说明理由。
(学生应能得出:只有单质参与的化合反应或分解反应才可能涉及化合价变化,才可能是氧化还原反应;置换反应一定有单质变成化合物的过程,有化合价变化,因此全是氧化还原反应;复分解反应是离子两两交换,没有化合价变化,一定不是氧化还原反应)
【设计意图】引导学生主动利用化合价模型判断四大反应与氧化还原反应的关系,发展其对化学反应的认识。
6.深化认知
师:我们已经学习了氧化还原反应的众多核心概念,那么,其核心判断依据是什么?
(学生应能得出:化合价)
师:课后尝试寻找中学阶段常见的氧化剂和还原剂,它们的氧化性和还原性体现在什么元素?试用所学知识解释O2、Cl2为什么是常见的氧化剂。
【设计意图】巩固根据原子结构模型推断物质氧化性、还原性,深化“结构决定性质”的化学观念。
(二)第二课时
1.任务驱动
师:将赤铁矿制成铁制品,要加入什么试剂?
(学生应能得出:Fe2O3中Fe 元素由+3 价降到0价,被还原,因此要加入还原剂)
【设计意图】回顾根据化合价判断氧化还原的基本概念。
2.总结经验
师:理论上能做氧化剂或还原剂的试剂具有什么特点?
(学生应能得出:物质中存在化合价可降低的元素,理论上可做氧化剂;物质中存在化合价可升高的元素,理论上可做还原剂)
师:因此我们要掌握常见元素化合价的变化区间,下面来核对作业填写的表格(略)。中学阶段常用作氧化剂的物质有O2、Cl2、浓硫酸、HNO3、KMnO4、FeCl3等,常用作还原剂的物质有活泼的金属单质如Al、Zn、Fe,以及C、H2、CO、KI等。若遇到陌生试剂,该如何分析?
【设计意图】掌握常见元素化合价变化区间,形成通过判断化合价能否升降从而判断是否具有理论上的氧化性或还原性的经验。
3.形成程序
师:预测H2S 是否具有氧化性或还原性。分别体现在哪种元素?
(学生应能得出:H2S中H元素是+1价,能降低,有氧化性;S 元素是-2 价,能升高,有还原性)
师:常见试剂浓H2SO4、HNO3、KMnO4、FeCl3的氧化性以及KI 的还原性,分别体现在哪种元素?
(学生应能得出:分别是+6价的S、+5价的N、+7 价的Mn、+3 价的Fe、-1 价的I。部分学生会进一步提问:浓H2SO4、HNO3的氧化性有可能体现在+1价的H元素吗?)
师:从理论分析来看,你们提出的问题是有可能的,待会进一步分析。
【设计意图】培养元素观,引导学生主动从元素化合价的角度思考和分析氧化还原反应的相关问题。
4.建立模型
师:请预测H2S 氧化性或还原性是否明显,说出判断依据。
(学生应能得出:H 元素能降价,S 元素能升价,H2S氧化性和还原性都很明显)
师:往约2mLNa2S 溶液中滴加5~6 滴盐酸,发生什么反应?观察并记录现象。
(学生实验后得出:不仅闻到臭鸡蛋气味,还看到黄色浑浊出现)
师:从元素角度分析,黄色浑浊最可能是什么?由哪种物质转化而来?
(学生应能得出:最可能是S单质,应该是由生成的H2S转化而来)
师:H2S如何转化成S单质?
(学生应能得出:可能是被空气中的O2氧化生成的)
师:O2是常见的氧化剂,在这个实验中能把生成的H2S 快速氧化成硫单质,可见S 元素还原性很强。为什么S元素的还原性很强,而H元素的氧化性不明显呢?这是由元素价态是不是稳定价态决定的。氧化或还原性质明显的物质一般含有不稳定价态的元素。常见的稳定价态有H(+1)、Na(+1)、Mg(+2)、Al(+3)、Mn(+2)、C(+4)、N(0)、S(0)、S(+6/水溶液)、Cl(-1)。
【设计意图】建立“元素化合价能否升降→理论上的氧化性或还原性→元素化合价是否稳定价态→氧化性还原性是否明显”的思维模型。
5.迁移应用
师:根据所学知识,判断H2O2是否具有氧化性或还原性?是否明显?
(学生有两种回答:其一,H元素+1价是稳定价态,所以H 元素体现的氧化性不明显;其二,O 元素-1 价是中间价态,既能升价体现还原性,也能降价体现氧化性,而且不是稳定价态,所以O 元素体现的氧化性和还原性都明显)
师:判断H2O2体现氧化性或还原性哪种更容易,为什么?
(学生应能得出:因为O 元素的稳定价态是-2价,因此H2O2降价到-2价更容易,可能氧化性更明显)
【设计意图】强化学生主动利用已有模型进行分析的意识,提升基于化合价进行证据推理的能力。
6.深化认知
师:如何设计实验验证H2O2既有氧化性又有还原性?说出设计思路。
(学生应能得出:要证明H2O2有氧化性,可以选择和还原剂反应;要证明H2O2有还原性,可以选择和氧化剂反应)
师:除此以外,实验中还需要考虑什么问题?(学生应能得出:还要产生明显的现象)
师:实验中有哪些明显的实验现象?
(学生应能得出:产生沉淀、气体,或者溶液颜色有改变)
师:那会选择哪些常见试剂?
(学生应能得出:可以选择KMnO4溶液和淀粉碘化钾溶液)
师:请预测往H2O2中加入KMnO4溶液后有哪些产物生成,如何简单检验?
(学生应能得出:H2O2被氧化后会有O2产生,可以用带火星木条检验)
师:请分组实验,记录现象,验证猜想。
(学生做实验来验证)
师:至此,我们已经掌握两个认识和分析化学反应的工具——物质分类和氧化还原,形成研究陌生物质性质的一般程序(详见图3)。

图3 研究陌生物质性质的一般程序
【设计意图】渗透证明氧化性、还原性的实验设计思路;强化对中学阶段常见氧化剂、还原剂的理解;能初步结合化合价变化预测产物。
(三)第三课时
1.任务驱动
师:预测浓硫酸与金属镁能否反应,说出判断依据。
(学生会有两种回答:其一,浓硫酸是酸,镁是活泼金属,二者能发生反应;其二,浓硫酸是常见氧化剂,镁是常见还原剂,二者能发生反应)
【设计意图】回顾从常见氧化剂和还原剂的角度判断反应能否进行。
2.总结经验
师:在浓硫酸与金属镁的反应中,浓硫酸可能转化成什么还原产物?
(学生会有两种回答:其一,还原产物是H2;其二,H元素+1价是稳定价态,非水溶液中的S元素+6价不是稳定价态,所以应该得到低价态的含硫物质)
师:+1 价H 元素氧化性相对于非水溶液中的+6价S元素并不明显,因此初三课本上的结论是不能利用活泼金属和浓硫酸发生置换反应生成H2。
【设计意图】形成根据化合价变化趋势判断可能产物的经验。
3.形成程序
师:已知金属镁和浓硫酸反应,产生大量刺激性气体,试判断其他产物。
(学生应能得出:还有MgSO4)
师:Mg元素有可能转变成MgO或Mg(OH)2吗?
(学生会有两种回答:其一,有可能,因为反应后Mg元素变成+2价;其二,不可能,这是在浓硫酸中反应,即使生成也会进一步转变成MgSO4)
师:在分析产物时,我们不能只考虑元素化合价的变化,还要考虑产物在环境中能否共存。
【设计意图】引导学生基于价态变化、大量共存的角度推断合理产物。
4.建立模型
师:写出上述反应完整的化学反应方程式,并说出配平依据。
(学生应能得出:Mg 元素化合价升高2价,S 元素化合价降低2 价,所以Mg 和SO2是1∶1 的数量关系,再通过元素守恒依次确定MgSO4、H2SO4和H2O的系数)
师:根据Mg 元素化合价升高2 价,S 元素化合价降低2价,为何不是确定Mg和H2SO4是1∶1的数量关系?
(学生应能得出:H2SO4中有部分S元素要转移到MgSO4,化合价不变)
【设计意图】引导学生建立氧化还原方程式配平的程序,即电子得失守恒→元素守恒,尤其要注意部分做氧化剂或者还原剂的物质配平问题。
5.迁移应用
师:请在下列横线上补充合适的产物,对方程式进行配平,并说出H2O2的作用(氧化剂还是还原剂)。
①H2O2+H2S=S↓+__________
②H2O2+Cl2=O2+__________
③H2O2=H2O+__________
(学生应能得出:方程式①中S元素升价,H2O2中的O 元素就要降价到-2 价,生成H2O;方程式②中O 元素升价,Cl2中的Cl 元素就要降价到-1,生成HCl;方程式③中O元素降价,H2O2中的O元素就要升价,生成O2)
师:为何大家都不考虑H元素变价?
(学生应能得出:H 元素的+1 价为稳定价态,不易变价)
【设计意图】强化学生将化合价作为工具去分析试剂、找出对应的产物,以及根据化合价升降守恒配平方程式的意识和能力。
6.深化认知
师:对于上述反应②,在不完整书写方程式的前提下,怎么判断反应物H2O2和Cl2的系数比?
(学生应能得出:根据H2O2中O 元素共升2价,Cl2中Cl元素共降2价,因此二者1∶1就可满足化合价升降相等)
【设计意图】强化氧化还原反应的定量本质,渗透守恒观,为关系式法计算打下基础。
(四)第四课时
1.任务驱动
师:结合给定反应,比较MnO2、KMnO4、Cl2氧化性强弱并说明理由。
(学生有两种回答:其一,根据氧化剂氧化性强于氧化产物可知氧化性KMnO4>MnO2>Cl2;其二,根据KMnO4在常温下可以氧化浓盐酸而MnO2需要加热才能做到可知,氧化性KMnO4>MnO2)
【设计意图】渗透利用与相同反应物反应的条件难易程度判断反应物性质差异的知识。
2.总结经验
师:比较Mg、Fe、Cu还原性强弱并说明理由。
(学生应能得出:根据金属活动性顺序表可知还原性Mg>Fe>Cu)
师:金属活动性顺序表本质就是不同金属和等浓度等体积的同种非氧化性酸反应置换出H2难易程度的体现。
【设计意图】唤醒学生对金属活动性顺序表的记忆,再次强化其对控制变量法的理解。
3.形成程序
师:若要通过置换实验来证明Mg、Fe、Cu还原性强弱,至少要完成多少个实验?写出对应的化学方程式。
(学生应能得出:Mg+FeCl2=MgCl2+Fe,Fe+CuCl2=FeCl2+Cu)
师:根据已有知识判断方程式中物质氧化性的强弱。
(学生应能得出:在氧化性上,CuCl2>FeCl2>MgCl2)
【设计意图】培养转化观,强化“强制弱”的规律。
4.建立模型
师:-1价的Cl是稳定价态且是最低价,不可能具有氧化性,那么这三种盐氧化性强弱的本质是什么?
(学生应能得出:本质是三种离子在氧化性上的表现,即Cu2+>Fe2+>Mg2+)
师:尝试归纳金属阳离子氧化性与金属单质还原性的关系。
(学生应能得出:金属单质还原性越强,对应金属阳离子的氧化性就越弱)
【设计意图】结合金属活动性顺序表建立物质和离子氧化性、还原性强弱的模型。
5.迁移应用
师:结合今天所学知识解释初三的化学问题:金属活动性顺序表中的氢前金属为何能和盐酸反应置换出H2,而氢后金属不行?
(学生会有两种回答:其一,金属单质还原性越强,对应金属阳离子的氧化性就越弱;其二,在氧化性上,氢后金属阳离子>H+>氢前金属阳离子。这就表明初三阶段学习的置换反应满足强氧化剂生成弱氧化剂的规律)
【设计意图】强化学生利用阳离子氧化性强弱模型来解释初三教材中相关结论的能力,实现迁移应用。
6.深化认知
师:请解释往AgNO3和Cu(NO3)2混合液中加入少量铁粉的反应先后问题。
(学生应能得出:在氧化性上Ag+>Cu2+,因此少量铁粉会先和Ag+发生氧化还原反应)
师:这就从本质上解决了氧化还原反应的先后问题,而不是像初三那样解释:如果铁置换出铜,铜也会继续置换出银,所以是先置换出银。
【设计意图】让学生自觉利用阳离子氧化性强弱模型来解释反应先后的问题。
五、总结
其一,笔者以“氧化还原反应”的学科大概念为统领,创设驱动问题情境,充分体现“以知识为载体、以能力为主线、以素养为目标”的设计思想,使知识巩固、方法训练与能力提升成为统一的过程。这些问题情境,既要用脑分析预测,又要用手写出符号表征,还要用口说出依据,有效避免了“为了概念而讲概念”的教学误区。
其二,该大单元设计的核心教学目标是建立从氧化还原的视角分析问题的学科模型。教学中,笔者基于问题情境开展“建立模型→运用模型→完善模型”教学,使学生实现从给定角度来思考问题到不给方向自觉分析问题的转变。
其三,建立“氧化还原反应”的概念并不是该大单元教学的核心目标,让学生透过元素稳定价态识别性质并能在陌生情境中结合氧化还原分析反应类型才是核心目标。可喜的是,在此次教学后笔者发现,在元素化合物后续教学中,凡是与氧化还原反应相关的问题,学生均表现良好,基本实现了“基础知识→活动经验→核心观念→认识方式→学科素养”的转变。

