不同植物组合的生态浮床对浅水富营养化湖泊水质净化效果及浮游动物群落结构的影响
梁翼东,匡箴,孙宁泽,顾佳林,徐东坡,*
(1.上海海洋大学 水产与生命学院,上海 201306;2.中国水产科学研究院淡水渔业研究中心 农业农村部淡水渔业和种质资源利用重点实验室,江苏 无锡 214081;3.南京农业大学 无锡渔业学院,江苏 无锡 214081)
淡水富营养化始终是世界范围内湿地、河流、湖泊和水库中普遍存在的环境问题[1]。治理富营养化水体的传统方法,一般采用物理修复手段或化学手段,如清淤挖泥、冲刷河道和覆盖沉积等措施,但上述措施难以应用于治理大型湖泊的实际工作中。水生植物对污染物具有较强的耐受性,可以通过吸附、吸收、积累和降解等方式,减轻或固定水体中的营养物和污染物[2]。研究发现,水葫芦(Eichhorniacrassipes)和水莴苣(Pistiastratiotes)等大型植物可用于提高水体质量[3],狐尾藻(Myriophyllumverticillatum)、眼子菜(Potamogetonspp.)、芦苇(Phragmitesaustralis)、宽叶香蒲(Typhalatifolia)、浮萍(Lemnagibba)和美人蕉(Cannaindica)等可用于池塘废水处理[4]。因此,在不同的水处理系统中可引入水生植物生态浮床进行水体原位修复[5]。
生态浮床技术是一项基于原位修复理念的水体修复技术,具有经济、高效和无二次污染的特点[6]。生态浮床的立体结构能够为浮游动物提供庇护所[7],使其躲避鱼类的捕食,且浮床植物可通过化感作用进而影响浮游动物,但其具体机制有待进一步研究[8]。生态浮床的置入不仅对整个湖泊生态系统的恢复起到良好的调节作用,而且会从多方面影响到浮游动物的生境,是影响浮游动物群落结构组成、生物量和丰度的重要因素。由于浮游动物种类组成、生物量及丰度的变化,会受到湖泊环境条件、水质状况和人类活动的影响,不同种类浮游动物对湖泊环境的敏感性和适应性存在差异[9],故浮游动物会随着环境的变化产生不同的响应。目前,已有不少在生态浮床中引入水生植物治理水体富营养化的研究报道,如在淀山湖置入带有美人蕉、黄菖蒲和水芹等水生植物的生态浮床,可有效削减富营养化水体中的高锰酸盐指数、氨氮、总氮和总磷浓度,并能提高水体透明度[10]。
生态浮床虽然对整个湖泊生态系统恢复具有重要意义,但其在水体修复过程中是否会对其他生物群落产生影响尚未见报道。近20年来,太湖周边工农业发展迅速,蓝藻水华聚集暴发,水体富营养化程度严重,迫切需要进行治理。因此,在太湖开展相关试验,有助于更好地了解生态浮床在大型富营养化湖泊中对水体修复效果及水生生物影响。本研究中,在太湖梅梁湾渔业生境修复与资源养护示范区内用不同植物组合的生态浮床进行了修复试验,通过比较修复区域与未修复区域内各自浮游动物群落的组成和结构变化,探究了浮游动物群落结构对生态修复措施的响应,以期为富营养化湖泊治理提供科学依据。
1 材料与方法
1.1 材料
1.1.1 研究区域概况及试验设施 梅梁湾(31°28′15″N,120°12′40″E)地处太湖北部湖湾,位于江苏省无锡市郊,面积约为 132 km2,平均水深约为 2 m,常年暴发蓝藻,富营养化程度严重。根据研究内容,在梅梁湾湖区内设置小型围隔设施和小型围网设施各6个,围隔和围网内生物群落与对照组无差异。围隔尺寸为15 m×25 m,每个围隔设 26根钢桩,防水布高为3 m,上沿高于水面1 m,防水布底部用石笼压实深入淤泥层底部,以隔绝内外水体交流;围网尺寸为15 m × 25 m,每个围网设18根钢桩,围网高为3 m,上沿高于水面1 m,围网底部用石笼压实深入淤泥层底部。试验区域总面积为4 500 m2。
1.1.2 供试植物 依据生态浮床植物选种原则,结合梅梁湾湖区气候条件及风浪等因素,综合考虑混合种植效果,本试验中以美人蕉(Cannaindica)为基础,选取美人蕉+菖蒲(Acoruscalamus)+芦苇(Phragmitesaustralis)和美人蕉+水芹(Oenanthejavanica)+慈姑(Sagittariasagittifolia)两种植物组合方式。
1.2 方法
1.2.1 试验系统 2021年4月初将不同植物组合的生态浮床置入围隔、围网设施内,浮床覆盖面积占围隔、围网面积(15 m×25 m)的8%,其中每组生态浮床中包括3种植物,每类植株为270盆,3种植株合计810盆。整个试验系统包含2个围网植物组合修复区(P1和P2)及2个围隔植物组合修复区(E1和E2),每个系统设置3个重复,共计12个试验区,同时设置3个对照组(未修复区),即周围无浮床区域,共计15个试验组(图1和图2)。所有浮床单体由尼龙绳串联之后固定于不锈钢桩。结合设施建立及浮床植株长势良好的生长周期,于2021年6月对该系统进行采样,以期能准确反映生态浮床修复效果。

本图基于自然资源部标准地图服务网站GS(2019)4345号标准地图为底图,底图边界无修改。The figure is based on the standard map GS(2019)4345 in the Standard Map Service website of Ministry of Natural Resources of the People’s Republic of China,with no modifications of the boundaries in the standard map.图1 梅梁湾采样点分布Fig.1 Map of sampling sites in Meiliang Bay

图2 示范区Fig.2 Demonstration area
1.2.2 水样采集 使用有机玻璃采水器,参照5点采样法自湖底向湖面采集混合水样,并使用多通道便携式水质分析仪(HACH)现场测定浊度(Tur)、水温(WT)、酸碱度(pH)、溶解氧(DO)和水深(WD)指标,使用赛氏盘现场测定水体透明度(SD)。根据国家环境保护总局《水和废水监测分析方法》测定营养盐指标,主要包括总氮(TN)、总磷(TP)、高锰酸盐指数(CODMn)和叶绿素a(Chl-a)等。
1.2.3 浮游动物定量样品的采集与鉴定 用1 L样品瓶采集原生动物和轮虫定量样品,现场加入10 mL鲁哥试剂固定,带回实验室沉淀浓缩,定容至40 mL。用有机玻璃采水器采集枝角类和桡足类浮游动物定量样品水样20 L,通过 13#(112 μm)浮游生物网过滤浓缩至50 mL定量瓶中,现场加入体积分数为4%的甲醛2 mL固定并加以标注。
浮游动物样品鉴定前进行预处理。将样品静置沉淀24 h,用移液枪吸取上清液30~40 mL,在Zeiss Axio Imager 4.2显微镜下对浮游动物进行种类鉴定与计数。鉴定前充分混匀浓缩样品,原生动物和轮虫用1 mL计数框进行全片计数,每瓶样品计数两片,取其平均值,每片结果与平均数之差小于±15%,若超过±15%则进行第3片计数,最后将两个相近值的平均数作为最后的计算结果;枝角类和桡足类用5 mL计数框将样品分若干次全部计数。
根据公交刷卡乘客上、下车站点识别结果,统计得到543路公交车在12月29日早高峰时段上行方向在各站点的上、下车人数,如图5所示.
1.2.4 浮游动物定性样品的采集与鉴定 用25#(64 μm)浮游生物网在上层水体呈“∞”字形捞取3~5 min,采集原生动物和轮虫定性样品,并过滤浓缩至50 mL定量瓶中,现场加入2 mL鲁哥试剂固定。用13#(112 μm)浮游生物网在表层水体呈“∞ ”字形拖曳3~5 min,采集枝角类和桡足类浮游动物定性样品,然后将样品滤缩至50 mL定量瓶中,现场加入体积分数为4%的甲醛溶液1 mL固定。用Zeiss Axio Imager 4.2显微镜在100~1 000倍下进行浮游动物种类鉴定。
1.2.5 生物量计算 通过查表(《水生生物学》P494~P498、P505~P506)[11]或采用体积换算法(109μm3≈1 mg)计算获得生物量。参照《水生生物学:形态和分类》[12]、《中国淡水轮虫志》[13]和《淡水微型生物图谱》[14]等的方法鉴定种类。
1.2.6 优势种 运用优势度Y计算优势物种,计算公式为
Y=(ni/N)×fi。
(1)
其中:ni为第i种的个体数;N为样品中浮游动物总个体数;fi第i种的出现频率。Y>0.02 为优势种。
1.2.7 浮游动物的多样性 用Shannon-Wiener多样性指数 (H′)、Margalef丰富度指数(D)[15]评价浮游动物的多样性。计算公式为
H′=-∑Pilog2Pi,
(2)
D=(S-1)/lnN。
(3)
其中:S总种类数;N为样品中浮游动的总个体数;Pi为样品中第i种的个体数占比,Pi=ni/N,ni为第i种的个体数。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示。采用SPSS 22.0 软件进行单因素方差分析(one-way ANOVA),显著性水平设为0.05,极显著性水平设为0.01。采用RDA分析浮游动物生物量与环境因子的关系;参考《数量生态学:R语言的应用》[16],运用R 3.5.3软件的Rstudio窗口进行排序及分析,其中,浮游动物生物量与环境因子数据经lg(X+1)转换后,先进行去趋势对应分析(DCA),根据各轴距再进行冗余分析(RDA)或典型相关分析(CCA),确定其相关性。采用SPSS 22.0软件进行Pearson相关性分析。
2 结果与分析
2.1 水质理化指标的变化
从表1可见:调查期间,修复区内水温变化范围小,平均值为(27.73±0.39)℃;与对照区相比,P1和P2区pH平均增加了22.47%,溶解氧平均增加了21.42%,浊度平均减少了42.66%,水体透明度平均增加了41.67%;与对照区相比,E1和E2区pH平均增加了20.90%,溶解氧平均增加了1.87%,水体透明度平均增加了312.50%,浊度平均减少了87.69%;4个试验组TN、TP和CODMn均显著低于对照组(P<0.05),且植物组合1比植物组合2有较强的TN、TP和CODMn去除率,其中,P1和E1对TN、TP和CODMn的平均去除率分别达到39.33%、38.64%和37.63%,P2和E2对TN、TP和CODMn的平均去除率分别达到32.22%、31.82%和34.19%;4个试验组Chl-a浓度均显著低于对照组(P<0.05),且E1和E2对Chl-a的去除率分别为67.85%和50.36%。综上可知,两种不同类型的生态浮床对梅梁湾修复区TN、TP和CODMn有良好的去除作用,其中,植物组合1(美人蕉+菖蒲+芦苇)对水体具有较强的净化作用。
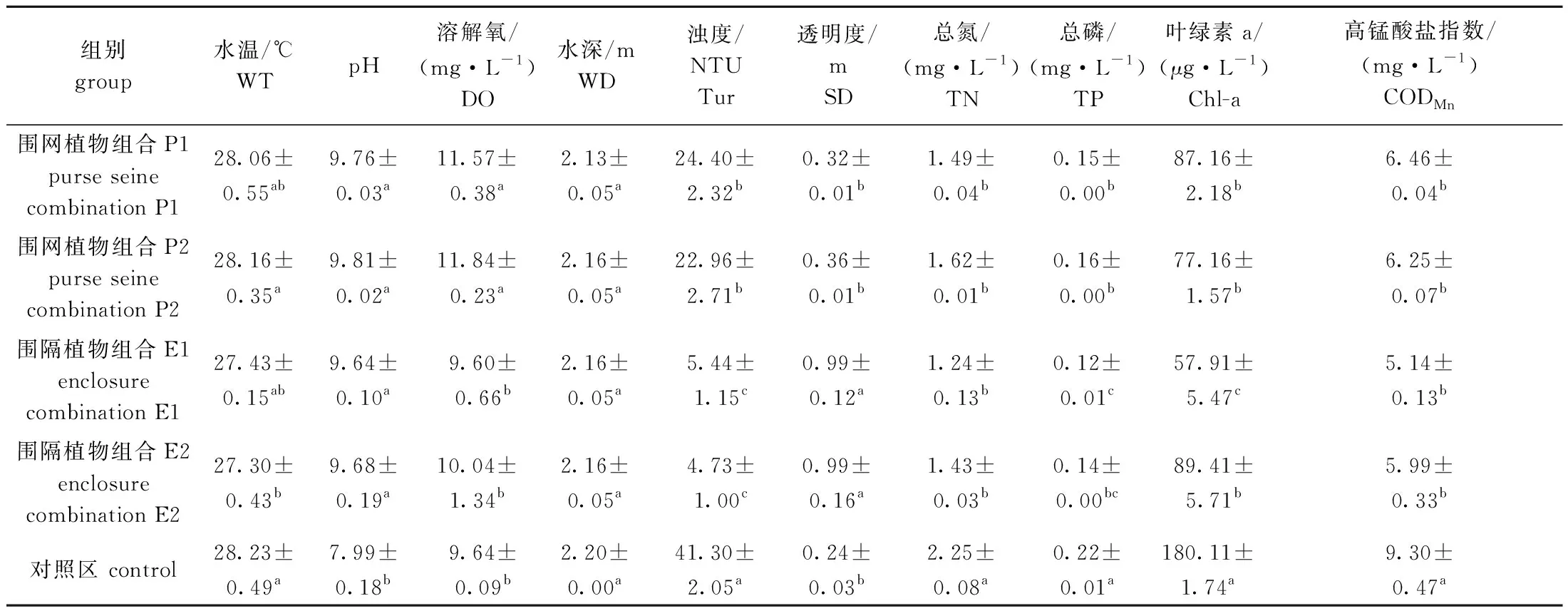
表1 各采样点的环境因子Tab.1 Environmental factors at each sampling site
2.2 浮游动物的种类组成
调查期间共鉴定出浮游动物28属44种,其中,原生动物类9属12种,轮虫类12属20种,枝角类5属7种,桡足类2属5种。浮游动物群落以轮虫为主,占物种总数的45.45%,其次是原生动物(占27.27%),桡足类最少(占11.36%)。修复区浮游动物物种数39种,对照区23种(表2)。
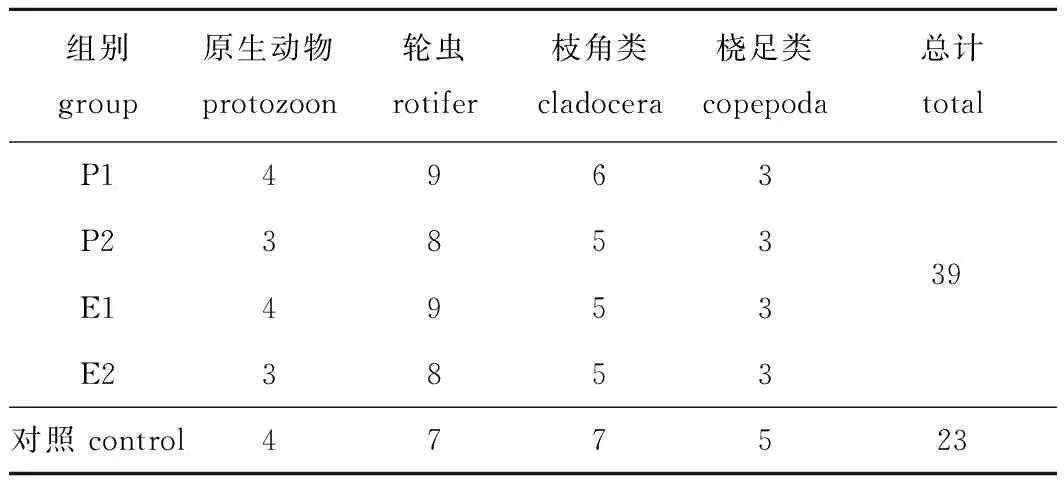
表2 修复区与对照区浮游动物的种类组成Tab.2 Species composition of zooplankton in the control area and treatment area
2.3 浮游动物的优势种
调查期间共鉴定出浮游动物优势种类10属10种,优势种包括原生动物3种,轮虫7种(表3)。从种类组成分析,原生动物中天鹅长吻虫(Lacrymariaolor)在对照区占优势;阔口游仆虫(Euploteseurystomus)在围隔植物组合中占优势;淡水麻铃虫(Leprotintinnusfluviatile)在围网植物组合中占优势。轮虫7种优势种中,针簇多肢轮虫(Polyarthratrigla)在各区域中均占优势;围网植物组合中优势种还包括前节晶囊轮虫(Asplachnapriodonta)和腹尾轮虫(Gastropussp.),而等刺异尾轮虫(Trichocercasimilis)仅在P1区占优势种;围隔植物组合中优势种还包括角突臂尾轮虫(Brachionusangularis),而奇异六腕轮虫(Hexarthramira)仅在E2区占优势种;对照区域优势种还包括曲腿龟甲轮虫(KeratelIavalga)和等刺异尾轮虫。
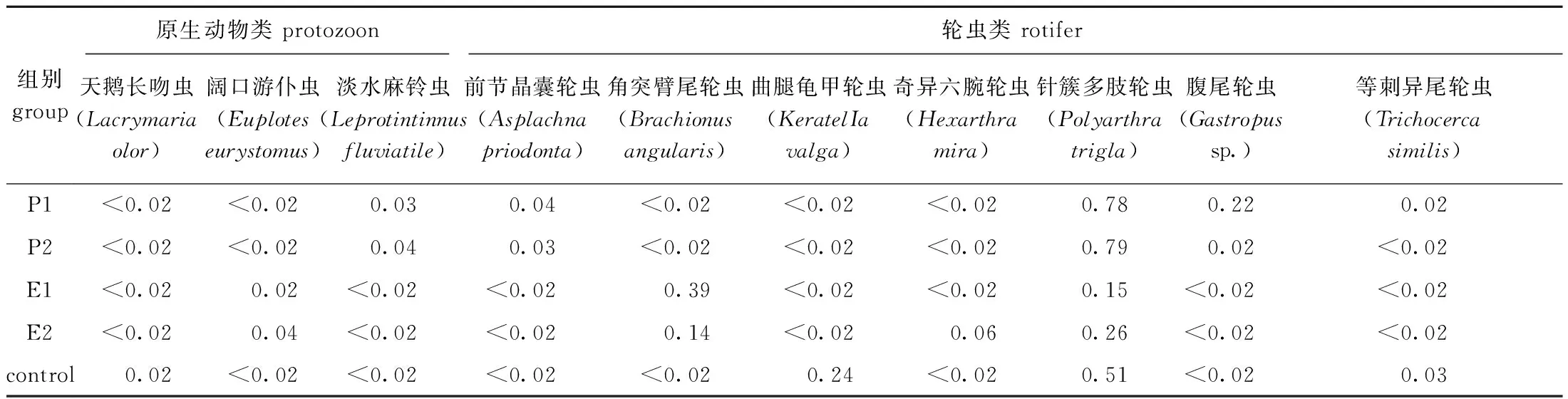
表3 修复区与对照区浮游动物优势种的比较Tab.3 Comparison of the dominant zooplankton species between the control area and treatment area
2.4 浮游动物的生物量和丰度
从图3可见,围网与围隔修复区内浮游动物的相对丰度具有不同的特征,修复区内原生动物、轮虫、枝角类和桡足类分别占浮游动物总生物量的0.54%、95.54%、1.56%、2.36%,分别占总丰度的32.82%、65.85%、0.28%、1.06%;围隔修复区中浮游动物平均生物量及丰度分别为5.84 mg/L和982.86 ind./L,对照组浮游动物平均生物量及丰度分别为9.29 mg/L和1079.32 ind./L,围隔修复区生物量及丰度分别较对照组降低了37.14%、8.94%,围隔修复区中原生动物、轮虫、枝角类、桡足类分别占浮游动物丰度的40.52%、58.39%、0.05%、1.05%;围网修复区植物组合1(P1)的浮游动物生物量及丰度分别较对照组提高了30.06%、37.46%,且显著高于对照区(P<0.05),轮虫丰度和生物量占绝对优势。 浮游动物丰度及生物量结果证明了植物组合1浮床对浮游动物修复效果优于植物组合2浮床,且对应所在区域内的水质也较好,二者的结果具有一致性。


图3 修复区与对照区浮游动物的生物量和丰度Fig.3 Biomass and density of zooplankton in the control area and treatment area
2.5 浮游动物群落的生物多样性指数
修复区和未修复区浮游动物的Shannon-Wiener多样性指数(H′)和Margalef种类丰富度指数(D)分析显示(表4),围网植物组合P1区浮游动物群落的H′和D值均显著高于对照组(P<0.05),结合浮游动物生物量及丰度,二者的结果具有较好的一致性;而围隔植物组合多样性指数较对照组显著降低(P<0.05)。

表4 浮游动物群落的生物多样性指数Tab.4 Biodiversity index of zooplankton community
2.6 浮游动物生物量与环境因子的关系
对示范区浮游动物平均生物量与水质指标进行DCA分析,结果排序轴长度0.607 1<3,可使用线性模型进行冗余(RDA)分析,选择WT、SD、Tur、DO、pH、TN、TP、Chl-a和CODMn共计9个环境因子。RDA分析结果显示,第一排序轴的解释比率为44.10%,包含的物种与环境因子的相关系数为0.115 4,第二排序轴的解释比率为19.49%,包含的物种与环境因子的相关系数为0.089 5,前两个排序轴累计解释了65.59%的物种与环境因子间的关系(表5)。

表5 浮游动物RDA分析特征值及解释比率Tab.5 Eigenvalue and interpretation rate on summary statistics of RDA of zooplankton
浮游动物生物量与环境因子的相关系数如表6所示,对不同修复区域内浮游动物有重要作用的环境因子包括Tur、Chl-a、CODMn和pH。从RDA排序中呈现的空间异质性可以看出,对照区集中在第二、三象限,与TN、TP等营养盐指标呈正相关;P1、P2、E1和E2集中在第一、四象限,与营养盐指标呈负相关(图4)。结果表明,随着生态浮床的置入,水体环境得到了改善,浮游动物的群落结构也逐渐恢复。Pearson相关性分析显示,浮游植物生物量与枝角类、桡足类、轮虫和原生动物生物量呈负相关,但不显著(P>0.05),而枝角类与桡足类呈极显著正相关(P<0.01)(图5)。

表6 浮游动物生物量与环境因子的相关系数(r)Tab.6 Correlation coefficient(r) between zooplankton biomass and environmental factors

图4 浮游动物生物量与环境因子的RDA分析Fig.4 Redundancy analysis of zooplankton biomass and environmental factors

**表示极显著相关(P<0.01)。 ** mean very significant correlations (P<0.01).图5 Pearson相关性分析热图Fig.5 Heat map of Pearson correlation analysis
3 讨论
3.1 不同生态浮床植物组合对水质修复效果的影响
以往对生态浮床修复效果的研究大多集中在对河道、池塘水的净化中。李文芬等[6]研究表明,美人蕉对TN、TP和CODMn的综合去除率明显高于其他植物。郭岩岩等[17]证实水芹、慈姑、美人蕉和水葫芦组合具有良好的修复效果。蒋跃等[18]表明,美人蕉可以作为治理富营养化湖泊生态浮床系统的构建植物,且美人蕉和再力花(Thaliadealbata)混合种植模式优于单一种植。苏媛等[19]对关中地区涝池浮床植物研究发现,美人蕉与菖蒲组合对污染水体去除率较高。本研究表明,采用美人蕉+菖蒲+芦苇(植物组合1)和美人蕉+水芹+慈姑(植物组合2)两种植物组合的生态浮床对水质有明显的改善,修复区内营养盐均具有较高去除率,且植物组合1对TN、TP、Chl-a和CODMn营养盐的去除效果优于植物组合2。修复区的浮游动物多样性指数和丰富度指数及水质指标检测结果,均验证了不同植物组合的生态浮床在富营养化湖泊中的可行性及有效性,其中,生态浮床植物组合1(美人蕉+菖蒲+芦苇)具有明显优势,在未来开展生态浮床修复富营养化湖泊的工作中可使用该植物组合作为浮床植株的选择参考。
3.2 不同生态浮床对浮游动物群落多样性的影响
本研究中,共鉴定出轮虫12属20种,原生动物类9属12种,枝角类5属7种,桡足类2属5种,浮游动物群落以轮虫为主。大型浮游动物(枝角类、桡足类)的丰度随小型浮游动物(原生动物和轮虫)优势度的增加而降低,这是由于围隔植物组合属于封闭环境,鱼类可能通过选择性捕食,使枝角类、桡足类生物量及丰度下降[20]。修复区置入生态浮床后,水质状况有所好转,且浮床植物长势良好,生物量增加,浮游动物的种类和数量均得到了增加,尤其是围网植物组合1修复区浮游动物群落的Shannon-Wiener多样性指数和Margalef丰富度指数均显著高于对照区,浮游动物种类趋于丰富,群落结构得到一定程度的恢复,说明生态浮床的置入对浮游动物增殖发挥了积极效果。
浮游动物群落结构变化与水体营养盐及浮游植物优势种具有相关性。本研究中,与对照区相比,修复区内浮游动物总种类数由23种增加到39种,其中,根据原生动物及轮虫水体营养指示种类表[21],原生动物优势种阔口游仆虫属于β中污性水体指示种,7种轮虫优势种中,前节晶囊轮虫、曲腿龟甲轮虫和等刺异尾轮虫属于寡污-β中污,而针簇多肢轮虫属于中污,角突臂尾轮虫属于β-α中污。优势种分布结果显示,前节晶囊轮虫和等刺异尾轮虫均在围网植物组合中为优势种,前节晶囊轮虫属于杂食性轮虫,其可通过改变食性应对食物竞争压力[22],从而使其种群得以增长,成为轮虫优势种。等刺异尾轮虫为围网植物组合1优势种,说明该水体环境较清洁。水体扰动、流速和流量等水动力因子对水体富营养化具有重要影响[23],由于围隔植物组合属于密闭环境,无水体流动,因而导致其营养物质达到一定积累,从而出现β中污性指示种角突臂尾轮虫和阔口游仆虫。
3.3 浮游动物群落的影响因子
浮游动物的分布与非生物因子密切相关,不同浮游动物优势种水平分布受到环境因子的影响也有所不同[24-25]。本研究中RDA分析表明,Tur、CODMn和pH是主要非生物影响因子,其中,浮游动物生物量与pH呈极显著相关。与此类似,吴利等[26]也指出,pH是影响西凉湖浮游动物群落结构改变的较强环境因子。水体pH对浮游动物具有重要影响,不同种类的轮虫,其适宜生长的pH不同,许多枝角类对较高或较低pH均非常敏感[27]。本研究中,浮游动物丰度和生物量也随pH的升高而相应增加,RDA分析也表明,第一排序轴与pH的正相关性最大。CODMn的大小通常作为评判水体营养水平的标准之一。本研究中,与修复区相比,对照区CODMn较高,加上蓝藻暴发等的综合作用,导致浮游甲壳动物丰度较高,这与对鄱阳湖研究结果一致[24]。围网与围隔设施的置入,导致围隔区与围网区水体浊度较对照区显著降低。浊度的改变有利于水中浮游动物的繁殖和发育,并为浮游动物提供了更加适宜的生存环境[28]。
浮游植物是浮游动物的重要食物来源之一,水体中浮游植物生物量的高低与轮虫的生长繁殖密切相关[29]。本研究中,浮游植物与枝角类、桡足类、轮虫和原生动物呈负相关关系,也验证了其间存在捕食关系。近年来监测数据显示,夏季蓝藻频繁暴发导致太湖叶绿素a的浓度显著增加,尤其是蓝藻含量的增加,使得枝角类、桡足类浮游动物的生长受到抑制,从而有利于小型浮游动物的生长[30]。同时,蓝藻产生的藻毒素具有较强的毒害作用,使浮游动物向小型化演化[20]。本研究结果显示,轮虫占绝对优势,这是由于体型小、繁殖快和适用性强等特点决定了轮虫在湖泊生态系统中最常见且属于优势种,且轮虫对浮游动物丰度的贡献最大,本研究结果与杨佳等[20]的研究结果一致。
4 结论
1)通过置入不同植物组合生态浮床修复措施,改变了围隔和围网修复区内浮游动物的物种组成及群落结构,对浮游动物的优势种产生了较大的影响,使得对照组与修复区域内的浮游动物群落结构产生差异,其中围网修复区内植物组合 1 (美人蕉+菖蒲+芦苇)具有良好的修复效果,表现出较强的浮游动物群落结构恢复能力。
2)生态浮床置入后修复区内各项水质指标均优于对照组,水质净化效果显著。 Pearson相关性分析和RDA分析研究结果一致,不仅非生物因子Tur、CODMn和pH影响浮游动物的分布,生物因子叶绿素a也是影响浮游动物群落分布的因子。
3)不同植物组合生态浮床在富营养化湖泊中具有可行性及有效性,未来可应用于富营养化湖泊生态浮床原位修复中,后续将持续深入开展富营养化湖泊浮游动物群落对生态浮床修复措施的响应机制,探索生态浮床修复生境内的生物与非生物间的耦合效应。

