薄荷醇修饰槲皮素脂质体的处方优选及体外靶向性考察
刘婉滢,蔡佳雨,刘 洋,司佳奇,李沣芮,孔 亮,2,李学涛*
(1.辽宁中医药大学 药学院,辽宁 大连 116600;2.辽宁中医药大学 中医脏象理论及应用教育部重点实验室,辽宁 沈阳 110847)
全球阿尔茨海默病(Alzheimer’s Disease,AD)患病人数逐年递增,给各地卫生系统带来前所未有的压力[1-2]。衰老导致的脑内神经元炎症、氧化应激是导致AD 发病的重要因素,而血脑屏障是导致AD 治疗进展相对有限的因素之一[3-4]。
近些年随着传统中医药的发展,多靶点、多通路的中药及其单体成分越来越多的应用于疾病的治疗中[5]。槲皮素(Quercetin,QU)具有很强的抗氧化与抗炎作用,可以保护神经元免受氧化损伤与炎症侵害,但因其水溶性较差,限制了其在体内的应用[6]。薄荷醇(Menthol,Men)为薄荷的提取物,是一种强有力的血脑屏障渗透剂[7]。
脂质体作为一种比较理想的药物载体,具有较好的生物相容性,再加以特定的靶头进行修饰,就可以靶向特定部位、提高药物的使用效率[8]。因此,本研究制备了薄荷醇修饰槲皮素脂质体(Men-Qu-Lip),靶向血脑屏障、增加药物入脑量。通过Box-Behnken响应面法选取Men-Qu-Lip 优化处方,并考察优化处方中不同浓度脂质体对细胞活力的影响,且使用bEnd.3 细胞考察Men 的靶向能力,为后续的研究提供实验基础。
1 材料
1.1 药品与试剂
槲皮素(批号:21122007,纯度:98.96%,成都普菲德生物技术有限公司);DSPE-PEG2000-薄荷醇(批号:RF0222837,西安瑞禧生物科技有限公司);胆固醇(Chol,批号:N1018A,大连美伦生物科技有限公司);卵磷脂(批号:120025,日本NOF 公司);DMEM(批号:20210619,北京索莱宝科技有限公司);香豆素(美国Sigma-Aldrich 公司);DAPI 染色液(北京碧云天科技有限公司);水为纯净水,其它试剂均为分析纯。
1.2 仪器
Agress1100 型高效液相色谱仪(大连依利特分析仪器有限公司);JY92-IIN 型超声波细胞粉碎机(宁波新芝生物科技股份有限公司);FA1104 型电子天平(上海越平科学仪器有限公司);FACSCalibur 型流式细胞仪(美国BD 公司);RE52CS 型旋转蒸发仪、B-220 型恒温水浴锅(上海亚荣生化仪器厂);TiS 型荧光倒置显微镜(日本尼康公司);WJ80B-Ⅱ 型CO2细胞培养箱(上海新苗医疗器械制造有限公司)。
1.3 细胞
小鼠脑微血管内皮细胞(bEnd.3)购于赛百慷(上海)生物技术股份有限公司。
2 方法与结果
2.1 脂质体的制备
采用薄膜分散法,分别称取DSPE-PEG2000-Men、卵磷脂、胆固醇和槲皮素于圆底烧瓶中,加入5 mL甲醇待其混合均匀后旋转蒸发除去甲醇。精密吸取5 mL 的PBS,超声5 min 使药物充分溶解,然后将混悬液移至10 mL EP 管中,探头超声10 min 后,即可得到Men-Qu-Lip。除不加槲皮素外,其余操作步骤同上,制备Men-Lip。除不加薄荷醇外,其余操作步骤同上,制备Qu-Lip。
2.2 槲皮素含量测定方法的建立
2.2.1 色谱条件 色谱柱为UltimateXB-C18柱(4.6 mm×250 mm,5 μm);流速为1 mL/min;流动相为甲醇-0.05%磷酸(65 ∶35);检测波长为360 nm;柱温为25 ℃;进样量为20 μL。
2.2.2 溶液的制备 对照品溶液:取槲皮素 1 mg,用10 mL 的甲醇进行定容,得到浓度为0.1 mg/mL 的槲皮素母液。以甲醇为溶剂,将母液稀释制得浓度为100、50、20、10、5、1、0.5 μg/mL 的系列槲皮素对照品溶液。
供试品溶液:精密吸取Men-Qu-Lip 1 mL,加甲醇9 mL 破乳,再稀释5 倍,后经0.22 μm 微孔滤膜滤过,取续滤液,即得。
空白溶液:取Men-Lip 1 mL,加甲醇9 mL 破乳,再稀释5 倍,后经0.22 μm 微孔滤膜滤过,取续滤液,即得。
2.2.3 标准曲线的建立 将“2.2.2”项下对照品溶液,按“2.2.1”项下色谱条件进行分析。以Qu 浓度(X,μg/mL)为横坐标,对应峰面积(Y)为纵坐标进行标准曲线的绘制,最后得到Qu 的回归方程为Y= 69.662X+ 4.145 2(R2= 0.999 9)。结果表明槲皮素在0.5 ~ 100 μg/mL 浓度范围内与峰面积成良好的线性关系。
2.2.4 专属性试验 取适量的供试品溶液,对照品溶液(20 μg/mL),空白溶液,按“2.2.1”项下色谱条件进行测定,色谱图见图1。结果显示槲皮素在6.3 ~6.4 min 左右出峰,空白溶液则在6.3 ~6.4 min处并无峰出现,表明该方法专属性良好。
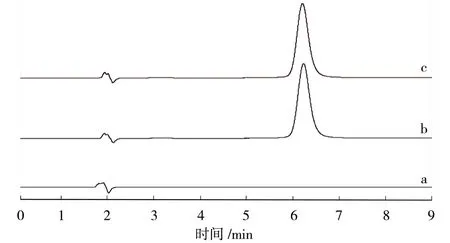
图1 槲皮素含量测定HPLC 图Fig.1 HPLC diagram of quercetin content determination
2.2.5 重复性试验 取Men-Qu-Lip,按照“2.2.2”项下方法制备供试品溶液6 份,按“2.2.1”项下色谱条件进行测定,将得到的峰面积带入回归方程,结果槲皮素峰面积的RSD 为0.13%(n= 6),表明该方法重复性良好。
2.2.6 精密度试验 取对照品溶液(20 μg/mL)适量,按“2.2.1”项下色谱条件进样6 次,将得到的峰面积带入回归方程,结果槲皮素峰面积RSD 为0.13%(n= 6),表明仪器精密度良好。
2.2.7 稳定性试验 取“2.2.2”项下供试品溶液,放置于室温下,分别于0、2、4、8、12、24 h,按“2.2.1”项下色谱条件进行测定,结果槲皮素的RSD = 0.21%(n= 6),表明该脂质体在24 h内具有良好的稳定性。
2.2.8 加样回收率试验 按“2.2.2”项下方法制备供试品溶液6份,与相应的对照品溶液按1∶1 (m/m)的比例混匀,再按“2.2.1”项下色谱条件进样分析,得到相应峰面积,带入回归方程计算其加样回收率。测得槲皮素的平均加样回收率为102.32%,RSD 为0.68%(n= 6),表明本方法准确度较好。
2.3 处方工艺优选
根据文献[9]可知对Men-Qu-Lip 影响较大的三个因素包括:胆固醇用量(A)、槲皮素用量(B)、水化温度(C),因此用以上三种因素作为Men-Qu-Lip 的包封率考察因素,固定处方量5 mL,磷脂量为110 mg。以槲皮素包封率(Y)作为考察指标,采用Box-Behnken 响应面法优选出Men-Qu-Lip 的最优处方工艺。各因素水平编码见表1,Box-Behnken 试验设计方案与结果见表2,方差分析结果见表3。

表1 各因素水平编码Tab.1 Factors and levels
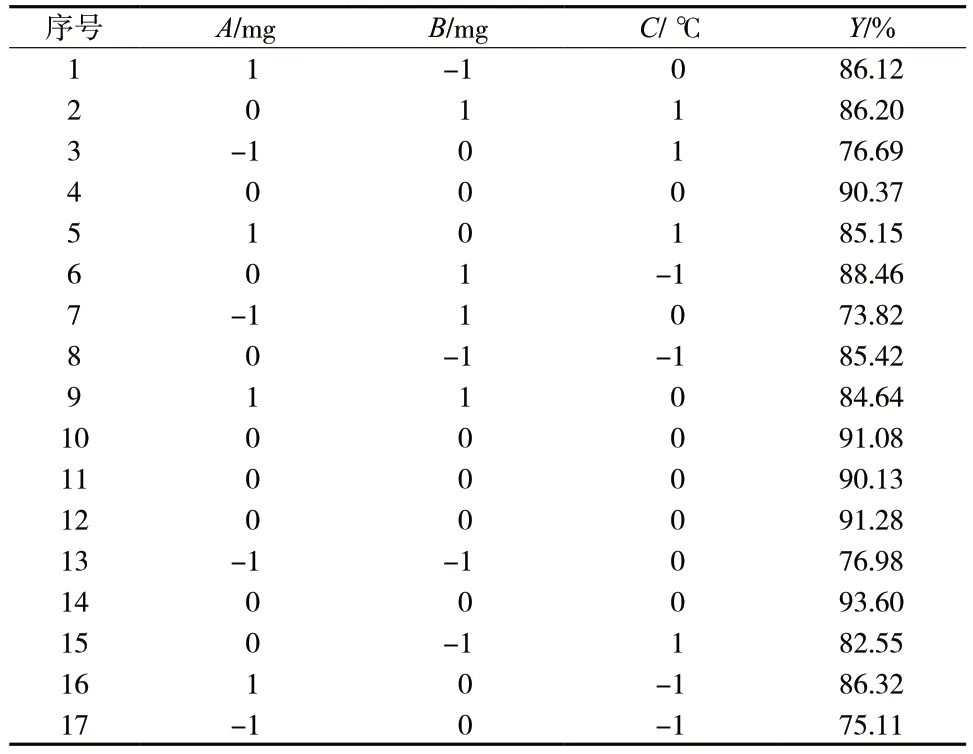
表2 Box-Behnken 试验设计方案与结果Tab.2 Design and results of Box-Behnken
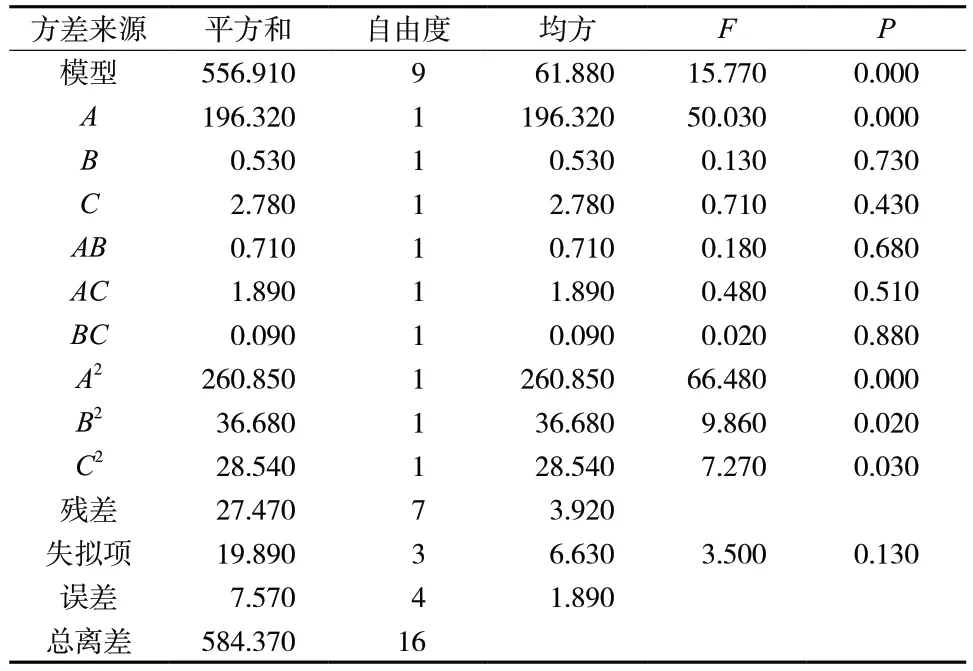
表3 方差分析结果Tab.3 Analysis result of variance
结合Design-ExpertV8.0.6.1 软件,将表2 中所得到的包封率与影响因素进行二次多项式的拟合,得到拟合方程为Y= 91.29 + 4.95A+ 0.26B- 0.59C+0.42AB- 0.69AC+ 0.15BC- 7.87A2- 3.03B2- 2.6C2(r=0.952 9,P<0.05)说明该拟合方程模型能够较好的反映出Y值的变化,可以用于筛选Men-Qu-Lip 的最优处方。对该拟合模型进行方差分析,发现因素A、A2、B2、C2对Y值有显著影响(P<0.05),因素B、C、AB、AC、BC对Y值没有显著影响(P>0.05),见表3。接着使用Design-ExpertV8.0.6.1 软件绘制三维响应面图以及等高线图,见图2。
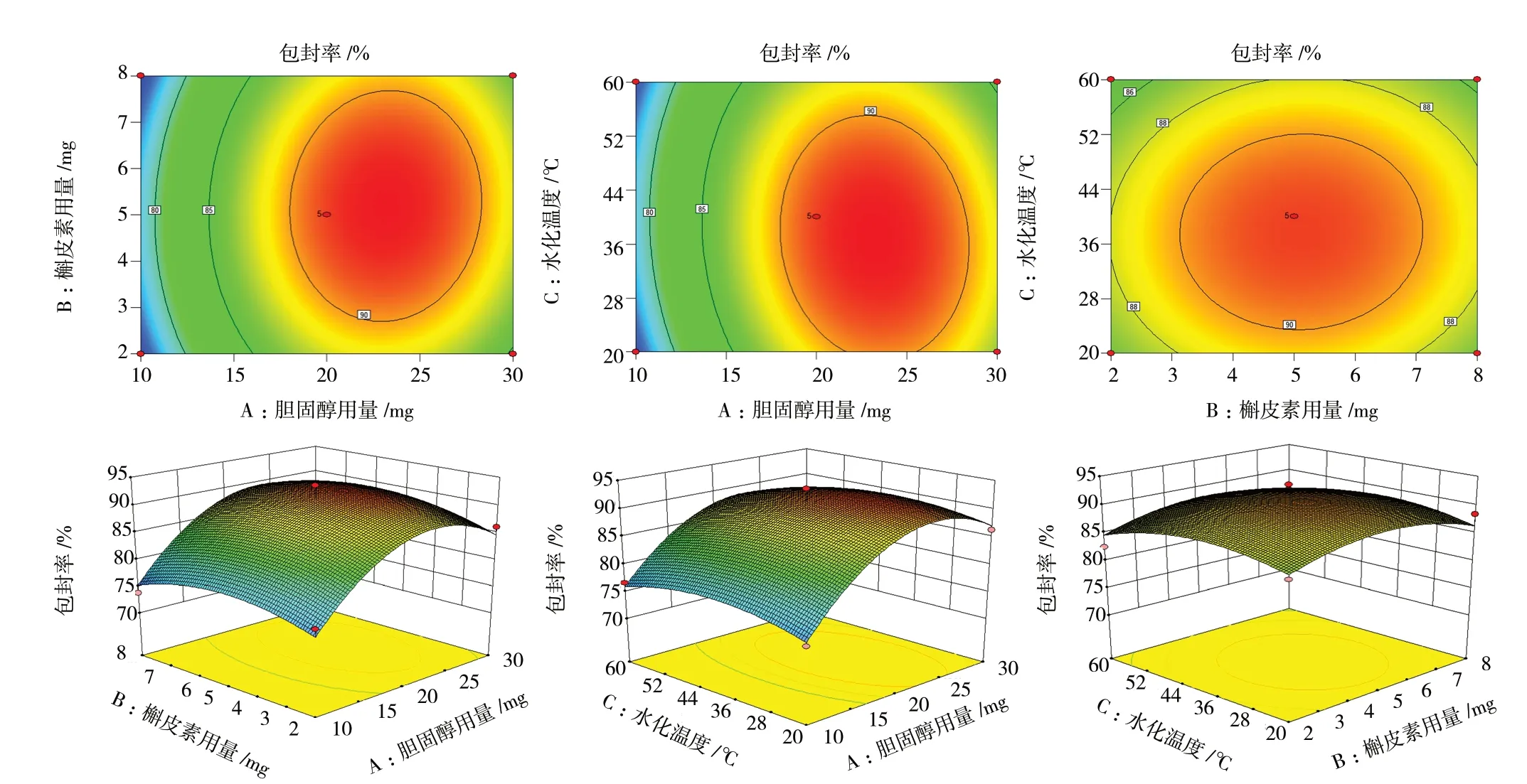
图2 各因素对包封率影响的响应面和等高线图Fig.2 Response surface and contour plot of the influence of each factor on encapsulation efficiency
图2 中曲线越陡,证明因素之间的交互作用对包封率(Y)影响越大。A与B、A与C交互作用的响应面形状较陡,而B与C的响应面形状较为平缓。等高线图中A与B、A与C交互作用要强于B与C的交互作用。结合以往经验,确定脂质体的优化处方为磷脂110 mg、胆固醇30 mg、槲皮素5 mg、水化温度为40 ℃、处方量为5 mL。
2.4 验证实验
根据优化处方,平行制备3 批Men-Qu-Lip,测定其包封率,结果见表4。最终测得槲皮素的平均包封率为(91.20±0.53)%,表明本实验所选取的优化处方稳定、可行。
表4 验证试验(%,n = 3)Tab.4 Validation experiment(%,n = 3)
2.5 体外细胞存活率考察
2.5.1 bEnd.3 细胞的培养 bEnd.3 细胞使用含10%胎牛血清,1%双抗和1%内皮生长因子的培养液,置于培养箱(37℃,5%CO2)。待细胞生长到95%以上,弃去培养液,用适量的PBS 清洗,再用胰蛋白酶进行消化,然后加培养液终止消化,离心,去上清液,加适量新培养液复悬,继续传代培养。
2.5.2 细胞活力检验 采用黄酰罗丹明B(SRB)染色法进行细胞活力考察。bEnd.3 细胞按1×105个每孔的密度接种于96 孔板中,置于37℃、5%CO2培养箱中孵育24 h。设置不同给药组,然后按优化处方的最大量,设置一系列的浓度梯度,分别为0.012、0.021、0.043、0.085、0.170、0.330 mmol/L,每组设置5 个复孔。加药后再孵育48 h,弃去培养液,用10%三氯乙酸溶液固定,加入0.4% SRB 溶液染色30 min,再加入200 μL 的Tris 碱溶液,振荡1 h,溶解SRB 溶液,用酶标仪在540 nm 波长下测定各孔的OD值,并计算细胞存活率。最后使用Graphpadprism-8.0.2 软件进行折线图绘制与单因素方差分析,使用荧光显微镜观察0.330 mmol/L 浓度下不同组别脂质体对bEnd.3 细胞形态的影响。
可以观察到该浓度下各组别的bEnd.3 细胞形态与空白脂质体组相比均无显著变化,见图3A。Men-Qu-Lip 组,Qu-Lip 组分别与Men-Lip 组相比差异无统计学意义(P>0.05),说明不同组别的脂质体对bEnd.3 细胞的细胞活力无显著影响,见图3B。以上结果均说明,在0.012 ~ 0.330 mmol/L 浓度范围内的Men-Qu-Lip 安全性较高,细胞活力较好。

图3 不同脂质体组细胞形态图及各浓度梯度下的细胞存活率Fig.3 Cell morphology of different liposome groups and cell survival rate under different concentration gradients
2.6 体外摄取能力的初步评价
2.6.1 细胞培养 选取bEnd.3 细胞作为脂质体摄取能力考察的细胞,其培养方式与“2.5.1”项下方式相同。
2.6.2 荧光显微镜观察脂质体的摄取情况 以香豆素(Coumarin,Cou)代替槲皮素作为荧光探针,来考察细胞对脂质体的摄取能力。采用48 孔板接种bEnd.3 细胞,接种密度为5×104个/孔。设置3 个给药组。待细胞在48 孔板中培养24 h 后,分别给予Men-Lip、Cou-Lip 和Men-Cou-Lip。孵 育2 h 后,加入DAPI 染液染色,采用荧光显微镜查看各组细胞荧光强度,可观察到Men-Cou-Lip 组的荧光要强于Cou-Lip 组的荧光,见图4A 。使用Image J 软件对图4A进行摄取量统计分析,摄取量= IntDen-Area*Mean,再使用Graphpad-prism-8.0.2 软件对Cou-Lip 组摄取量与Men-Cou-Lip 组摄取量进行方差分析,发现Men-Cou-Lip 摄取强度明显强于Cou-Lip(P<0.05),见图4B。
图4 不同脂质体中香豆素荧光强度及摄取量统计结果(n = 3)Fig.4 Results of coumarin fluorescence intensity and uptake statistics in different liposomes (n = 3)
2.6.3 流式细胞仪测定脂质体的摄取情况 采用6 孔板接种bEnd.3 细胞(5×106个/孔),同样设置3 个给药组,同“2.6.2”分组情况(n= 3)。待细胞在6 孔板中培养24 h 后,分别给予不同给药组,后用胰酶进行消化,再加入1 mL 培养液终止消化,以1 000 r/min 离心后弃去上清液,加入300 μL 的PBS,氮气吹匀,过膜进行流式分析。
各组脂质体的FCS Express V3 流式摄取曲线,见图5A,使用FlowJo 进行摄取量统计,再使用Graphpad-prism-8.0.2 软件对Cou-Lip 组摄取量与Men-Cou-Lip 组摄取量进行方差分析,发现Men-Cou-Lip摄取强度明显强于Cou-Lip(P<0.05),见图5B。以上结果均说明,经Men 修饰的脂质体能够增加bEnd.3 细胞对药物的摄取能力,使得脂质体的靶向性增强。
图5 不同脂质体中流式摄取曲线及摄取量统计结果 (n = 3)Fig.5 Flow uptake curves and statistical results of uptake in different liposomes (n = 3)
3 讨论
AD 被认为是一种发病机制较为复杂的神经退行性疾病,年龄增长、遗传因素、头部受伤、血管疾病、感染和环境因素都可能成为AD 的致病因素[10]。Aβ斑块是AD 典型的病理特征,其中ROS 的生成可以导致氧化应激使Aβ 聚集而导致神经损伤,在衰老和患病的大脑中炎症因子的增加同样会导致Aβ 斑块周围的小胶质细胞活化,从而导致神经变性[11-12]。
槲皮素是一种拥有抗氧化与抗炎作用的中药单体成分,可通过上调谷胱甘肽过氧化物酶,调节Nrf2等相关因子与通路,减少环加氧酶和脂氧合酶的表达来发挥抗氧化及抗炎作用[13]。将其制备成脂质体可改善其水溶性差、易降解等缺点,提高溶解度和相关组织分布。普通脂质体进入体循环后会因血液中蛋白、酶等作用下发生破裂而引起的药物渗漏,本研究选用DSPE-PEG2000 作为长链与其它膜材一起溶于有机溶剂中用于长循环脂质体的制备,可增加脂质体的稳定性、减少药物渗漏、延长体内循环时间[14]。
Box-Behnken 响应面法是一种非线性模型拟合的响应面设计法,可通过数据拟合将各因素之间的交互作用变为直观的等高线与三维立体图,减少测试次数[15]。因此本实验选择Box-Behnken 响应面法进行Men-Qu-Lip 的处方优化,选取胆固醇用量、槲皮素、水化温度这三个因素进行数据拟合,确定最优处方为磷脂110 mg、胆固醇30 mg、槲皮素用量5 mg、水化温度40 ℃、处方量5 mL。最终测得平均包封率为(91.20±0.53)%(n= 3),结果符合2020 年版《中国药典》的相关要求[16],证明本方法的科学性。
细胞活力检测结果显示,Men-Qu-Lip 组与Men-Lip组相比差异无统计学意义(P>0.05),因此证明按优化处方所制备的Men-Qu-Lip 在0.012 ~ 0.330 mmol/L范围内,对细胞的存活率没有影响。考察不同脂质体被bEnd.3 的摄取情况,因槲皮素本身无荧光作用,因此课题组选用香豆素来作为荧光探针。结果表明,与Cou-Lip 组相比,Men-Cou-Lip 组摄取能力明显增加(P<0.05),可以增强药物在大脑中的分布,提高靶向性。流式细胞仪摄取结果与荧光显微镜摄取结果趋势一致。
4 结论
本研究成功制备并优选出Men-Qu-Lip 处方,优选的处方对bEnd.3 细胞无毒副作用。还明确了经Men 修饰的脂质体能够顺利跨过血脑屏障,为后续其在AD 的研究与应用提供了相应的基础。但后期仍要进行更为深入的体内和体外研究来对本实验的结论进行验证。

