原发性中枢神经系统非霍奇金淋巴瘤1例
张延鹏,赵东贤,张健,蒋灿灿,周淑萍
(1. 淮南联合大学医学院康复教研室,安徽淮南 232038;2. 中国医科大学第七临床学院神经外科;3. 安徽理工大学第一附属医院肿瘤内科)
患者,男,69岁,以“左侧视力下降半年、言语不清和右侧肢体肌力进行性下降半个月”为主诉于2020 年3 月11 日入院治疗。患者既往无高血压病史。入院体格检查:神志清楚,言语笨拙,右侧肢体肌力0 级,肌张力增强,左侧肢体肌力4 级,肌张力大致正常,病理反射未引出。患者无发热、抽搐、意识不清。入院时血常规、尿常规和凝血4项正常,胸、腹部CT无异常。2020年3月9日门诊头部MRI平扫+增强示:左额叶皮髓交界区见一椭圆形病灶,呈T1W1 稍低、T2W2 稍高信号,大小约2.7 cm×1.7 cm,静脉注射钆喷替酸葡甲胺(Gd-DTPA)增强后,左额叶病灶不均匀强化,考虑脑转移瘤;相邻脑质并见大片状指样长T1长T2信号影,左侧脑室受压变形,中线结构右偏,见图1。初步诊断:左额叶转移瘤。完善相关检查后于2020年3月14日行左额顶开颅肿瘤切除术。患者取右侧卧位,全麻成功后,常规消毒铺巾,左额顶入路,切口位于中线外侧,皮肌瓣翻向前。于额顶骨钻取2孔,用铣刀铣下骨瓣,电凝止血,探查发现硬膜张力高,圆针细线悬吊硬膜后呈弧形剪开,长约5 cm,在靠近中线处沿脑沟逐层电凝,进入额叶约1.5 cm处见黄色水肿带,沿水肿带分离肿瘤,内侧肿瘤呈淡红色,与周边脑组织界限不清,肿瘤无包膜,有水肿带,沿水肿带切除肿瘤,肿瘤大小约3.0 cm×3.0 cm×3.5 cm,质软。瘤床电凝止血,冲洗无出血,加用止血纱布,颅内压下降、波动良好,用人工硬膜修补缝合硬膜,骨瓣复位,用4组连接片固定,皮下置1 枚引流管,分层缝合头皮。术后病理回报:非霍奇金淋巴瘤,见图2。经院外会诊(2020年3月25日)后证实为非霍奇金弥漫性大B细胞淋巴瘤,非生发中心细胞来源;免疫组化提示:CD20(+),Bcl-2(+),Bcl-6(-),Kit-67(+),MPO(-)。术后半个月(2020 年3 月29 日)常规复查头部CT示:左额叶见一椭圆形低密度影,大小约为4.6 cm×2.3 cm,边界欠清,相邻脑质并见大片低密度影,考虑肿瘤复发,见图3。患者于2020年4月7日出院。患者出院后前往放疗科进行进一步治疗,于2020 年4 月9 日、4 月16 日、4 月22 日、4 月28 日、5 月6 日和5 月14 日进行阶段性全脑放射性治疗,全脑照射放射剂量为40 Gy,共20 次,4 个周期。阶段性放疗前期,术后1 个月(2020年4月17日)头颅MRI示:左额叶皮髓交界区见一椭圆形病灶,呈T1W1 稍低、T2W2 稍高信号,大小约4.0 cm×2.8 cm,周边水肿带较前缩小,肿瘤大小较上次复查有所缩小,见图4A。阶段性放射治疗末期,术后2 个月(2020 年5 月26 日),头颅MRI示:肿瘤占位范围较前无明显变化,见图4B。术后4 个月(2020 年7 月6 日),头颅CT 示:左额叶椭圆形占位,大小约3.0 cm×2.4 cm,水肿带较前明显缩小,见图5A。术后6个月(2020年9月13 日),头颅CT 示:左额叶椭圆形占位,大小约3.0 cm×2.4 cm,水肿带较前缩小,见图5B。术后8个月(2020 年11 月11 日),头颅MRI 示水肿带较前缩小,见图6A;术后12 个月(2021 年3 月31日)、16 个月(2021 年8 月25 日)头部CT 示:肿瘤水肿带缩小,见图6B、6C。患者治疗期间视力有所好转,右侧肢体肌力恢复至3 级,肌张力减弱,但在治疗期间和随访过程中患者多次出现癫痫发作,均予以丙戊酸钠对症治疗。患者近期失访。
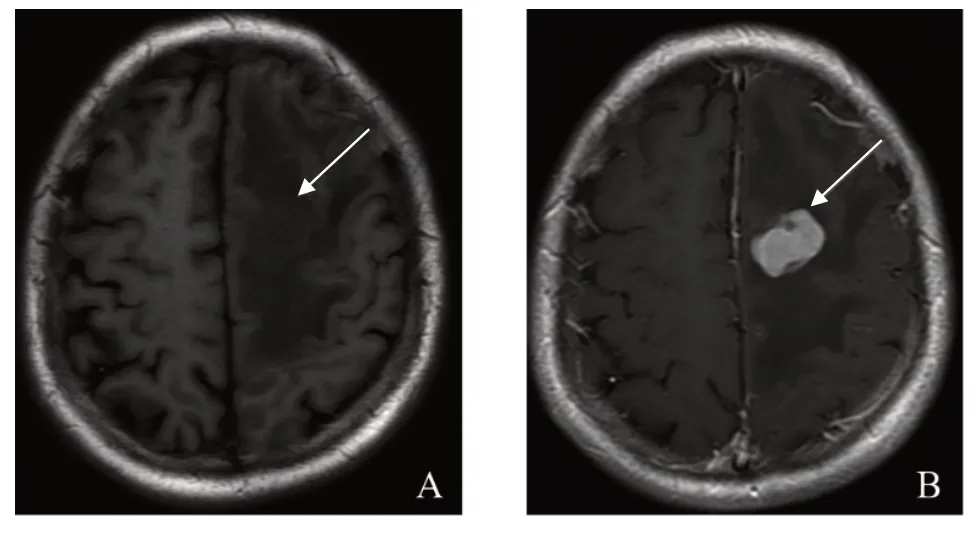
图1 1例69岁非霍奇金淋巴瘤男性患者术前头部MRI

图2 1例69岁非霍奇金淋巴瘤男性患者病理组织学结果(HE染色×200)
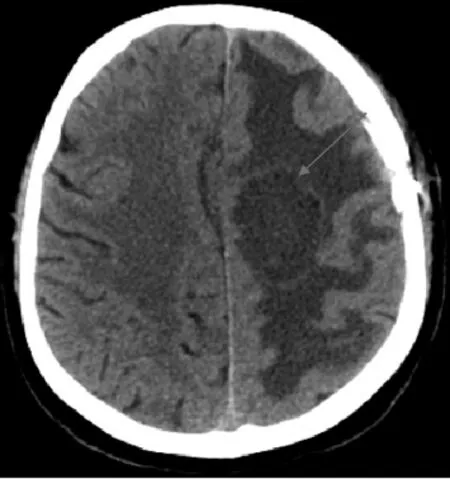
图3 1例69岁非霍奇金淋巴瘤男性患者术后半个月头部CT

图4 1例69岁非霍奇金淋巴瘤男性患者术后1、2个月头部MRI

图5 1例69岁非霍奇金淋巴瘤男性患者术后4、6个月头部CT
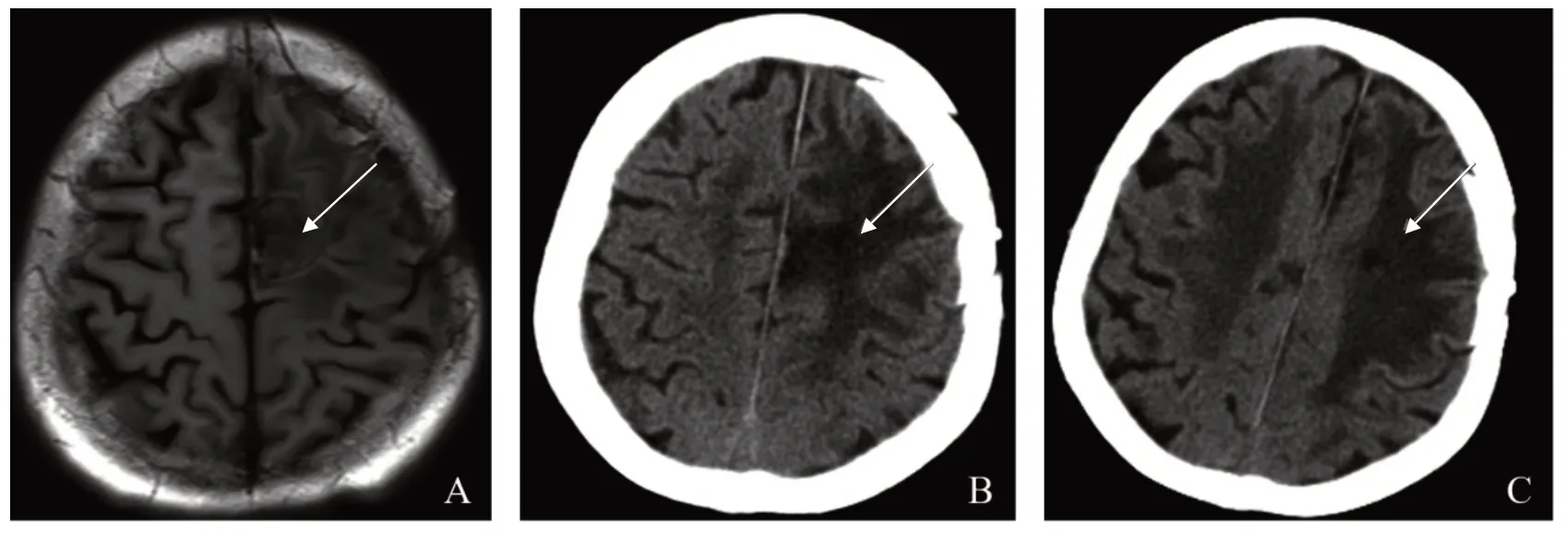
图6 1例69岁非霍奇金淋巴瘤男性患者术后8个月头部MRI和术后12、16个月CT
讨论原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)是一种罕见的侵袭性结外非霍奇金淋巴瘤,主要局限在脑实质、眼部、脊髓和软脑膜中。PCNSL 约占所有非霍奇金淋巴瘤的3%,约占所有中枢神经系统原发性肿瘤的2%[1]。约95%的PCNSL 是弥漫性大B 细胞淋巴瘤,与其他结外弥漫性大B 细胞淋巴瘤相比,PCNSL 的预后更差,死亡率更高。PCNSL 好发于中老年人群,发病中位年龄为65岁,在老年人群的总体发病率逐渐增加,且预后极差,其5 年、10 年生存率分别为29.9% 和22.2%[2-3]。过去发现PCNSL 通常合并免疫缺陷疾病,但近年来的报道表明PCNSL 在无免疫缺陷的人群中发病率也逐渐增加,且难以与脑转移瘤区分。本研究报道了1例以双眼视力减退为主要临床表现的老年病例,其影像学资料误诊为脑转移瘤,分析了该病例临床表现、诊断方法和治疗手段,并与相关疾病进行了鉴别讨论。
PCNSL 是一种局限于中枢神经系统的高度侵袭性的非霍奇金淋巴瘤。与其他脑肿瘤不同,PCNSL 通常对放疗和化疗都有良好的反应,但与中枢神经系统之外的淋巴瘤相比,生存率通常较差,除此之外,PCNSL 误诊率高达86%。PCNSL病因和发病机制目前尚不明确,免疫缺陷疾病(长期使用免疫抑制剂、人类免疫缺陷病毒/获得性免疫缺陷综合征患者和器官移植受者)、EB 病毒和人类疱疹病毒6型均可能诱导PCNSL 的发生[4]。有研究显示PCNSL 发病的中位年龄为65岁,发病高峰年龄在70~79 岁,这可能提示PCNSL 的发生与免疫低下有关[2-3]。PCNSL可发生在中枢神经系统的任何部位,以幕上和额顶叶多见,眼部和脑脊液较少见,而脊髓受累极少见[5-7]。通常PCNSL的临床症状无明显特异性,常与脑转移瘤、病毒性脑炎和胶质母细胞瘤临床表现类似,但不同部位的肿瘤临床症状有所不同。隐匿性的PCNSL 往往表现为情感淡漠、情绪低落、记忆力减退或性格变化等神经认知障碍[7]。当PCNSL 累及脑实质或软脑膜时,可表现为头痛、意识模糊、恶心呕吐等颅内压升高的症状。相较于脑转移瘤或胶质母细胞瘤,PCNSL 的癫痫发作症状并不常见,这可能是PCNSL 对皮层的侵犯程度较低。当发生脊髓内病变时,可能会出现躯体感觉障碍、膀胱或肠道功能障碍[8]。眼部受累的PCNSL 初次就诊时通常无症状,或者仅表现为葡萄膜炎症状,当病变加重可表现为视力下降和视野缺损,甚至出现侵犯中枢神经系统症状[9]。本例PCNSL 患者以言语不利和肢体肌力进行下降为首发症状,患者无头痛、呕吐等颅内压升高症状。因此对于这一类的老年患者,需要与急性缺血性脑卒中相鉴别。
头颅CT 是鉴别颅内肿瘤和脑卒中的首选检查方法。缺血性脑卒中在CT 常表现为大片低密度影,而PCNSL 表现为实体肿瘤占位和瘤周水肿。与其他颅内占位性疾病相比,PCNSL 的CT 检查无差异。MRI 是PCNSL 诊断的主要影像学方法,PCNSL 的影像学特征与其组织病理学密切相关。实际上,PCNSL 的肿瘤组织富含网状纤维和小的基质成分,并具有高细胞密度、高核/细胞质体积比。因此,PCNSL 在T1WI 上显示等或低信号,在T2WI 上显示等或相对高信号,甚至低信号。MRI 上最具特征的是PCNSL 沿脑室周围区域的线性增强[10],这可能是肿瘤血管在侵袭性生长过程中,肿瘤细胞向心性排列的缘故。除此之外,有研究表明扩散加权成像(DWI)可以准确反映PCNSL 血管生成的水平[11]。然而,MRI 不能作为PCNSL 确诊的方式。无论肿瘤是否发生坏死,MRI 增强扫描在PCNSL 中均表现为均匀强化。PCNSL 中肿瘤的大小与肿瘤占位效应引起的瘤周水肿范围不成比例是此类肿瘤最显著的特征,因此本病难与脑转移瘤区分,一般脑转移瘤的瘤周水肿带广泛且明显,而肿瘤较小;PCNSL 瘤周水肿带窄而小,而肿瘤较大。本例PCNSL 患者瘤体直径较大,但瘤周水肿极为明显,且水肿范围广泛,因此单纯通过影像学检查很难与转移瘤进行区分。由于PCNSL 的一般临床表现无明显特异性,且影像学特征性低,因此本病的误诊率较高。FDG-PET 作为一种新的影像学成像方式,在检测NHL 上表现出较高的敏感性和特异性。更重要的是,FDG-PET 已被证实在区分脑淋巴瘤、高级别胶质瘤和获得性免疫缺陷综合征患者的感染性病变方面具有很高的准确性[12]。PCNSL 通常表现出高FDG 浓度。因此,FDG-PET 可以区分高代谢的PCNSL和低代谢的感染病变[13]。
常规脑脊液检查并不能发现异常,通常PCNSL 脑脊液仅表现为蛋白含量增高,葡萄糖含量正常。当肿瘤侵犯脑膜时,脑脊液中葡萄糖含量下降,细胞计数正常或仅表现为以淋巴细胞计数升高,常规细胞学检查可能检测到恶性淋巴细胞的存在。而流式细胞术可以增加脑脊液中阳性细胞的数量,从而用于细胞学评估、免疫表型分析,以及通过PCR 检测免疫球蛋白H 或T 细胞受体重排,表明其单克隆性,以提高诊断的准确性。关于PCNSL患者脑脊液标志物,如IL-6、IL-10及其受体水平与其他脑肿瘤的差异可能为PCNSL 的诊断提供新的思路。对于PCNSL 的诊断,影像引导的立体定向活检被认为是金标准。值得注意的是,PCNSL 对皮质类固醇敏感,皮质类固醇具有淋巴毒性,往往可以掩盖病理诊断。在患者接受皮质类固醇治疗后通过立体定向活检获得组织时,敏感性也可能显著降低[14]。因此,除非当需要使用皮质类固醇以稳定迅速恶化的神经功能缺损时危及生命的占位效应和水肿,在活检前应尽可能避免使用皮质类固醇,以减少其对诊断的影响。如果存在眼部受累,选择玻璃体切除术可以提高诊断准确度。病理学检查是诊断PCNSL 的“金标准”。 本例肿瘤界限不清,切面质软而嫩,水肿带呈黄色,而肿瘤呈淡红色。镜下肿瘤细胞呈弥漫性成片分布,形态较为单一,胞质少,核类圆形,染色质分布不均匀,核分裂象多见。PCNSL组织学上常见肿瘤细胞聚集在Virchow-Robin 间隙并侵犯血管壁形成“袖套”结构,部分肿瘤组织中散在分布巨噬细胞,表现为“满天星”。PCNSL病理学类型的鉴定依赖于免疫组织化学检查,最常见的类型是B 细胞型非霍奇金淋巴瘤。本例患者免疫组化表现为CD20(+)和Bcl-2(+)可诊断为弥漫大B 淋巴瘤,而CD10(-)且BCL-6(-)则可诊断为非生发中心型弥漫大B淋巴瘤。
PCNSL 一般呈弥漫性浸润生长,手术在PCNSL 中的作用通常仅限于立体定向活检。手术切除会增加永久性神经功能缺损的风险,目前没有足够的证据推荐对PCNSL 采取手术治疗。全脑放射治疗(WBRT)是治疗PCNSL 的主要手段。PCNSL对放射治疗高度敏感,放疗局部控制率高,但仅以单纯放射治疗PCNSL 是不够的,其复发率高达70%。目前推荐40 Gy 全颅照射加上20 Gy瘤体强化照射的WBRT 作为一线治疗方式。有学者尝试使用高剂量强化全脑放射治疗,但是除了增加了神经毒性风险之外,并不能改善肿瘤的复发率,由此可见约45 Gy 的WBRT被认为是治疗新诊断PCNSL的必要和足够的剂量[15-16]。但是放疗中位生存期为12~18个月,原发部位通常复发。单纯放疗并不能治愈PCNSL,且复发率较高,目前已有明确的证据表明PCNSL 生存期限和放疗剂量无关[17]。为了改善生存结局,目前通常联合放化疗治疗PCNSL。对于全身性非霍奇金淋巴瘤的化疗,CHOP 方案的主要组成药物,如环磷酰胺、多柔比星、长春新碱和泼尼松都难以通过血脑屏障发挥作用,而且PCNSL 也极少发展成非霍奇金淋巴瘤,即使颅外复发,病灶通常不造成患者死亡,因此不需要使用CHOP 方案预防全身性非霍奇金淋巴瘤的发生。甲氨蝶呤是目前推荐治疗PCNSL 的化疗药物,当以高剂量(>1.5 g/m2)快速输注给药时,甲氨蝶呤可快速穿透血脑屏障,从而抑制肿瘤细胞的增殖。
本例PCNSL 患者由于年龄较大,一般身体状况较差,且为复发性PCNSL,对化疗耐受力低,因此治疗该患者我们首选放射治疗。复查评价疗效部分缓解,目前患者失访。PCNSL发病率较低,但恶性程度较高,进展较快,该病容易误诊为转移瘤,因此在治疗时需要谨慎,目前不推荐常规手术治疗,该病的确诊依赖于穿刺活检和病理学检查。放疗和化疗是目前首选的治疗方法,但对于老龄患者、复发性PCNSL 和耐受力差的患者首选放射治疗。除此之外,生物制剂和靶向治疗可能获得更高的总缓解率,长期生存获益还需要进一步随访和研究。

