基于紫外可见光谱的红葡萄酒关键质量指标快速监测
刘彩云 李慧颖 张倩玮 范舒悦 陶永胜,2 李运奎,2
(1.西北农林科技大学葡萄酒学院, 陕西杨凌 712100;2.西北农林科技大学宁夏贺兰山东麓葡萄酒试验示范站, 永宁 750104)
0 引言
葡萄酒是一种具有很高商业价值的商品。葡萄酒酿造过程中品质指标的检测对于产品的质量控制和等级划分具有重要意义。酚类化合物是红葡萄酒生产中的关键成分,因为它们在很大程度上决定了最终产品的感官特性。因此,对于葡萄酒厂而言,能否通过快速、简单、准确且经济的方式获得红葡萄酒发酵和陈酿过程中与酚类化合物的相关信息至关重要。其中黄烷醇、花色苷、黄酮醇、单宁等的变化对于葡萄酒的感官品质(如口感、颜色乃至香气)都有重要的影响,被广泛用于葡萄酒质量评估[1-2]。但目前还没有快速、全面且经济的方法来监测葡萄酒酿造过程中酚类物质的演变。颜色是葡萄酒最直观的品质特征,也是决定消费者购买决策和体验的重要因素。颜色反映了葡萄酒的类型、品质层次、陈酿潜力、营养价值等信息,颜色也作为葡萄酒生产过程中质量控制的重要依据和指标。葡萄酒产业亟需可靠的颜色质量控制手段帮助葡萄酒生产者更加方便、有效地进行葡萄酒色泽质量的管理和控制。
消费者对高质量和安全生产的葡萄酒的需求,要求在质量保证和过程控制方法方面有高标准,而这种需求又要求对葡萄酒在生产过程中和生产后进行适当的分析。葡萄酒发酵和陈酿过程中酚类成分分析方法与颜色管理需以最简单的样品制备,并在多个参数上快速产生结果才能获得广泛的工业应用。虽然有研究者探讨了葡萄酒中酚类物质的分析方法,但都存在葡萄酒行业采用的局限性。如化学方法处理过程的繁琐[3]、高效液相色谱(HPLC)等仪器昂贵的成本都限制了其在行业的应用[4]。随着研究的不断深入和创新,基于光谱的测定方法是目前最具吸引力的分析手段。迄今为止,这些预测葡萄和葡萄酒成分的方法主要集中在红外光谱(Infrared spectroscopy)的使用上[5]。但红外光谱对昂贵的专用仪器的需求,以及对产地、季节和品种的持续验证要求,阻碍了这种技术在常规酚类分析中的应用[6]。因此仍需要能够同时分析多种酚类物质质量浓度和颜色演变的快速、全面的分析方法。酚类化合物在紫外可见(UV-Vis)区域具有天然吸光度,包含了酚类化合物的大量信息。紫外可见分光光度法也因其可靠性、快速性、成本效益和简单性成为酚类的常用定量方法。在葡萄酒研究中,这种光谱技术主要应用于花青素、黄酮类化合物和非黄酮类化合物的鉴定及其浓度的测量[7-8]。同时,这种多参数测量技术也非常适合在线检测系统,这使得它适合于葡萄酒发酵和陈酿过程的控制和监测[9]。
紫外-可见光谱与化学计量学可联合使用于葡萄和葡萄酒中酚类化合物以及多个参数的同时监测。文献[10]测定了波尔多产区(n=34)多产地、多品种、年轻葡萄酒和陈酿葡萄酒的紫外可见光谱,数据显示了紫外可见光谱对葡萄酒酿造过程中酚类物质的分析潜力。文献[11]研究了使用紫外光谱法定量甲基纤维素可沉淀单宁(MCP)的精确多元线性回归(MLR)和偏最小二乘(PLSR)回归校正。文献[12]的研究表明,紫外-可见光谱是监测酿酒过程中酚类成分的有效选择。文献[13]也通过UV-Vis光谱测定发酵过程样品和成品酒中的单宁、花色苷、总酚和颜色的变化。文献[14]基于紫外-可见光谱建立了不同的多元回归方法(RR、PLSR、PCR 和 PRM)用于预测赤霞珠和西拉葡萄酒中单宁和花色苷的质量浓度,在理论研究的基础上还进行了将预测模型商业化的尝试。
本文探究赤霞珠酿酒葡萄发酵和陈酿过程中总酚、总单宁、总黄烷醇、总黄酮醇、总花色苷及颜色参数的变化规律,基于紫外可见吸收光谱结合PCA(主成分分析)和偏最小二乘法区分发酵进程并构建发酵过程中酚类化合物和颜色参数的预测模型,通过校正集和验证集参数证明基于紫外可见光谱监测葡萄酒发酵和陈酿过程中酚类物质和颜色参数演变的可信性与可行性。通过紫外-可见光谱代替繁琐复杂的化学法和精密仪器检测法,实现葡萄酒生产过程中质量指标的快速监测,以期为葡萄酒产业红葡萄酒发酵和陈酿过程的控制提供简便经济的方案。
1 材料与方法
1.1 葡萄原料
赤霞珠葡萄于2021年10月采摘自宁夏贺兰山东麓葡萄酒产区。浆果的pH值为3.83,还原糖(葡萄糖)质量浓度为262.83 g/L,可滴定酸度(酒石酸)质量浓度为6.85 g/L。
1.2 试剂与仪器
没食子酸、咖啡酸、(+)-儿茶素为国产分析纯试剂,购于天津一方科技有限公司;二甲花翠素-3-O-葡萄糖苷标准品购于上海阿拉丁生化科技有限公司;酿酒酵母BV818购自湖北安琪酵母股份有限公司; 果胶酶购于上海源叶生物科技有限公司。
Cary 60 UV-Vis型紫外可见分光光度计,美国安捷伦公司。
1.3 发酵和陈酿过程中样品采集
1.3.1发酵过程
酿酒葡萄经粒选、除梗、破碎后转入5 L规格的玻璃发酵罐中(设置3个重复),入罐期间分3次添加60 mg/L的二氧化硫。然后,添加20 mg/L果胶酶,在4℃下浸渍48 h。通过添加200 mg/L活化后的安琪酵母BV818启动酒精发酵。发酵温度控制在(25±1)℃。通过测定温度和比重监测发酵过程。当发酵自然终止后(残糖质量浓度低于4 g/L),加入60 mg/L的SO2。酒精发酵期间,从3个发酵罐中每天取一次样,每个罐采集17个样品,共采集51个样品。将采集的样品经300目的尼龙布过滤后,于-80℃条件下冷冻保存。在光谱分析和化学分析前,样品在室温(20℃)条件下解冻,并使用离心机在4℃下以7 500 r/min离心15 min。
1.3.2陈酿过程
发酵结束后的葡萄酒分装在250 mL规格棕色瓶中,于酒窖贮存(温度:15~18℃;相对湿度:55%~65%),贮藏过程中每月取1次样品,共采集了30个样品。将采集的样品于-80℃条件下冷冻保存。在光谱分析和化学分析前,样品在室温条件下解冻,并使用离心机在4℃下以7 500 r/min离心15 min。
1.4 紫外-可见吸收光谱采集
样品经离心后,由1 mol/L HCl溶液稀释10倍,在室温黑暗条件下反应1 h,采用光程1 mm的石英比色皿,通过紫外-可见分光光度计扫描200~780 nm范围内样品的紫外-可见吸收光谱,扫描间隔为1 nm,1 mol/L HCl溶液作为参比溶液,每个样品重复3次。
1.5 颜色参数测定
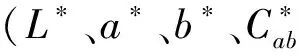
1.6 酚类成分测定
总酚、总黄酮醇、总花色苷质量浓度的测定:取0.5 mL酒样,用10%的乙醇溶液稀释10倍。吸取0.25 mL稀释酒样,加入0.25 mL的0.1% HCl-95%乙醇溶液,加入4.55 mL的2% HCl溶液,摇匀,室温静置15 min。采用10 mm光程、2 mm狭缝宽的比色皿,用紫外分光光度计测定280、360、520 nm下的吸光度,分别对应总酚(A280)、黄酮醇(A360)、总花色苷(A520)的吸光度,由标准曲线计算出质量浓度,浓度乘以稀释倍数进行矫正[16]。
总黄烷醇质量浓度的测定:首先量取(+)-儿茶素母液配制标准溶液加定量的p-DMACA(对二甲氨基肉桂醛),然后用分光光度计滴定各溶液在640 nm波长处的吸光度,绘制总黄烷醇质量浓度的标准曲线。样品中总黄烷醇的测定根据吸光度选取合适的稀释倍数,经与标准溶液相同的处理后在640 nm波长下测定其吸光度,以去离子水调零[17]。重复测定3次,结果以儿茶素等价值表示(mg/L)。
总单宁质量浓度的测定:准确吸取0.5 mL甲醇稀释后的酒样(红葡萄酒需稀释10倍)于试管中,依次加入3 mL的4%的香草醛甲醇溶液和1.5 mL浓盐酸,混匀,避光静置40 min,于510 nm波长下测定吸光度,计算质量浓度[18],结果以儿茶素等价值表示,单位mg/L。
聚合花色苷相对质量浓度的测定:将20 μL 10%乙醛加入到2 mL葡萄酒样品中,在室温下保存45 min,然后用光程1 mm的玻璃比色皿在520 nm处测量吸光度Aacet。将160 μL 0.05 g/mL SO2加入到2 mL葡萄酒样品中,室温下反应10 min后用光程1 mm的玻璃比色皿测定520 nm处的吸光度ASO2[19]。
多聚体花色苷相对质量浓度按ASO2/Aacet×100%计算。
1.7 预测模型构建与验证
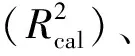
2 结果与分析
2.1 发酵和陈酿过程中酚类物质演变
在红葡萄酒的发酵过程中,酚类物质如黄烷醇、花色苷、黄酮醇、单宁等的变化对于葡萄酒的感官品质(如口感、颜色乃至香气)都有着重要的影响。总酚在浸渍24 h后质量浓度增加为658.01 mg/L,启动酒精发酵后,质量浓度迅速增加,酿造的第11天质量浓度增加为1 606.67 mg/L,而后增加速率减缓(图1a)。总单宁在浸渍24 h后质量浓度为359.26 mg/L,启动酒精发酵的第8天较浸渍结束质量浓度增加了1 896.02 mg/L,而后增加速率略有减缓(图1b)。总黄烷醇在酿造的前7 d质量浓度稳步增加,第8天到第12天之间质量浓度急剧增加,5 d内质量浓度增加376.86 mg/L,而后增加速率明显减缓(图1c)。总黄酮醇在发酵5 d后质量浓度增加到96.43 mg/L,发酵12 d后质量浓度为136.86 mg/L,第13天开始质量浓度逐渐减小,发酵结束后质量浓度为121.86 mg/L(图1d)。总花色苷在发酵的前 7 d质量浓度急剧增加,第7天时质量浓度为212.65 mg/L,而后的第8天到第10天增加速率明显减缓,从第11天到发酵结束,质量浓度逐渐降低,发酵结束时质量浓度为179.73 mg/L(图1e)。聚合花色苷相对质量浓度在发酵的前4 d变化很小,第5天开始占比逐渐增加,发酵结束时聚合花色苷相对质量浓度为34.65%(图1f)。
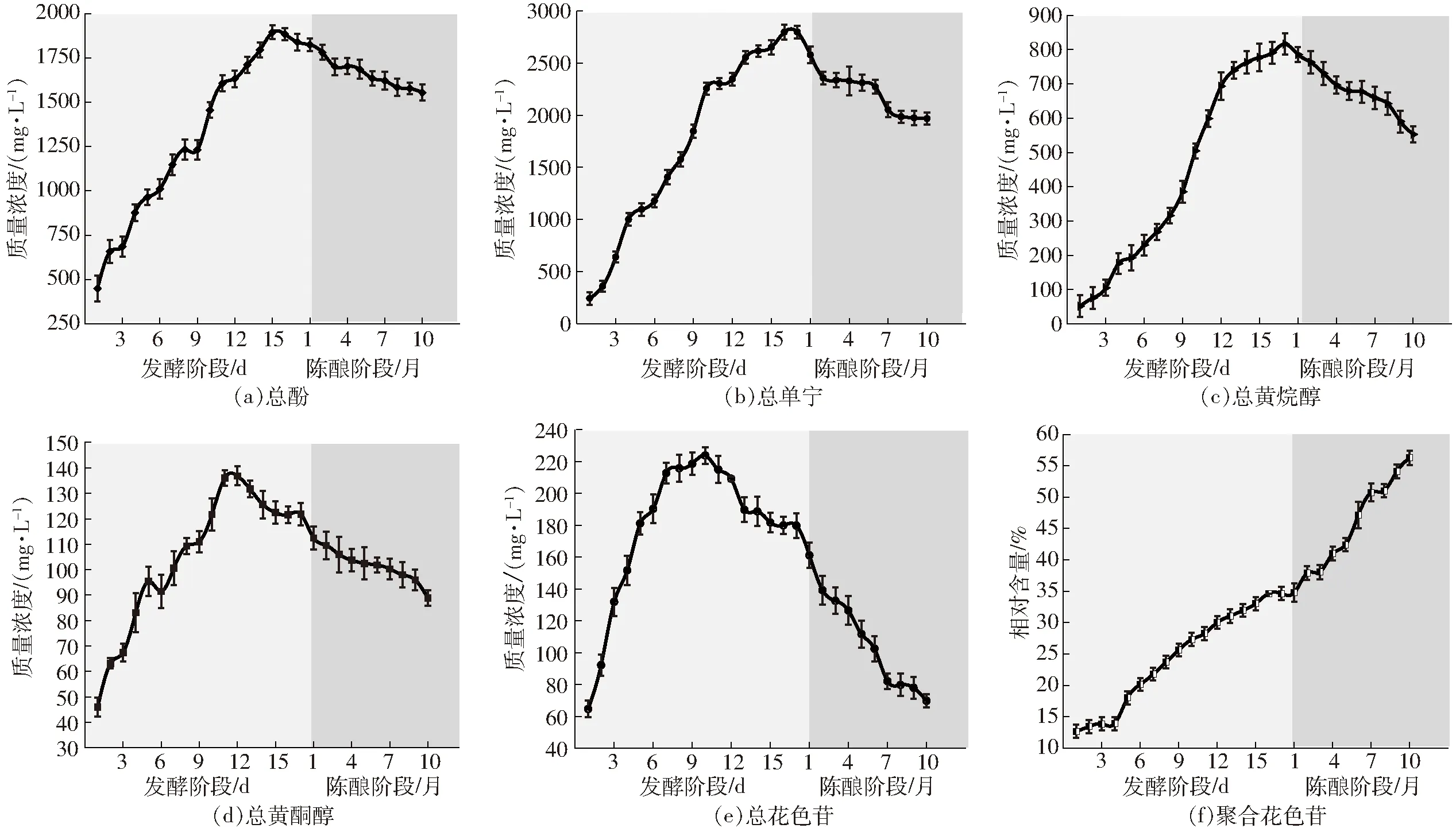
图1 葡萄酒发酵和陈酿过程中酚类物质的演变Fig.1 Evolution of phenolics during wine fermentation and aging
葡萄酒在贮藏过程中酚类化合物的演变是复杂的。年轻的赤霞珠红葡萄酒在陈酿过程中酚类物质质量浓度逐渐减小,聚合花色苷相对质量浓度逐渐增加。贮藏3个月后,总酚质量浓度减小7.52%,而后,总酚质量浓度减少速率逐渐降低(图1a)。单宁在陈酿2个月后,由2 798.33 mg/L减少为2 358.06 mg/L,而后降解速率变缓,呈稳定缓慢减少的趋势(图1b)。黄烷醇质量浓度在陈酿期间逐渐减少,黄烷醇由最初的716.08 mg/L降为552.63 mg/L。在黄烷醇贮藏的前5个月降解速率大于后5个月(图1c)。黄酮醇在最初陈酿时的质量浓度为121.57 mg/L,陈酿10个月后,黄酮醇质量浓度降为88.86 mg/L,陈酿过程中,黄酮醇质量浓度稳步减少(图1d)。陈酿过程中花色苷质量浓度逐渐减少,尤其是在贮藏的前7个月,从贮藏前的178.90 mg/L降低到102.45 mg/L,贮藏8个月后,花色苷质量浓度缓慢降低,直至贮藏10个月后,花色苷质量浓度仅为69.80 mg/L(图1e)。通过SO2漂白法估算聚合花色苷对总花色苷的贡献。新酿造的葡萄酒中聚合花色苷占总花色苷的34.65%,随着葡萄酒的陈酿,聚合花色苷相对逐渐增加,贮藏10个月后,聚合花色苷占总花色苷的56.27%(图1f)。
在葡萄酒发酵过程中总酚、总单宁、总黄烷醇、总黄酮醇和总花色苷在浸渍过程中质量浓度逐渐增加。酚类物质在低温条件以及无酒精环境(水介质)下从浆果的固体部分转移到葡萄汁中。尤其是总花色苷,在浸渍48 h后,由最初的64.69 mg/L增加到131.84 mg/L。聚合花色苷比例在浸渍过程中变化很小。从这个意义上讲,为了改善葡萄酒的一些重要品质特征,如酚类物质,在受控条件下对破碎后的葡萄进行发酵前的冷浸渍是一种重要方法。在浸渍过程中,不同的因素,如浸渍时间、浸渍温度等会强烈影响果皮和种子中酚类物质的提取进程[22]。接种酵母后,酚类化合物质量浓度急剧增加,酵母释放的果胶酶增加葡萄中酚类物质的提取,并且由于酵母对酚类化合物的吸附作用加速了酚类化合物的提取[23],随着酒精发酵的进行,乙醇、二氧化碳、二氧化硫以及温度等都会影响酚类物质的浸提,通常较高温度会增加酚类物质的提取率,因为升高温度可以增加葡萄皮细胞的渗透性[24]。在酒精发酵后期直到发酵结束,随着酒糟的再吸附以及发生的一系列氧化、降解、酒石酸盐沉淀、酚类化合物间的聚合反应等,酚类物质提取速率逐渐变缓,甚至出现质量浓度逐渐减小的趋势,尤其是总黄酮醇和总花色苷。葡萄酒是一个复杂的体系,在储存期间经历许多复杂的变化。这些复杂的变化对葡萄酒的质量和经济价值具有非常重要的影响[25]。年轻的赤霞珠红葡萄酒在陈酿过程中酚类物质质量浓度逐渐减小,聚合花色苷比例逐渐增加。总酚、总单宁、总黄酮醇和总黄烷质量浓度的降低主要归因于陈酿过程中的氧化和聚合反应。其中,黄酮醇极易与花色苷发生聚合反应,对于稳定颜色具有积极作用。花色苷是葡萄酒呈紫红色的主要原因,随着葡萄酒的陈酿,花色苷逐渐聚合,形成聚合花色苷,使得花色苷质量浓度减少,颜色逐渐丧失,红葡萄酒的紫红色逐渐变为橙红色[26]。在红葡萄酒的储存和陈酿过程中,葡萄中存在的游离花色苷和无色多酚(特别是单体和聚合物黄烷醇)之间逐渐形成聚合花色苷。这些化合物在有氧和无氧条件下形成,因此在瓶中储存葡萄酒期间发生的聚合反应基本上是厌氧的,并且受温度的影响比溶解氧浓度的影响更大[27]。
2.2 发酵和陈酿过程中颜色演变
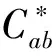
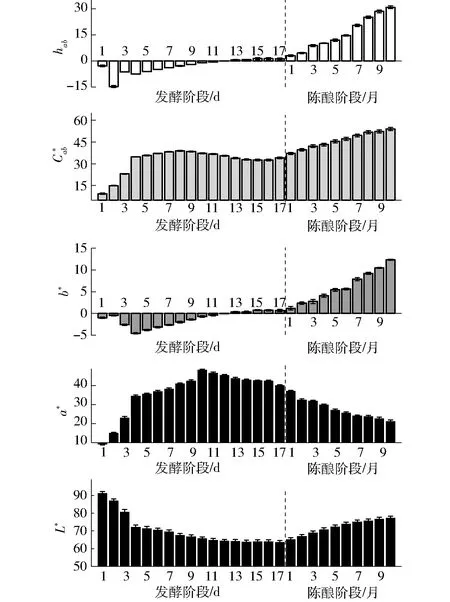
图2 发酵和陈酿过程中颜色的演变Fig.2 Evolution of color during fermentation and aging
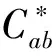
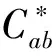
2.3 发酵和陈酿过程中紫外-可见光谱分析
图3展示了发酵和陈酿过程中样品的紫外-可见吸收光谱特征。在浸渍和发酵初期,在520 nm附近观察到显著变化,吸收强度随发酵进程显著增加。由于花色苷在可见光谱的 490~550 nm区域表现出特征吸收带,因此这一现象与葡萄皮中的游离花色苷浸提到葡萄酒中有关。在整个酿造过程中,280 nm附近的吸收强度随发酵进程逐渐增强,说明酚类物质也在快速地浸提到葡萄酒中,280 nm处的吸光度被提议作为葡萄酒中酚类质量浓度的最佳预测指标,因为该波长处具有特征吸光峰。并且以520 nm和280 nm为中心出现轻微红移现象。在酒精发酵即将结束时,发现花色苷的吸收带在逐渐降低,这可能是由于聚合花色苷的形成、酵母细胞壁的再吸收以及形成酒石酸盐沉淀等[32]。
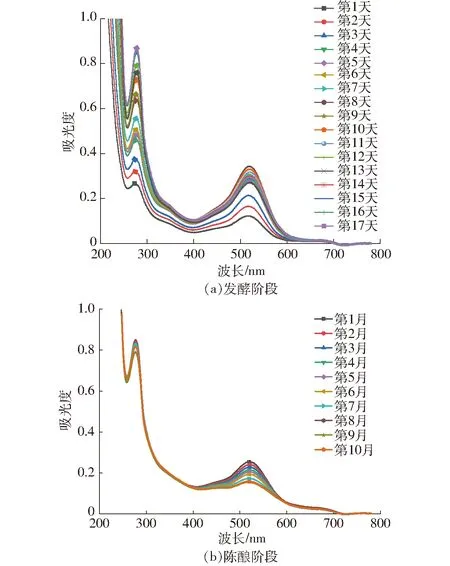
图3 发酵和陈酿过程中紫外-可见吸收光谱的演变Fig.3 Evolution of UV-Vis absorption spectra during fermentation and aging
随着葡萄酒的陈酿,520~535 nm区域的吸光度逐渐降低,在400~420 nm处的黄色/棕色区域的吸光度没有显著变化。因此,陈酿过程中葡萄酒的420 nm和520 nm处的吸光度增加,这也是红葡萄酒陈酿的主要特征之一。并且,红葡萄酒在陈酿期间270~283 nm处的吸光度略有降低,280 nm附近处的吸光度通常与总酚质量浓度和呋喃化合物(如糠醛、乙酰呋喃、5-甲基糠醛)的存在有关,意味着陈酿过程中酚类化合物的聚合,导致总酚质量浓度在减少。这种聚合使得低分子量多酚物质浓度降低,同时聚合多酚浓度增加,进而影响葡萄酒颜色。对这些变化的分析,以及其他不太明显的变化,是为了找到一个简洁的模型来表征葡萄酒的发酵和陈酿过程,特别是预测葡萄酒发酵和陈酿过程中酚类物质和颜色的变化。
为了更进一步研究发酵和陈酿过程中的紫外-可见光谱特征,对200~780 nm范围的光谱采用主成分分析(PCA),得到PC1、PC2和PC3贡献率分别为51.9%、33.2% 和3.8%,前3个主成分的累计贡献率达到88.9%。发酵样品的PCA发现,随着发酵进程样品出现明显的分布差异(图4a),发酵的前7 d,样品得分由第一象限逐渐向第二象限移动,且PC2的影响越来越小。这可能与浸渍和发酵初期酚类物质的浸提有关。发酵后10 d,样品得分由PC1的负半轴逐渐向中心移动,PC1的影响越来越小,而PC1的影响逐渐明显,尤其在发酵的第11天到第17天。这可能与酚类物质的提取基本完成,开始发生一系列复杂的生物化学反应有关。在陈酿过程中,样品得分由第四象限向第一象限移动,主成分的贡献率越来越大。图4b显示了前3个主成分的载荷,即每个波长对该区域方差的影响,PC1和PC2表明200~780 nm的整个紫外-可见光谱都在影响样品光谱的方差,在建立PLSR校正模型时需要考虑这一因素。PC3显示280 nm和520 nm附近区域对光谱方差有很大影响,可能与酚类物质和花色苷有很大关系。结果表明,基于紫外-可见光谱的PCA可用于对发酵和陈酿阶段进行区分,对酿造过程中酚类物质质量浓度变化的定量预测需要进一步建立偏最小二乘回归(PLSR)预测模型。
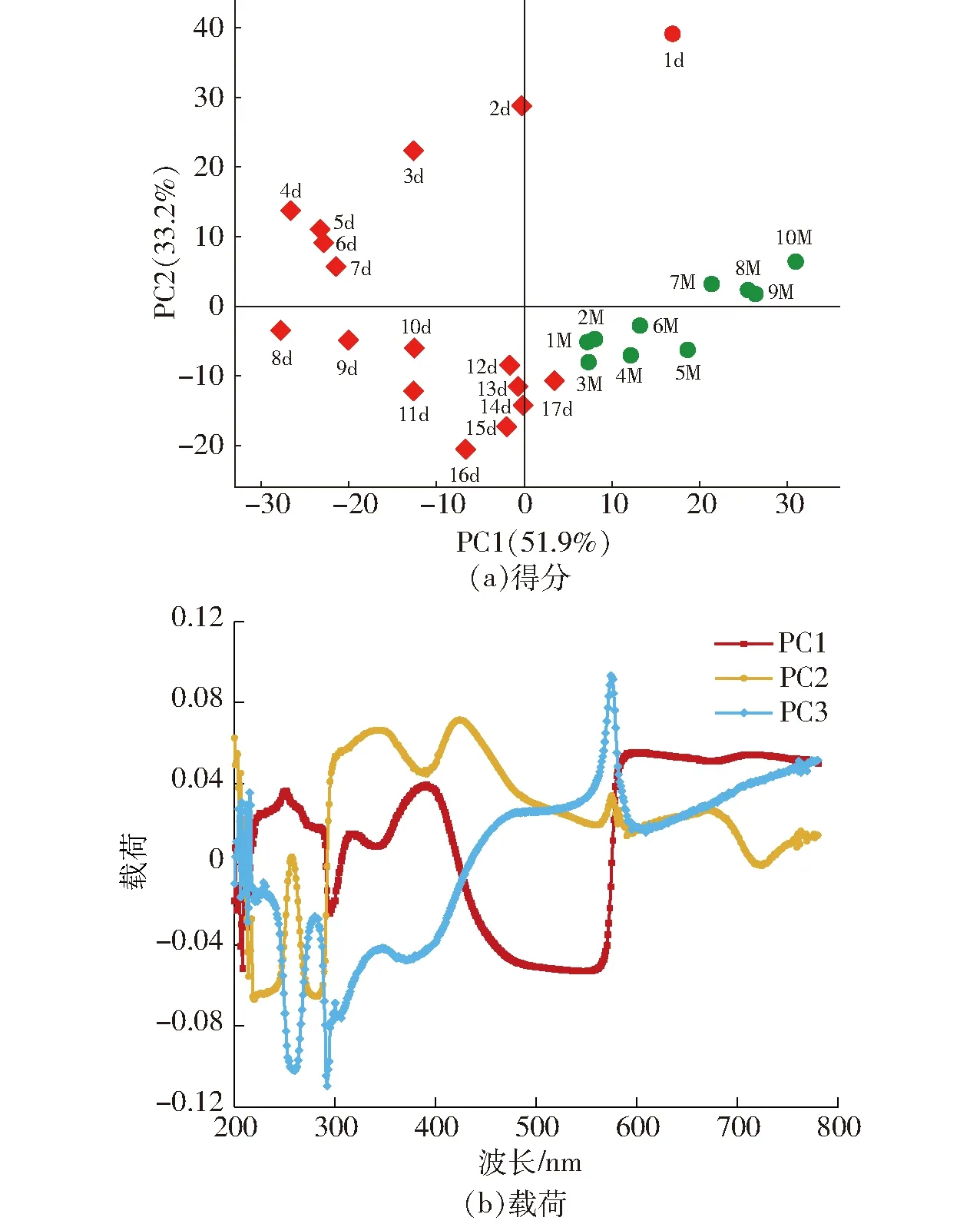
图4 葡萄酒酿造过程中紫外-可见光谱的主成分分析Fig.4 Principal component analysis of UV-Vis spectra during winemaking
2.4 基于紫外-可见光谱构建酚类物质和颜色参数的PLSR预测模型
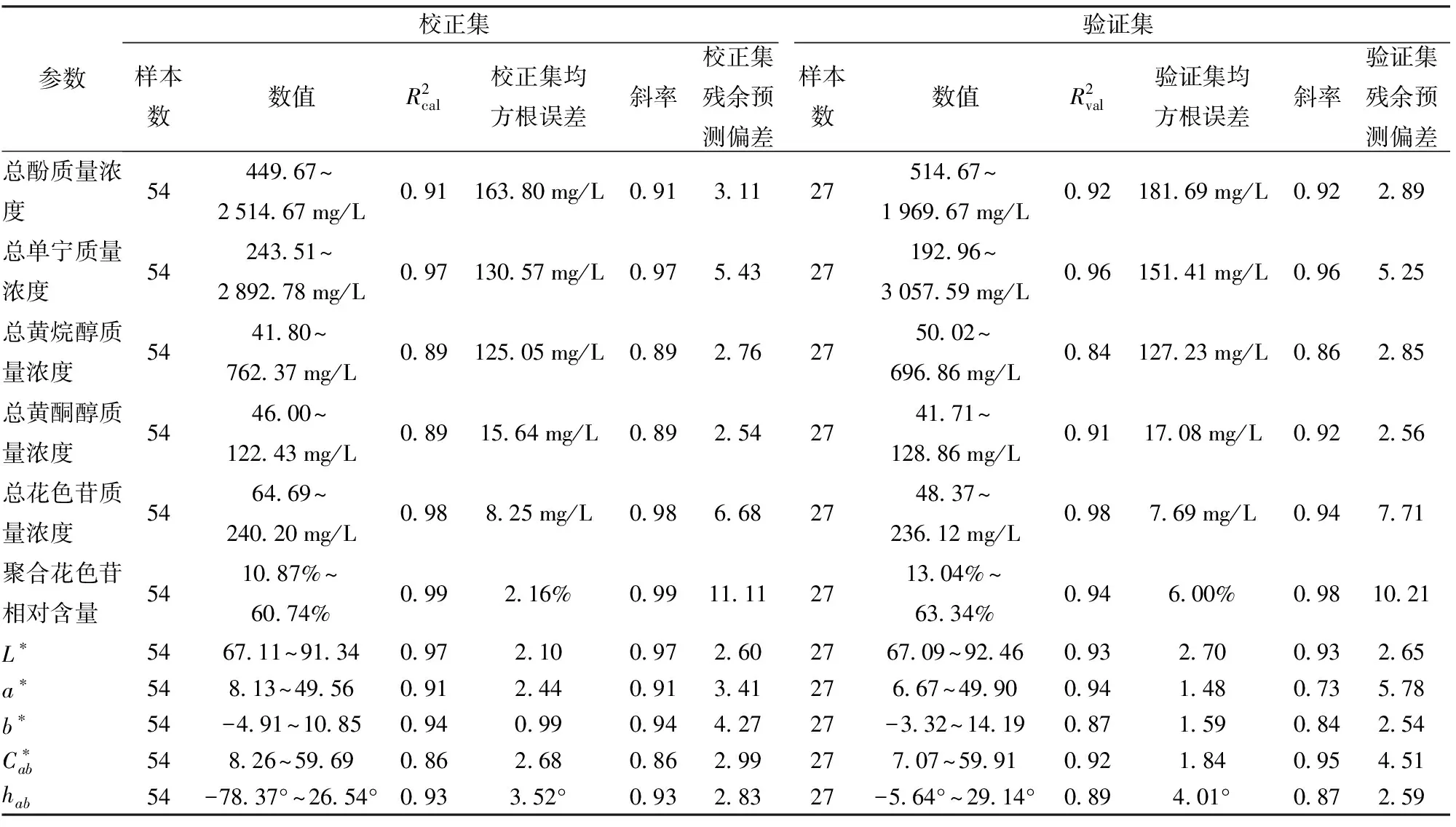
表1 酚类物质和颜色参数的最佳模型性能指标Tab.1 Best model performance indicators for phenolic substances and color parameters
3 结论
(1)浸渍阶段和发酵初期是红葡萄酒酚类物质浸提和颜色形成的关键时期。
(2)在发酵和陈酿过程中,酚类物质和颜色的演变与葡萄酒的紫外-可见光谱之间具有非常紧密的联系。
(3)基于紫外-可见光谱的PCA可以很好地区分发酵和陈酿进程。
(4)基于干红葡萄酒发酵和陈酿过程中的UV-Vis光谱特征构建酚类物质和CIELAB颜色参数的PLSR预测模型,发现PLSR预测模型可以成功地代替化学法和复杂仪器对发酵和陈酿过程中酚类物质和颜色的变化进行定量分析。特别适用于处理大批量样品,实现实时检测。这种方法可以帮助酿酒厂在葡萄酒发酵和陈酿过程快速、简便、准确、经济地监测总酚、总黄酮、总黄烷醇、总单宁、总花色苷、聚合花青素比例和CIELAB颜色参数的变化,进而更好地控制葡萄酒的质量。

