THIP 对MK-801 介导小鼠脑脱髓鞘损伤的保护作用
李金霞, 王 聃, 韩 勇, 尚 彤, 刘 娟, 马全瑞
(宁夏医科大学基础医学院人体解剖与组织胚胎学系,银川 750004)
精神分裂症(schizophrenia,SCZ)是一种患病率高、遗传率高、社会危害性高的精神性障碍,其中出现认知损害的患者占80%,认知症状是SCZ的核心症状之一[1-3]。研究[4-6]发现,SCZ 患者大脑出现脱髓鞘改变后,增强髓鞘的形成可以改善认知损伤,髓鞘损伤或发育不良与SCZ 认知障碍密切相关。因此,保护损伤髓鞘或促进髓鞘修复是改善SCZ 认知障碍的潜在途径。在体内,少突胶质前体细胞(oligodendrocyte precursor cells,OPCs)分化为少突胶质细胞(oligodendrocytes,OLs),OLs 继续分化成熟后围绕神经元轴突形成髓鞘。髓鞘形成和OLs 分化成熟是一个高度动态调节的过程[7],提高OLs 分化成熟是促进髓鞘形成或修复的关键步骤[8]。
γ-氨基丁酸(γ-aminobutyric acid,GABA)A受体(γ-aminobutyric acid sub-type A receptors,GABAAR)能够介导GABA 的多种生理性作用[9]。神经元释放的GABA 递质可通过GABAAR 调控OLs 分化及髓鞘形成过程[10]。阻断GABAAR 能够通过抑制OLs 分化导致髓鞘损伤[11]。然而,干预GABAAR 是否可通过调控OLs 分化进而影响地卓西平马来酸盐(dizocilpine maleate,MK-801)脑损伤模型髓鞘的修复,目前尚不清楚。加波沙朵(gaboxadol,THIP)是GABAAR 特异性激动剂,本研究以腹腔注射MK-801 介导的脑损伤模型小鼠为研究对象,利用行为学、形态学及分子生物学方法观察THIP 对MK-801 脑损伤模型小鼠学习记忆、髓鞘损伤和OPCs 分化的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取36 只6~8 周龄SPF 级C57BL/6J 雄性小鼠,体质量18~20 g,由宁夏医科大学实验动物中心提供[SCXK(宁)2020-0001]。所有动物自由饮水进食,光照/黑暗周期为12 h,鼠房环境温度为(22±1)℃。
1.1.2 主要试剂与材料 MK-801、THIP 均购自美国Sigma 公司,小鼠抗CC-1 抗体(MABC200)购自德国默克Calbiochem 公司,重组Anti-Olig2抗体(ab109186)购自Abcam(上海)贸易有限公司,兔抗GPR17 抗体(10136)购自美国Cayman Chemical 公司,小鼠抗β-Actin 抗体(TA-09)购自北京中杉金桥公司,山羊抗小鼠IgG H&L(ab150116)购自Abcam(上海)贸易有限公司;山羊抗兔IgG H&L(ab150077)购自Abcam(上海)贸易有 限公司;HRP Goat Anti-Rabbit IgG、HRP Goat Anti-Mouse IgG(A21020),购自武汉Abbkine公司;动物行为学记录分析系统购自西班牙Panlab 公司,H7650 型透射式电子显微镜购自日本日立公司。
1.1.3 MK-801 介导小鼠脑损伤模型的制备与分组 将36 只小鼠随机分为对照组(Blank 组)、MK-801 损伤 组(MK-801 组)、THIP 干预组(MK-801+THIP 组),每组12 只。MK-801 组小鼠连续14 d 腹腔注射MK-801[1.0 mg·(kg·d)-1],Blank 组给予相同体积的生理盐水处理,MK-801+THIP 组在制备模型的第8 天开始添加THIP[5.0 mg·(kg·d)-1]。
1.2 方法
1.2.1 水迷宫实验 选择安静且密闭的环境进行实验,将小鼠提前1 h 放入房间以适应环境。实验前6 d 为训练阶段,每只小鼠每天训练4次,头朝池壁按东、南、西、北方位分别将小鼠放入水池中,记录小鼠找到平台前的潜伏游泳时间与潜伏游泳距离,潜伏游泳时间越长、潜伏游泳距离越长,则反映小鼠学习记忆损伤越严重,若超过1 min 小鼠未找到平台,则将小鼠放到平台上观察周围环境15 s,并将潜伏游泳时间设为1 min。实验第7 天为测试阶段,在测试阶段,将平台撤出,将小鼠放进水迷宫中1 min,记录其跨越平台次数,跨越平台次数越少,则反映小鼠学习记忆损伤越严重。
1.2.2 透射电子显微镜 使用2%戊二醛溶液将脑组织在4 ℃固定2 h,更换二钾胂酸钠缓冲液(0.1 mol·L-1)洗2 次,梯度乙醇脱水后环氧丙烷渗透2 次;不完全包埋液与环氧丙烷渗透各1 h,不完全包埋液渗透过夜;完全包埋液35 ℃温箱浸泡6 h 后转移至包埋板,42 ℃温箱过夜后于60 ℃温箱干燥48 h。完成组织包埋后修复、切片定位,在各组小鼠胼胝体相近区域随机选取5 个视野进行拍照,观察髓鞘超微结构。
1.2.3 Western blot 蛋白印迹技术 用全蛋白提取试剂盒提取脑皮层蛋白,蛋白质定量(BCA)法检测蛋白浓度并统一定量后变性。150 V 恒压条件下10% SDS-PAGE 凝胶电泳分离蛋白(上样量为30 μg/孔);0.2 A 恒流条件下将蛋白转移至PVDF 膜上(4 ℃);5%脱脂牛奶封闭2 h;一抗(兔抗GPR17,1∶2 000;兔抗β-actin,1∶2 000)4 ℃孵育过夜;二抗(山羊抗兔,1∶10 000)室温孵育1 h;添加ECL 混合发光液后上机曝光。用Image J 软件分别测量并计算对应的目的蛋白和内参蛋白的灰度值,采用正常对照组灰度值比值均一化处理各组灰度值比值,每个样本至少重复3 次。
1.2.4 免疫荧光染色 将石蜡切片60 ℃加热2 h,依次入二甲苯脱蜡、梯度乙醇水化;0.01 mmol·L-1柠檬酸钠缓冲液抗原修复15 min;山羊血清封闭30 min;加入一抗(小鼠抗CC-1,1∶200;兔抗Olig2,1∶200),4 ℃冰箱孵育过夜;加入荧光二抗(山羊抗兔,1∶400;山羊抗小鼠,1∶400)避光孵育1 h 后用含DAPI 封片剂于避光环境下封片。每组样本的脑皮层相近区域选取6 个20 倍物镜视野观察并拍照、计数。比较各组胼胝体相近区域6 个20 倍物镜视野内阳性细胞数的表达差异。
1.3 统计学方法
采用GraphPad Prism 8 软件作图。计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析(one-way ANOVA),多组间两两比较采用Bonferroni 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 THIP 可改善MK-801 损伤小鼠下降的学习记忆功能
水迷宫实验结果显示,与Blank 组相比,MK-801 组小鼠潜伏游泳时间延长、潜伏游泳距离延长、跨越平台次数减少(P均<0.05);与MK-801 组相比,MK-801+THIP 组小鼠潜伏游泳时间缩短、潜伏游泳距离缩短、跨越平台次数增多(P均<0.05),见图1。
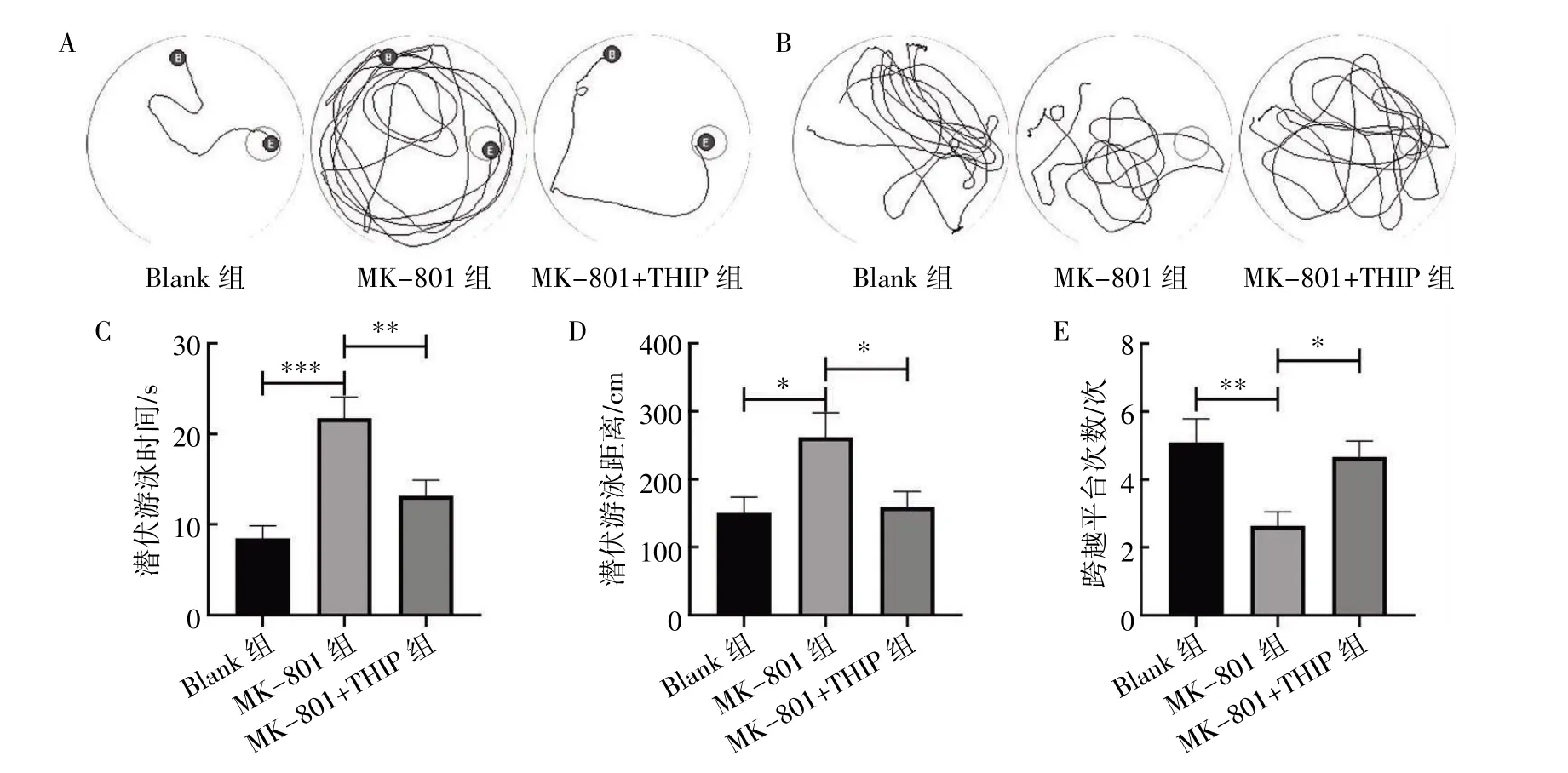
图1 水迷宫实验检测THIP 对MK-801 损伤小鼠学习记忆的影响
2.2 THIP 改善MK-801 损伤小鼠脑髓鞘超微结构
透射电镜观察胼胝体附近髓鞘超微结构结果显示,Blank 组内髓鞘板层结构致密完整,无局灶性溶解和水肿等病理变化;与Blank 组相比,MK-801 组小鼠脑髓鞘结构紊乱变形,板层结构分离,出现局灶性溶解;在MK-801+THIP 组中,髓鞘局灶性溶解的情况明显改善,板层清晰,结构致密,形态完整,见图2。
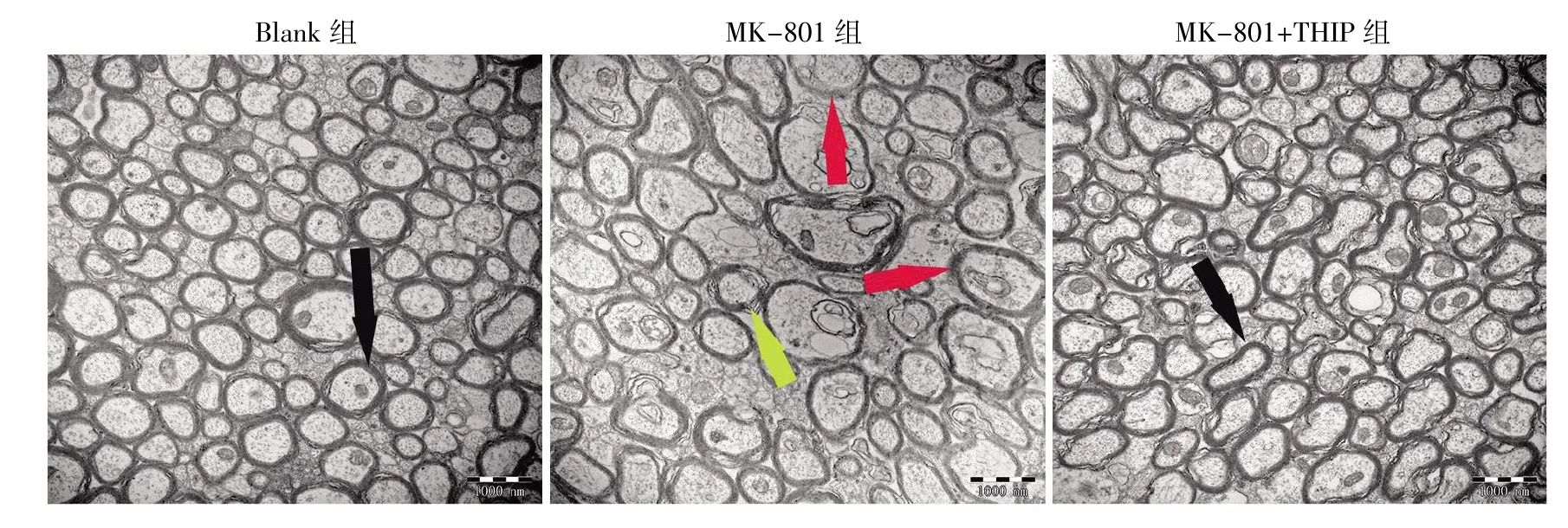
图2 电镜观察THIP 对MK-801 损伤小鼠脑髓鞘超微结构的影响(bar=1 000 nm)
2.3 THIP 增加MK-801 损伤小鼠脑内成熟OLs的数量
各组小鼠胼胝体附近区域的荧光结果显示,与Blank 组相比,MK-801 组小鼠CC-1+/Olig2+细胞数量减少(P<0.05);与MK-801 组相比,MK-801+THIP 组小鼠CC-1+/Olig2+细胞数量增多(P<0.05),见图3。
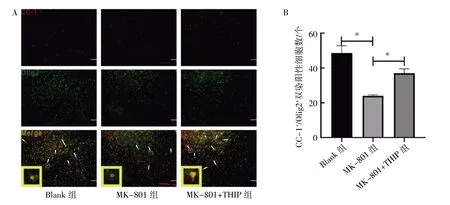
图3 免疫荧光检测THIP 对MK-801 损伤小鼠脑内成熟OLs 细胞数目的影响
2.4 THIP 降低MK-801 损伤小鼠脑内GPR17蛋白表达量
GPR17 是OPCs 分化的负性调节蛋白,GPR17表达越高意味着OPCs 分化为OLs 的能力越弱,相反,GPR17 表达越低意味着OPCs 分化为OLs的能力越强。Western blot 实验结果显示,与Blank组相比,MK-801 组小鼠GPR17 蛋白表达量升高(P<0.01);与MK-801 组相比,MK-801+THIP 组小鼠GPR17 蛋白表达量降低(P<0.01),见图4。
3 讨论
N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体拮抗剂MK-801 介导脑损伤的动物模型是目前精神疾病研究领域普遍认可的SCZ 动物模型,用于SCZ 发病机制和干预措施的研究[12]。在本研究中,水迷宫实验显示,MK-801介导的脑损伤模型小鼠较正常小鼠潜伏游泳时间延长,潜伏游泳距离增加,跨越平台次数减少,提示MK-801 组小鼠学习记忆能力受损,与前期研究[13-14]结果一致。经腹腔注射THIP 干预后,MK-801 损伤小鼠潜伏游泳时间和潜伏游泳距离缩短,跨越平台次数增加,提示THIP 可有效改善MK-801 脑损伤小鼠的学习记忆能力。THIP 是一种有效且具有特异性的GABAAR 激动剂,可以直接激活含有δ 亚基的突触外GABAAR[15],产生抑制性突触后电流[16]。经腹腔注射BIC 抑制GABAAR作用可加重脑损伤小鼠的学习记忆受损程度,也从反面证明激活GABAAR 对MK-801 介导的脑损伤小鼠学习记忆能力具有改善作用[17]。
脱髓鞘和髓鞘再生障碍是SCZ 的重要发病机制之一,也是认知障碍发生的重要原因,研究显示,Cuprizone 诱导脱髓鞘的动物模型可出现明显的学习记忆力下降[18-19],药物促进此模型脑内髓鞘修复或减少髓鞘破坏可明显改善学习记忆下降等认知障碍行为[20]。本实验结果发现THIP干预可逆转MK-801 损伤小鼠脑内髓鞘板层结构的破坏,由此可见,髓鞘保护很可能是THIP 改善SCZ 模型小鼠学习记忆功能的机制之一。同时也有学者[21]认为,GABAAR 通过调控海马神经可塑性变化来改善认知损伤。
在中枢神经系统(CNS)中成熟OLs 包裹神经元轴突形成一个多层的、致密的同心圆结构即髓鞘。成熟OLs 数量增多是髓鞘形成或修复必不可少的条件。CC-1 存在于成熟OLs 的细胞体中,与Olig2 双标后可以标记成熟的OLs[22]。本研究采用免疫荧光检测CC-1 与Olig2 双标的阳性细胞数量,结果显示脑损伤模型小鼠脑内OLs(CC-1+/Olig2+)数量较正常小鼠减少。研究[23-24]显示,MK-801 与OPCs 的分化密切相关,MK-801可通过能量代谢过程影响OLs 存活,也可通过mTOR 信号通路阻断OPCs 分化和髓鞘形成。也有学者[25]使用RNA 干扰技术特异性敲低OPCs上NMDAR 的GluN1 亚基表达来抑制OPCs 的分化,导致成熟OLs 减少。THIP 干预可增加脑损伤模型小鼠脑内成熟OLs 数量,说明THIP 可能通过促进OLs 分化成熟或减少成熟OLs 的丢失来保护髓鞘损伤。GPR17 是一种G 蛋白偶联膜受体,在OPCs 向OLs 分化过程中,GPR17 高表达可抑制晚期OPCs 进一步分化成熟,进而导致髓鞘形成障碍,OPCs 分化晚期GPR17 的缺失是使OLs 完成最终成熟的必要条件[26]。本研究结果显示,脑损伤模型小鼠脑内GPR17 表达量较对照组小鼠增加,提示MK-801 介导的脑损伤模型小鼠OPCs 分化受抑制,导致最终成熟的OLs(CC-1+/Olig2+)数量减少,与相关报道[27]相符。THIP 干预可逆转MK-801 诱导小鼠脑内GPR17 的表达上调,意味着THIP 可通过促进OPCs 向OLs 分化,影响最终成熟的OLs 数量,有益于髓鞘的修复。但截至目前,我们依然不清楚THIP 是否通过对抗MK-801 诱导的OLs 损伤/死亡,继而减少髓鞘的破坏,是否存在这种可能性,需要进一步实验证明。
综上所述,本实验发现THIP 干预脑损伤模型小鼠可通过增强OPCs 分化作用促进髓鞘修复,由此改善脑损伤模型小鼠的学习记忆功能,从而为THIP 改善脑损伤认知障碍提供新机制。

