基于网络药理学及分子对接技术探讨千金藤素治疗新型冠状病毒感染的作用机制
黄 灿, 牛 阳, 南 一, 袁 玲, 窦红莉, 姜文婕
(1.宁夏医科大学中医学院,银川 750004; 2. 宁夏少数民族医药现代化教育部重点实验室,银川 750004;3.宁夏医科大学药学院,银川 750004; 4. 陕西中医药大学,咸阳 712046)
新型冠状病毒感染是一种人群普遍易感的传染病[1]。目前针对新型冠状病毒的3CL 蛋白酶抑制剂Paxlovid 是由奈玛特韦和利托那韦联合使用的一种药物,另一种药物阿兹夫定属于RNA 聚合酶抑制剂,可抑制病毒复制或清除病毒,但这两种临床用药均会导致肝功能异常,腹泻、味觉减退,消化不良、胃食管反流、呕吐,头痛、肌肉酸痛等不良反应[2-3]。千金藤素(cepharanthine,CEP)是从传统中药白药子的块根中提取的,其具有抗炎、抗菌、抗氧化、抗溶血和促进抗体生成,提高机体免疫力的作用[4-5],临床上用于治疗肺部炎症和急性肺损伤(acute lung injure,ALI),同时作为白细胞增生药治疗辐射引起的白细胞减少症[6-8]。研究[9]显示,10 μmmol·L-1的CEP 可抑制冠状病毒复制的倍数为15 393 倍。CEP 具有明显的抗急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)活性的能力,其实验疗效优于已获批上市的瑞德西韦和帕罗韦德,可用于对抗COVID-19[10-12],但其作用通路机制尚不明确。故本研究通过网络药理学筛选出CEP 化合物与疾病作用靶点进行聚类分析,同时对化合物-靶点进行分子对接,计算理化参数,评价其相互作用,以期为CEP 抑制COVID-19 的作用机制和药物开发提供参考意义。
1 方法
1.1 CEP 靶点预测
借助PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/),以“cepharanthine”为关键词检索其分子表达式、国际化学品标识符及密钥(international chemical identifier and key,InChIKey)、使用规范算法生成的线性描述代谢物结构(canonicalization the simplified molecular-inout line-entry system,Canonical SMILES)、2D 结构等信息,将Canonical SMILES 号导入SwissTargetPrediction 网站(http://www.swisstargetprediction.ch/)预 测CEP的靶点。
1.2 预测COVID-19 疾病靶点,得出“药物-疾病”交集靶点
通过GeneCards 数据库(https://www.genecards.org/),以“novel coronavirus pneumonia”“new coronavirus pneumonia”和“COVID-19”为关键词搜集疾病靶点,合并删除重复项。在Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/index.html)中分别输入CEP 和COVID-19 疾病的作用靶点,得到“药物-疾病”交集靶点。
1.3 构建PPI
把交集靶点导入STRING 11.5(https://cn.string-db.org/)构建PPI,将tsv 文件导入Cytoscape 3.9.0 软件中进行可视化。
1.4 基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclope-di a of genes and genomes,KEGG)通路富集分析
将1.2 得到的交集靶点导入DAVID 数据库(https://david.ncifcrf.gov/),选择物种为“Homo sapiens”,P<0.05,其余为默认值,进行GO 生物功能分析和KEGG 通路富集分析。利用微生信(http://www.bioinformatics.com.cn/)在线绘图工具,分别对GO 分析结果的生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)取P值最小的前10 个结果以及KEGG 的GeneInGO 值的前20 个结果作可视化处理。
1.5 成分-靶点分子对接
为进一步验证CEP 治疗COVID-19 的作用关系,选用已被确定为SARS-CoV-2 的功能宿主受体ACE2 和3CLpro 分别与CEP 和文献[13]推荐药物作分子对接。
2 结果
2.1 CEP 的靶点信息获取情况
在PubChem 数据库得到CEP 的分子表达式、InChIKey、Canonical SMILES、2D 结构等信息(表1),并从SwissTargetPrediction 中预测到100个药物靶点。

表1 千金藤素成分信息
2.2 疾病靶点预测结果
根据上述方法共得到4 735 个疾病靶点,与CEP 的靶点交集得到40 个共有靶点(图1)。
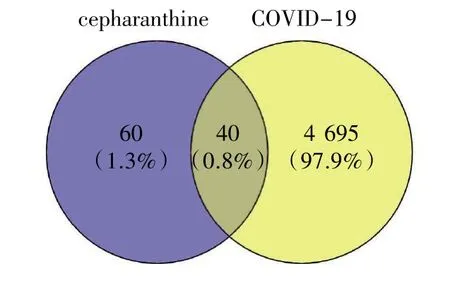
图1 CEP 与COVID-19 交集靶点图
2.3 构建PPI
将40 个交集靶点导入STRING 11.5 构建PPI,将tsv 文件导入Cytoscape 3.9.0 软件中删除独立节点,根据度值(Degree)对其作可视化处理(图2),图中包含38 个节点和224 条边。同时由Cytoscape 3.9.0 内置分析功能分析得到各蛋白之间的拓扑结构参数,以Degree 大小为排序标准,筛选出核心蛋白,其中可见核心靶点:肉瘤(sarcoma,Src)基因、蛋白质丝氨酸/苏氨酸激酶1(protein serine/threonine kinase 1,AKT1)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)等,见表2。
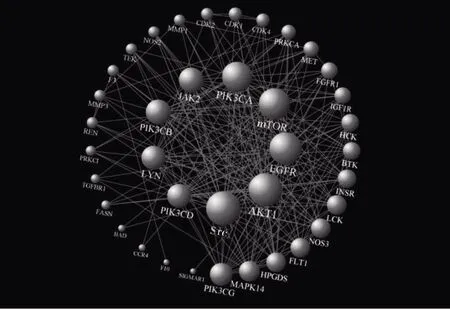
图2 Cytoscape 3.9.0 软件对PPI 作可视化处理
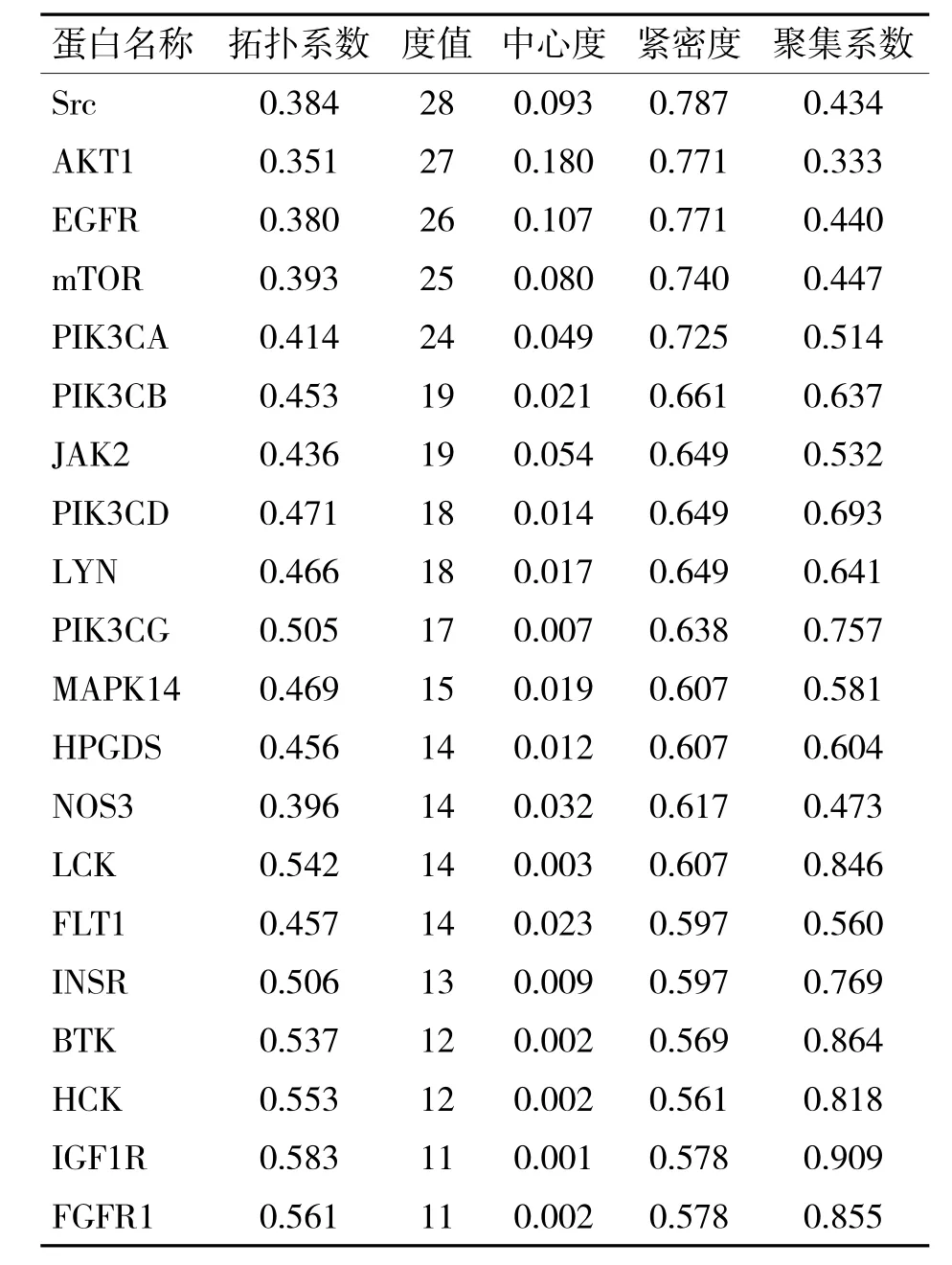
表2 排名前20 的交集靶点拓扑结构参数
2.4 GO 生物功能分析和KEGG 通路富集分析
GO 分析一共得到333 个条目,其中BP240条,CC31 条,MF62 条。利用P值分别筛选出前10 条作可视化处理(图3)。主要涉及蛋白质磷酸化、信号转导、蛋白激酶B 信号的正调控等生物学过程;BP 包括蛋白质结合、ATP 结合、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性等;CC 有质膜、胞质溶胶、细胞质等。KEGG 筛选得到133 条,根据GeneInGO 值(基因在GO 中的数量)筛出前20条通路(图4),其中有19 个靶点富集在PI3K-AKT信号通路、11 个靶点在MAPK 信号通路、8 个靶点在coronavirus disease - COVID-19 信号通路。根据KEGG 以及核心靶点结果绘制coronavirus disease-COVID-19 信号通路(图5)。
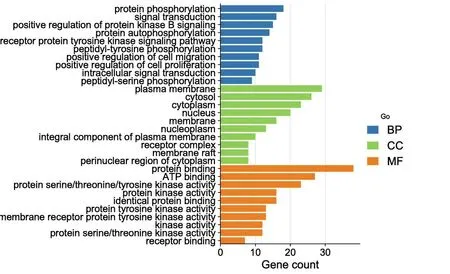
图3 GO 功能分析结果柱状图
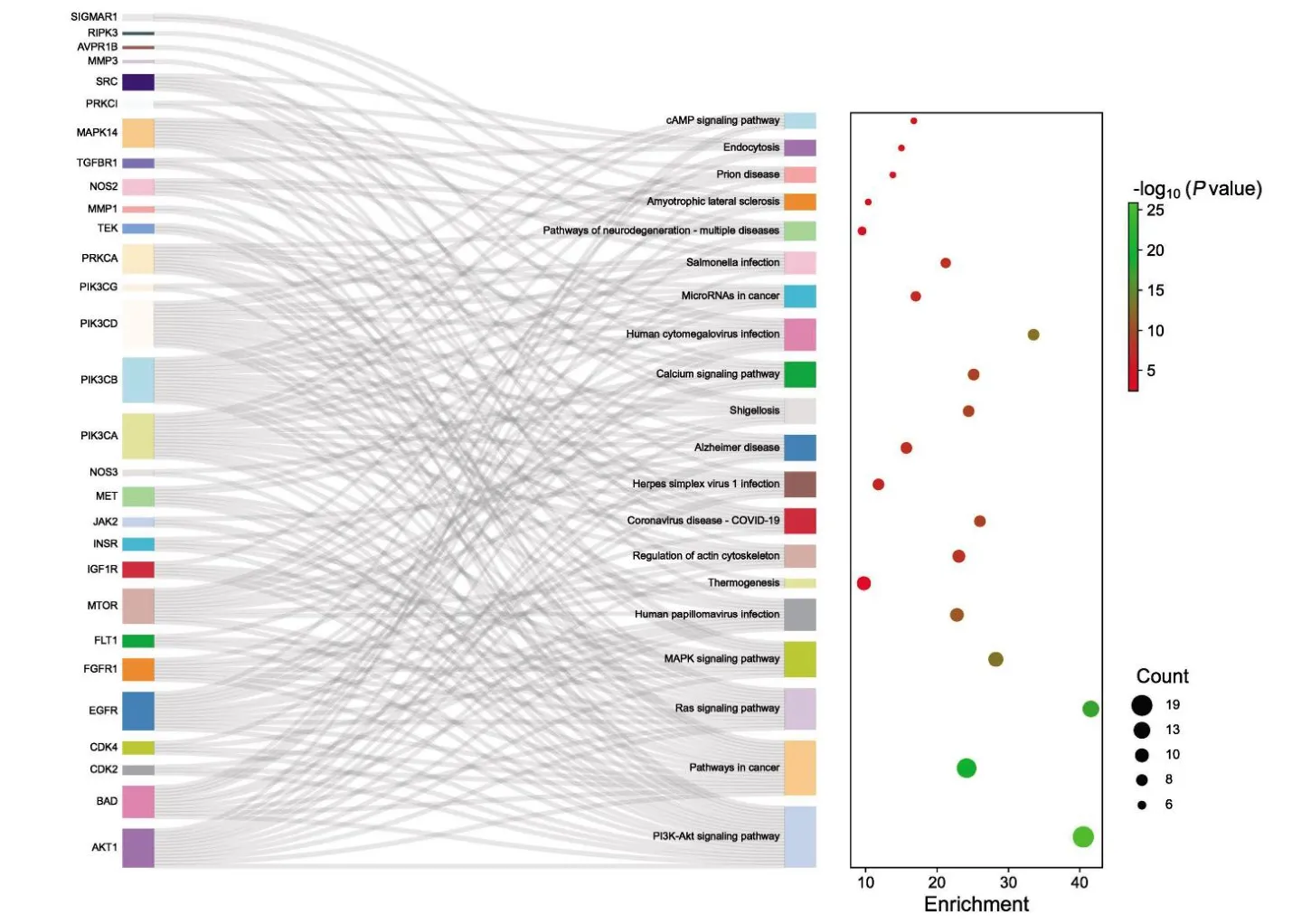
图4 KEGG 通路富集分析桑基气泡图
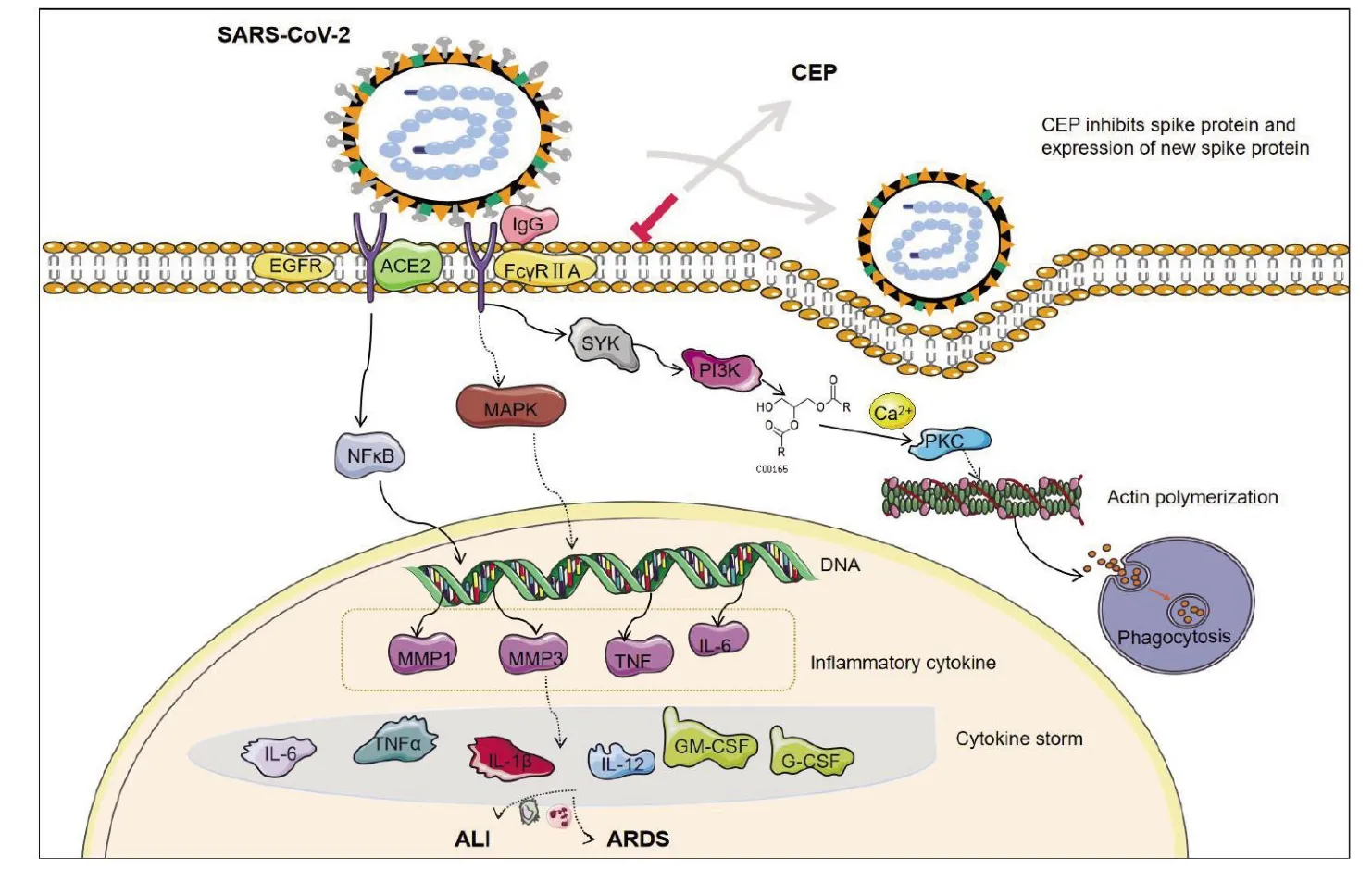
图5 coronavirus disease-COVID-19 信号通路
2.5 分子对接结果
对重要靶点进行分子对接。对接分数可评价结合活性:分数<-5.0 kcal·mol-1说明结合活性较好,分数<-7.0 kcal·mol-1则说明两者之间有强烈的结合活性[14],即配体与受体结合构象越稳定,能量越低,分子与靶点蛋白作用越突出[15]。首先,CEP 与前8 个核心靶点蛋白分子对接(表3),CEP与靶蛋白的最低结合能均<-7.0 kcal·mol-1,说明配体与受体可以自发紧密结合,即CEP 与COVID-19 的靶点具有较好的结合性。同时,选取CEP 和文献[13]推荐的5 种药物分别与ACE2(PDB ID:1R42)和3CLpro(PDB ID:6LU7)进行分子对接(表4),CEP 与COVID-19 的两个受体蛋白结合能量值明显最低,两者相互作用关系更紧密;分子对接结果可视化可见空间上,CEP 能够很好地嵌入病毒的蛋白酶活性位点,蛋白构象稳定,说明CEP 与COVID-19 能够稳定结合(图6)。

表4 药物活性成分与COVID-19 核心靶点分子对接
3 讨论
CEP 是抗COVID-19 和抗肺癌药物,被美国食品药品监督管理局(FDA)批准为SARS-CoV-2 感染的候选治疗药物[16]。研究表明,CEP 可抑制SARS-CoV-2 病毒附着,阻止其进入细胞,对新出现的SARS-CoV-2B.1.351 变异具有很强的疗效[17],被用作SARS 的临床前实验[18]。CEP 也有良好的抗COVID-19 疗效,其安全性得到一定程度的验证[19];作为治疗COVID-19 候选药物的CEP可作用于病毒复制酶,能抑制核因子-κB(NF-κB)的活化、脂质过氧化、一氧化氮(NO)的产生和环氧合酶的表达,从而抑制病毒复制[20]。CEP 对人冠状病毒OC43 和SARS-CoV 也具有抗病毒的特性[21],Wang 等[22]通过小鼠体内模型发现CEP 可降低IL-1β、IL-6 和TNF-α 等炎性因子的表达量,具有抗炎特性;Ohashi 等[23]构建了疗效数学预测模型,结果显示静脉注射CEP 和口服奈非那韦的联合用药对COVID-19 患者有良好的协同效应,病毒清除比单独使用奈非那韦早1.23 d,两种药物都显示出抗病毒活性,其治疗浓度在已获批的人体适用浓度内,两者同时使用的抗病毒效果更佳。芝加哥大学Drayman 等[24]筛选评估了所有FDA 提名的候选药物,发现CEP 抗新冠病毒的EC50(引起50%最大效应的浓度,越低越好)只需0.1 mol·L-1,远低于其他候选药,说明CEP的抗新冠病毒活性优异。Fan 等[25]通过转录组学的方法进一步解释了CEP 抗COVID-19 的机制,认为CEP 主要通过干扰细胞应激反应,逆转受感染细胞中大多数失调的基因和通路,从而发挥抗冠状病毒效果;同时对数千种药物进行了高通量筛选,发现中药单体化合物CEP 具有较强的抗新冠病毒活性。Jiang 等[26]从分子水平证实了CEP 治疗COVID-19 的潜在机制,为快速发现有效的COVID-19 治疗药物提供了新的线索和理论依据。因此,进一步研究CEP 对COVID-19 的潜在作用变得至关重要。
在核心靶点中,Src 蛋白是细胞质中的酪氨酸专一性蛋白激酶,与质膜的细胞质膜相结合后可调控细胞的增殖、发育和分化,并且其生成物可高度激活多种肿瘤细胞[27]。Src 激酶家族在病毒生命周期中起着关键作用,与SARS-CoV-2复制有关[28]。研究[29]表明,酪氨酸激酶Src 在SARSCoV-2 滴度上呈剂量依赖性降低。AKT1 是PI3K下游的重要蛋白,PI3K 激活后可募集活化AKT1进而激发内皮细胞活化和细胞增殖,促进上皮细胞间质转化,会加重肺部炎症损伤,释放多种炎性因子[30]。EGFR 是上皮生长因子(EGF)细胞增殖和信号传导的受体,与配体结合后能够激活PI3K-AKT 信号传导通路,继而触发基因转录,同时控制细胞增生、分化和生存。SARS-CoV-2感染时肺损伤可导致EGFR 过表达[31],引发促炎反应,易导致肺纤维化。古巴分子免疫中心的研究团队使用抗EGFR 抗体治疗COVID-19 患者,结果表明抗EGFR 抗体可改善疾病的炎症,并抑制肺纤维化[32]。主要存在于真核生物中的mTOR是一种AKT1 激酶,可整合多类细胞刺激信号,调节下游细胞因子的表达,进而调控细胞增殖、分化、自噬与凋亡,促进物质代谢,参与分化免疫细胞[33]。mTOR 及其组成的相关信号通路在哮喘的发生发展中发挥着重要作用[34],mTOR 能抑制人肺泡上皮细胞,刺激微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)的表达进一步激活自噬,释放炎性介质从而调控肺泡上皮细胞的损伤机制[35]。研究[36-37]表明,抑制mTOR 可诱导自噬细胞凋亡从而减少SARSCoV-2 引起的炎性反应。可见CEP 作用于COVID-19 时,多靶点参与炎性反应。
在GO 条目中BP 条目占比最大,为72.1%,CC 占9.3%,MF 占18.6%。CEP 治疗COVID-19的GO 分析发现蛋白质磷酸化是重要的生物学过程,波士顿医学院研究团队发现SARS-CoV-2病毒会使肺细胞陷入混乱,导致细胞内蛋白磷酸化频率发生异常变化,从而加速病毒繁殖,最终破坏细胞,造成广泛的肺损伤[38]。SARS-CoV-2病毒的S 蛋白与ACE2 结合后,宿主细胞表面的其他蛋白会启动病毒外膜与细胞膜融合,将病毒RNA 注入细胞,由此推断CEP 可能通过阻止病毒入侵宿主细胞的膜融合,抑制SARS-CoV-2 病毒复制[39]。KEGG 通路富集分析可知,PI3K-AKT 信号通路在RNA 病毒复制和治疗肺炎过程中可诱导抗体反应,上调抗病毒蛋白,直接抑制病毒复制,亦能激活先天免疫,清除病毒,有利于肺组织重构[40]。同时,PI3K-AKT 信号通路调控细胞增殖和凋亡,在低氧环境下PI3K 被激活使下游AKT 磷酸化,增强HIF-1 的活性,启动下游靶标基因转录,促进细胞增殖,抑制细胞凋亡[41]。研究[42]发现,SARS-CoV-2 感染可激活PI3K-AKT 调控下游的mTOR 蛋白激酶,抑制自噬,降低异常增殖的肺成纤维细胞的凋亡,从而促进肺纤维化,并促进病毒蛋白快速合成。也有研究[43]表明,SARS-CoV-2 病毒通过表面S 蛋白与ACE2 结合,借助网格蛋白介导的内吞作用进而在细胞内形成内体,且该途径受PI3K-AKT 信号通路调控。同时,MAPK14、EGFR、MMP1、MMP3、PIK3CA、PIK3CB、PIK3CD、PRKCA 这些与病毒感染、免疫反应、炎性反应相的蛋白富集在coronavirus disease-COVID-19信号通路上[44],SARS-CoV-2 的S 蛋白表位在免疫球蛋白G(IgG)和受体结合期间体现出一定的亲和力[45],抗SARS-CoV-2 表面S 蛋白的IgG滴度主要参与严重的SARS-CoV-2 感染,与FcγRⅡA 受体结合促进细胞质内脾酪氨酸激酶(spleen tyrosine kinase,SYK)的表达,进一步激活PI3KAKT 信号通路;PIK3CA、PIK3CB、PIK3CD 为PI3K的催化亚基,主要通过PI3K-AKT 发挥生物学作用,PI3K 的下游蛋白甘油二酯(diacylglycerol,DAG)在Ca2+的协同下激活蛋白激酶C(protein kinase C,PKC),引起级联反应,进行细胞应答,并促使PKC 由细胞质转移至细胞膜上,触发微生物表面的肌动蛋白聚合,由此产生的力可推动病毒穿过细胞质,并启动细胞吞噬作用,肌动蛋白又参与骨骼肌质量的调节,故感染SARS-CoV-2 又多有关节肌肉酸痛的症状。有学者研究发现多种SYK 和PI3K 抑制剂可抵消抗S 免疫复合物介导的炎性反应[46]。ACE2 可通过Src 家族通路、PI3K 通路,分别激活NF-κB 通路、P38(MAPK14)信号通路,进而上调MMP1、MMP3 等炎性因子的表达,过度激活炎性细胞、巨噬细胞和中性粒细胞,引起肺组织损伤,从而导致ALI 和严重急性呼吸窘迫综合征(ARDS)。故推测CEP 作用于COVID-19 时,主要通过PI3K-AKT、coronavirus disease-COVID-19 信号通路调控炎性反应,同时有大量靶标蛋白参与细胞增殖、凋亡与自噬,抑制病毒复制,参与肺组织重构,从而改善呼吸系统环境,提示了新冠病毒感染的关键机制和途径。
ACE2 是新冠病毒侵入细胞的受体蛋白[47],其遗传机制是COVID-19 基础研究及防诊治的关键[48],血浆中ACE2 蛋白水平在遗传上与COVID-19 重症有遗传正相关且具有增加COVID-19 感染、住院和重症风险的因果效应。ACE2 可以保护肺部免受ALI,SARS-CoV 的S 蛋白与ACE2 结合,则ACE2 下调,即刻出现ALI 和肺水肿,产生大量炎性因子进而促使呼吸衰竭。SARS-CoV-2产生的主要蛋白酶3CLpro 是冠状病毒复制所必需的酶,在病毒感染与复制中发挥着重要作用,可作为有效的抗病毒药物靶点[49]。有研究表明,3CLpro 切割位点在SARS、MERS 病毒和2019-nCoV 冠状病毒中属“高度保守”区域,对冠状病毒的变异株保有高度活性,加上人类在HIV 蛋白酶抑制剂上的成功经验,认为3CLpro 是广谱抗冠状病毒药物的有效靶点,3CLpro 抑制剂能够有效抑制病毒的感染与复制[50],发挥抗病毒的作用。SARS-CoV-2 病毒的Polyprotein 1a 和Polyprotein 1ab 在多个位点被3CLpro 切割,产生对病毒复制至关重要的非结构蛋白,因此阻止这种切割会抑制病毒复制和增殖[51],根据分子对接图的结合位点可知,CEP 能与其活性氨基酸残基结合,并深入其结合口袋,由此推断CEP 可能对3CLpro 具有一定抑制作用。本研究将以上两个COVID-19重要受体分别与CEP 和5 种抗病毒药物做分子对接验证,显示CEP 与COVID-19 受体均能紧密结合,结合能分别为-9.5 kcal·mol-1和-8.4 kcal·mol-1,因此更有优势,稳定性最佳。故推测,CEP 在治疗COVID-19 中具有潜在的成药性,能够发挥积极作用,但需要进一步的药效学验证。
综上可知,本文通过网络药理学预测CEP 可能通过调节PI3K-AKT、coronavirus disease-COVID-19 等信号通路从而干预COVID-19 的作用,分子对接验证显示CEP 能和COVID-19 的两大主要受体紧密联系,有利于病毒抑制剂的研发,希望能为今后的基础实验和临床实验提供参考。

