基因芯片分析Narasin 对雌激素受体阳性乳腺癌细胞基因表达的影响
蔡卫吉, 凌 珺, 王宝祯, 马 磊, 王彦凤, 李 涛, 陈 静
(1.宁夏医科大学基础医学院,银川 750004; 2.宁夏医科大学生育力保持教育部重点实验室,银川 750004;3. 宁夏医科大学临床医学院,银川 750004; 4.宁夏医科大学总医院肿瘤医院肿瘤外二科,银川 750004)
乳腺癌是人类最常见的癌症之一,是一种具有不同组织病理学特征的异质性疾病,其发生发展是由多因素共同作用的结果[1-2]。研究[3-5]发现,年龄、家族史、月经初潮年龄或更年期年龄、生殖因素、雌激素和生活方式等均是导致乳腺癌发生的重要危险因素。近年来个体化治疗方案使乳腺癌各分子亚型的患者无病生存率和总生存率明显提高[6-7]。然而,我国乳腺癌发病率仍逐年上升,且发病年龄呈年轻化趋势[8-10]。因此,寻找新的治疗靶点对于提高乳腺癌患者的生存率及降低复发率具有重要意义。雌激素受体阳性(ER +)乳腺癌是最常见的乳腺癌亚型,约占所有乳腺癌的70%[11]。Narasin 是一种从白色链霉菌中分离出的羧基聚醚离子载体,目前作为一种治疗家禽球虫病的抗生素被添加在饲料中[12]。本课题组前期研究[13]发现,Narasin 能够通过TGF-β/SMAD 和IL-6/STAT3 信号通路来抑制ER+乳腺癌细胞的转移和生长,但具体机制还需要进一步探究。基于以上研究背景,本研究利用生物信息学方法分析经Narasin 作用后ER+乳腺癌细胞基因的改变,寻找其发挥作用的分子机制及关键靶标,以期为Narasin 抑制乳腺癌细胞增殖、转移提供更充分的理论依据。
1 材料与方法
1.1 材料
1.1.1 主要仪器设备 CO2培养箱(力康生物医疗科技控股有限公司);4 ℃低温离心机(Eppendorf 公司);ABI 9700 RCR 仪(ABI 公司);全波长酶标仪、NanoDropR2000、GeneChipRHybridization Oven 645、GeneChipRFluidics Station 450、GeneChipRScanner 3000 7G(Thermo Fisher 公司)。
1.1.2 细胞培养试剂 ER+乳腺癌细胞系MCF-7(美国Type Culture Collection 公司),TRIzol(Ambol 公司),总RNA 提取试剂盒(Macherey-Nagel公司),3’IVT PLUS 试剂盒(Affymetrix 公司),GeneChipR杂交、洗涤和染色试剂盒(Affymetrix公司)。
1.2 方法
1.2.1 细胞培养 所有细胞用含有10%胎牛血清(MultiCell Technologies 公司)的DMEM(Multi-Cell Technologies 公司)培养基在37 ℃、5%CO2的培养箱中培养,每48 h 更换1 次培养基。Narasin(适马-阿尔德里奇公司)溶解在100%二甲基亚砜中,生成10 mmol·L-1溶液,并以小份储存于-80 ℃环境中。
1.2.2 RNA 的提取 将ER+乳腺癌细胞MCF-7按照2×106个/孔的密度接种在100 mm 组织培养皿中,待细胞贴壁后将其分为对照组C(未经Narasin 处理的3 个重复对照组C1、C2、C3)和实验组T(经0.05 mmol·L-1的Narasin 处理的3个重复实验组T1、T2、T3)。在37 ℃、5%CO2培养箱中继续培养24 h,待细胞密度达90%时用PBS 清洗,加入TRIzol,反复吹打,使细胞充分裂解。加入氯仿,室温静置15 min,随后4 ℃、12 000 r·min-1离心10 min,吸取上清,加入异丙醇,静置10 min,再次4 ℃、12 000 r·min-1离心10 min,75%乙醇洗涤沉淀,离心后室温静置5 min,充分干燥后,加入DEPC 轻弹溶解RNA,55~60 ℃放置10 min,使RNA 充分溶解,-70 ℃保存。采用分光光度计和琼脂糖凝胶电泳测定其浓度和质量,总RNA 纯化的详细步骤严格按照3’IVT PLUS 试剂盒说明书操作。本实验中的对照组和实验组均独立重复3 次。
1.2.3 数据标准化处理和差异基因(DEGs)的筛选 将基因数据集用Affymetrix 公司提供的Expression Console 软件进行芯片QC 质检,用Robust Multichip Average(RMA)进行统一性处理,利用R 语言中的limma 包初筛后得出DEGs。将样品分组进行组间统计学Moderated T-test 分析,根据组间>1.5 倍差异和组间P≤0.05 进行筛选,得到Narasin 处理后的实验组较对照组上调、下调的DEGs,并以对照组的基因芯片为验证集,考察所筛选出来的DEGs 表达值与聚类区分度。根据样本类型和基因表达量,使用MEV4.9.0(Multi Experiment Viewer)绘制基因聚类热图。DEGs 火山图以差异倍数(log Fold Change)为x轴,P值为y轴并以灰色粗线标示倍数差异与显著性的阈值,将过检的下调基因标示为绿色,上调基因标示为红色。
1.2.4 KEGG 通路和GO 富集分析 为了进一步分析DEGs 的生物学功能,根据基因本体(gene ontology,GO)数据库和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路数据库对差异表达显著的基因进行生物学富集分析。GO 富集分析分为分子功能(molecular function,MF)、生物过程(biological process,BP)和细胞组成(cellular composition,CC)3 个部分,主要对DEGs 进行功能类别或者细胞定位分析。
2 结果
2.1 Narasin 处理后MCF-7 细胞的DEGs 分析
综合分析后,共筛选出111 个DEGs(|log2FC|≥1.5,adjustP-value<0.05),与对照组相比,用0.05 mmol·L-1Narasin 处理后的实验组有82 个上调基因和29 个下调基因(差异在1.5 倍以上)。火山图和聚类热图用于表示这些基因在对照组和实验组中的表达情况。DEGs 火山图如图1A 所示,越偏离中心两条线的点,代表此基因在实验组和对照组的差异越明显。DEGs 聚类热图(图1B)显示,下调的基因包括细胞色素P450 24 A1(CYP24A1)、眼缺失蛋白2(eyes absent homolog 2,EYA2)等。

图1 Narasin 处理后MCF-7 细胞差异基因的表达
2.2 GO 富集分析
为进一步探究0.05 mmol·L-1Narasin 处理后111 个DEGs 的生物学意义,将以上DEGs 上传到DAVID 数据库以确定重要的GO 类别和KEGG途径。GO 分析结果显示,在BP 中下调的DEGs主要富集在先天免疫系统、Ⅰ型干扰素信号通路、病毒基因组复制的负调控、免疫反应、伤口愈合、细胞迁移、基因表达调控、细胞黏附及细胞增殖等(图2A)。在CC 中下调的DEGs 主要富集在膜的锚定组件、血液微粒、细胞中心体、核斑点等(图2B)。而在MF 中下调的DEGs 主要富集在细胞因子活性、酶结合、DNA 结合、双链RNA 绑定、受体结合、鸟苷酸交换因子活性、钙调蛋白结合、转录辅阻遏物活动等(图2C)。

图2 Narasin 处理后MCF-7 细胞DEGs 的GO 富集分析
2.3 KEGG 通路分析
KEGG 通路富集分析结果显示,DEGs 主要富集于癌症中的小分子核糖核酸、单纯疱疹病毒感染、麻疹、黏着斑、ECM-受体相互作用、PI3KAkt 信号通路、甲型流感、Rap1 信号通路及糖尿病并发症中的AGE-RAGE 信号通路等,见图3。
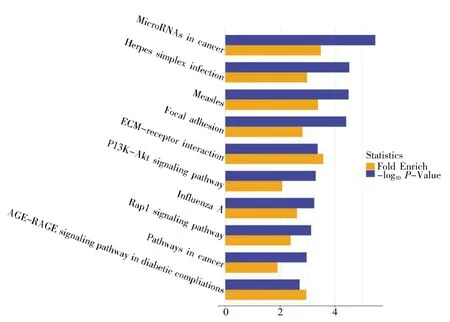
图3 Narasin 处理后MCF-7 细胞DEGs 的KEGG 通路分析
3 讨论
乳腺癌是全球女性癌症相关死亡的主要原因,早期转移和复发是乳腺癌死亡率高的主要原因,并且患者的预后个体差异很大[14-15]。现阶段针对乳腺癌的有效治疗方法主要是药物化疗,但化疗易导致多种不良反应,效果欠佳,需要靶向药物来弥补这一治疗缺陷,以提高患者的生活质量[16-18]。因此,新的抗乳腺癌药物的研发至关重要。
本课题首先通过基因芯片检测未经Narasin处理的乳腺癌细胞和0.05 mmol·L-1Narasin 处理的乳腺癌细胞DEGs 的表达情况,结果得到111个DEGs,其中有81 个基因表达上调,29 个基因表达下调。随后对DEGs 进行GO 富集分析和KEGG 通路分析。GO 富集分析结果显示,BP 中下调的DEGs 主要富集在先天免疫系统、Ⅰ型干扰素信号通路、病毒基因组复制的负调控、免疫反应、伤口愈合、细胞迁移、基因表达调控、细胞黏附和细胞增殖等过程中。CC 中下调的差异基因富集在膜的锚定组件、血液微粒、细胞中心体、核斑点等。MF 中下调的差异基因主要富集在细胞因子活性、酶结合、DNA 结合、双链RNA 绑定、受体结合、Rho 鸟苷-核苷酸交换因子活性、钙调蛋白结合、转录辅阻遏物活动等。KEGG 通路分析结果显示,下调差异基因通路主要富集在小分子核糖核酸、单纯疱疹病毒感染、麻疹、黏着斑、ECM-受体相互作用、PI3K-Akt 信号通路、甲型流感、Rap1 信号通路及糖尿病并发症中的AGE-RAGE 信号通路等。
基因芯片分析发现,Narasin 下调了CYP24A1、EYA2 等基因。CYP24A1 又称为25-羟维生素D3-24-羟基化酶,由CYP24A1 基因编码,在维生素D 的代谢中发挥重要作用[19-20]。研究[21-22]显示,维生素D 的代谢与细胞增殖、分化和凋亡等有关,维生素D 缺乏会增加罹患癌症的风险。CYP24A1介导的维生素D 缺乏促进了乳腺肿瘤的发展,并且CYP24A1 过表达与基础性乳腺癌的预后不良相关,提示CYP24A1 可能是一个候选癌基因[23-24]。EYA2 是EYA 家族蛋白之一,具有高度保守的EYA 结构域,该家族成员可以编码一系列转录辅助因子。研究[25-28]表明,EYA2 可以促进多种类型的肿瘤发生,其在乳腺癌组织和细胞中高度表达与乳腺癌预后不良相关。
IL-6 /STAT3 信号通路、PI3K-Akt 信号通路等能够调节细胞增殖、侵袭和转移等生物学过程[29-31]。本课题组前期的实验结果显示,Narasin能够影响STAT3 和Akt 的激活,抑制MCF-7 细胞的迁移和侵袭能力[13]。本研究中KEGG 通路分析显示,下调的差异基因富集在PI3K-Akt 信号通路,因此推测Narasin 可能通过调节STAT3 的激活影响EYA2 的表达,进而抑制乳腺癌细胞的增殖、侵袭和转移,后续将通过基础实验进一步进行验证。
本研究利用生物信息学方法从多角度考察了对照组和实验组在基因表达及生物学过程之间的差异。从基因层面探索了Narasin 抑制乳腺癌增殖和转移的潜在靶点及通路,为寻找Narasin 作用的分子机制及关键靶标,以及抗肿瘤转移的治疗提供了更好的方向。但更为具体的机制还需要后续实验进行更加深入的探究。

