两种不同方法提取骨髓间充质干细胞来源外泌体的比较
徐 彧, 徐海瑾, 李家瑞, 孔 斌, 李 卉, 陆 宏, 宋 辉
(1. 宁夏医科大学基础医学院医学遗传学与细胞生物学系,银川 750004; 2.宁夏医科大学基础医学院生物化学与分子生物学系,银川 750004; 3. 宁夏医科大学基础医学院人体解剖与组织胚胎学系,银川 750004)
间充质干细胞(mesenchymal stem cells,MSCs)是一种具有多向分化潜能的成体干细胞[1],源于机体发育不同阶段的多个组织和器官中,如骨髓、脂肪、脐带、胎盘、牙髓等[2]。基于低免疫原性、组织来源多样化、易于在体外分离并快速扩增等优势[2-4],MSCs 的研究和治疗取得了一定进展。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)是较早发现并研究较为深入的一种MSCs[5]。研究[6]表明,MSCs 主要通过其所衍生的外泌体来发挥旁分泌修复作用。外泌体粒径为30~150 nm,普遍存在于各种体液中,并携带亲代细胞中的蛋白质、脂质、DNA、RNA 等重要物质[7-8],可以进行细胞间信息传递,影响细胞的生理状态,并与多种疾病的发生发展密切相关[9]。研究[10]发现,MSCs 外泌体不仅具有与亲代MSCs 相似的生物学作用,且免疫原性更低,更容易量化,并能在储存和运输过程中保持生物活性,克服了MSCs 的很多缺陷,有望替代MSCs 成为新型的无细胞疗法。如何有效地制备外泌体,并保留其生物学特性,是进一步实验研究及临床应用的重要前提。目前,提取外泌体的主要方法有超速差速离心法、ExoQuick-TCTM法、密度梯度离心法、色谱法等[11-13],但均未形成规范化体系。本研究对大鼠BMMSCs 外泌体两种提取方法(超速差速离心法与ExoQuick-TCTM法)进行比较,以期筛选适合大鼠BMMSCs 外泌体的有效提取方法。
1 材料与方法
1.1 主要仪器及试剂
超高速离心管、超速高速离心机(Thermo MTX150)购于赛默飞世尔科技有限公司;透射电子显微镜(HITACHI H-7650)购于日本日立公司;DMEM/F12 培养基(10565-018)购于美国Gibco 公司;无外泌体血清(C3801-0100)购于德国BI 公司;RIPA 裂解液(P0013B)购于上海碧云天生物技术有限公司;油红O 及茜素红均购于赛业(广州)生物科技有限公司;胎牛血清购于美国Gibco 公司;CD63(PA5-92370)购自美国Invitrogen 公司;CD81(ab109201)购自英国Abcam 公司;β-actin(AP0060)购自Bioworld 公司;Goat Anti-Rabbit IgG H&L(HRP)(ab6721)购自英国Abcam公司;ExoQuick-TCTMExosome Precipitation Solution购于System Biosciences 公司。
1.2 方法
1.2.1 原代BMMSCs 的分离及培养 取6 只SPF级雄性SD 大鼠,体质量为100~150 g,麻醉处死后,乙醇浸泡5 min,转入超净台,在无菌条件下,去除大鼠双下肢腿部的皮肤和肌肉,分离出完整股骨和胫骨,置于无菌PBS 中。然后转入装有75%乙醇的无菌皿中30 s 后取出,PBS 液冲洗3次。剪掉股骨和胫骨的两端,用注射器吸取完全培养基,少量多次冲洗髓腔,将冲洗液收集于离心管中,600×g离心5 min,将沉淀重悬于DMEM/F12 完全培养基中,根据细胞密度用移液枪接种于培养瓶或培养皿中,放入培养箱。24 h 后半量换液,之后每隔2 d 换液,待细胞汇合度达到90%后,按1∶3 传代,取3 代BMMSCs 用于进一步实验和检测。
1.2.2 流式细胞术检测BMMSCs 的表面标记物 用胰酶消化6 孔板中的3 代BMMSCs,4 ℃、600×g离心5 min,收集沉淀细胞,PBS 液洗涤2 次后进行细胞计数。取3×105个BMMSCs 置于1.5 mL 离心管中(6 管),600×g离心5 min,去上清液,吸取200 μL,PBS 重悬细胞,其中4 管分别加入CD34-FITC、CD44-FITC、CD45-PE 和CD90-PE 抗体各2 μL,剩余2 管分别加入IgG-FITC 和IgG-PE 同型对照抗体2 μL,涡旋数秒,避光孵育30 min,PBS 液冲洗2 次,最后用300 μL PBS 重悬细胞,30 min 内在流式细胞仪上检测。检测结果用FlowJo(Ver10.0)进行分析。
1.2.3 BMMSCs 的分化功能鉴定 成骨诱导:使用适量0.1%明胶处理6 孔板,1 h 后吸掉明胶,待6 孔板底面晾干后按一定密度接种3 代BMMSCs,当细胞汇合度至60%~70%时,吸弃原培养基,更换为成骨诱导分化培养基,每2 d 换液1 次,密切观察细胞生长情况及形态变化,诱导27 d 后进行茜素红染色。成脂诱导:将3 代BMMSCs 按一定密度接种于6 孔板中,每隔2 d换液1 次,直至细胞过融合,吸弃原培养基,每孔加入2 mL 大鼠BMMSCs 成脂诱导分化培养基A液。3 d 后吸弃A 液,加入相同量的诱导分化B液。24 h 后吸弃B 液,换回A 液进行诱导。A 液和B 液交互作用,每天观察细胞形态及生长情况,镜下可观察到脂滴时,停止诱导,进行油红O染色。
1.2.4 BMMSCs 外泌体的分离提取 取3 代BMMSCs接种于T-75 培养瓶中,待细胞汇合度至80%时,吸弃旧培养基,更换为不含外泌体血清的培养基,进一步培养48 h,于预冷的离心管中收集细胞上清液。将上清液分为两份,每份45 mL,分别进行两种方法BMMSCs 外泌体的提取。超速差速离心法:将BMMSCs 上清液置于4 ℃条件下差速离心,依次经过300×g离心10 min,2 000×g离心20 min,12 000×g离心30 min 去除残留细胞和细胞碎片;收集上清,经0.22 μm 滤筛过滤,除去微生物及大囊泡;最后用超高速离心机120 000×g离心90 min,弃上清液,将外泌体沉淀重悬于PBS中。ExoQuick-TCTM法:将BMMSCs 上清液3 000 ×g离心15 min,去除残留细胞和细胞碎片。参考说明书,按样本量∶外泌体试剂盒=5∶1 的比例,向上清液中加入适量提取试剂,并颠倒试管混匀,置于4 ℃下过夜。离心生物液混合物,1 500×g30 min。弃上清液,将外泌体沉淀重悬于PBS液中。
1.2.5 透射电子显微镜(transmission electron microscope,TEM)鉴定BMMSCs 外泌体形态结构 取20 μL 外泌体悬液滴于铜网上,在室温下孵育5 min,然后将铜网转至2.5%戊二醛中固定5 min,并用去离子水洗涤。在室温下用4%醋酸铀负染外泌体1 min,用PBS 洗涤网格3 次,风干5 min。在TEM 下观察获取图片。
1.2.6 BMMSCs 外泌体蛋白浓度提取及浓度测定 加等量RIPA 裂解液于两种方法提取的BMMSCs 外泌体中,置于冰上30 min,每隔4 min剧烈振荡30 s。30 min 后12 000×g4 ℃离心5 min,提取外泌体蛋白悬液,随后按BCA 试剂盒的操作步骤,测定外泌体蛋白的浓度。
1.2.7 Western blot 测定BMMSCs 外泌体表面标记物 本研究采用外泌体中常见的两种标志蛋白CD63 和CD81,对两种方法提取的BMMSCs外泌体进行Western blot 鉴定。将两种方法提取的BMMSCs 外泌体总蛋白按30 μg 定量并进行变性处理。变性后的蛋白样品按20 μL/孔上样,经SDS-PAGE 分离凝胶分离,然后转移至PVDF膜。用5%脱脂乳封闭膜1 h 后加入特异性一抗CD63(1∶1 000)、CD81(1∶1 000)孵育过夜。再用TBST 缓冲液洗涤3 次后,将膜与二抗在室温下孵育1 h。通过增强化学发光法曝光免疫反应条带。
1.2.8 纳米颗粒跟踪分析仪(nanoparticle tracking analysis,NTA)测定BMMSCs 外泌体颗粒浓度和粒径分布 将分离后的BMMSCs 外泌体按1∶100 比例重悬到1 mL 无菌水中,应用NTA 分析记录BMMSCs 外泌体的直径和大小分布。
1.3 统计学方法
采用SPSS 23.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,组间比较采用t检验,实验均重复3 次。P≤0.05 为差异有统计学意义。
2 结果
2.1 BMMSCs 的细胞形态观察
在倒置显微镜下,原代BMMSCs 大小不一,呈梭形贴壁生长,分布不均(图1A);3 代BMMSCs呈梭形、鱼排状旋涡排列,分布较均匀(图1B)。
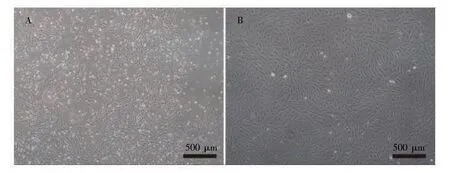
图1 BMMSCs 细胞形态(×40)
2.2 BMMSCs 流式细胞仪检测
流式细胞仪检测结果显示,BMMSCs 高表达多能干细胞标记物CD44 和CD90,而造血干细胞标记物CD34 和CD45 表达较低,见图2。
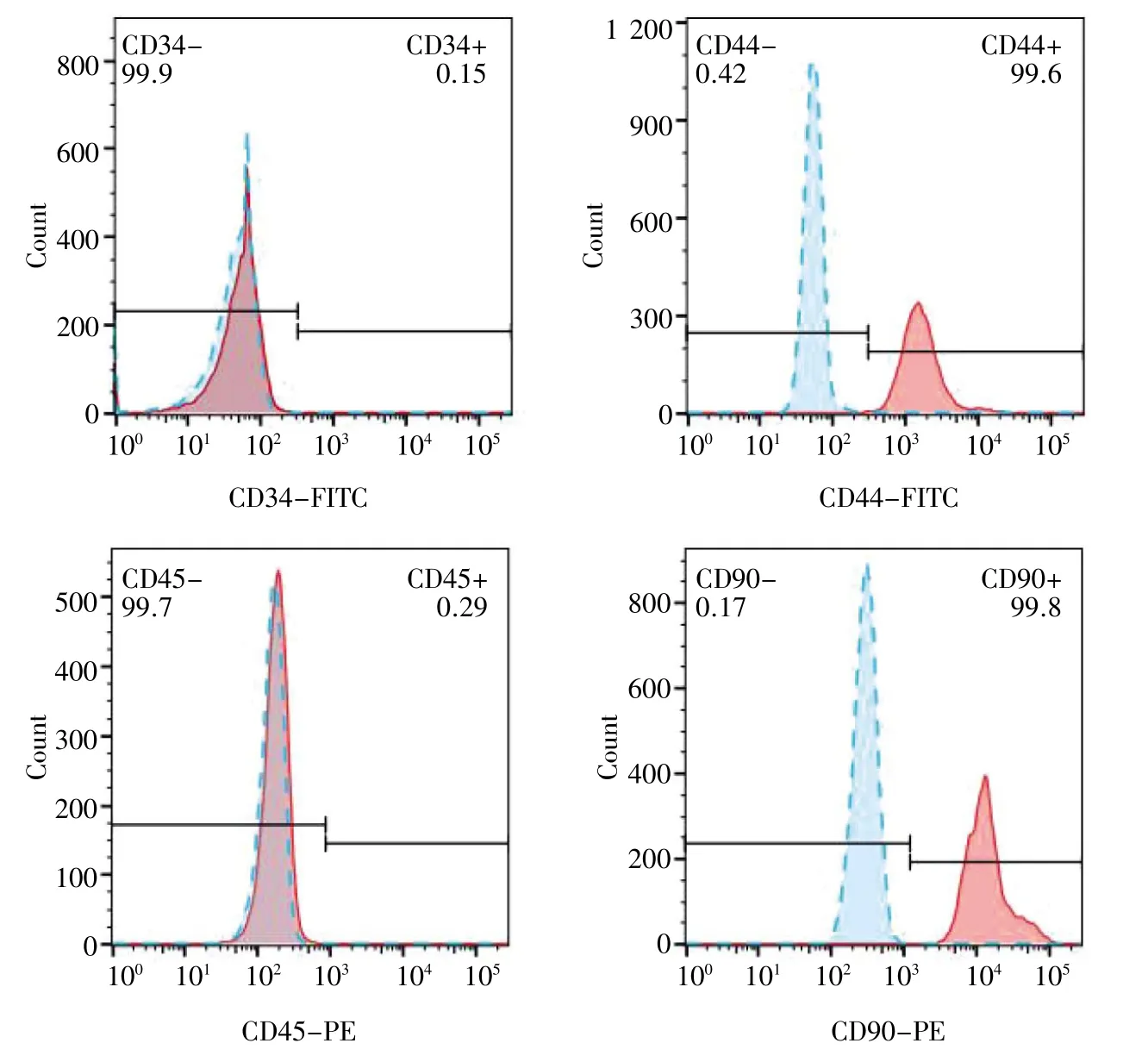
图2 BMMSCs 流式细胞仪检测
2.3 BMMSCs 分化能力检测
BMMSCs 经成骨分化培养基培养27 d 后,茜素红染色见大量矿盐沉积及钙化结节被染成棕色(图3A)。BMMSCs 经成脂分化培养基培养26 d后,经过红油O 染色可观察到细胞集落群中充满脂滴的脂肪细胞(图3B)。
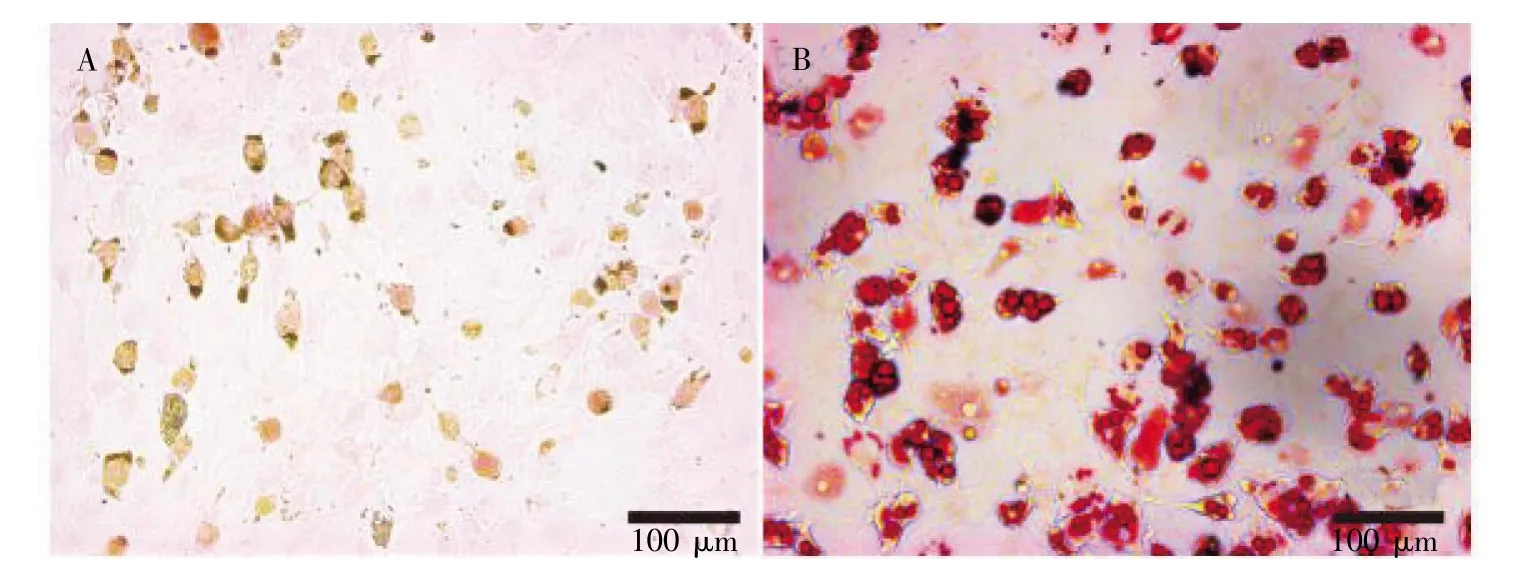
图3 3 代BMMSCs 定向诱导分化(×200)
2.4 TEM 检测外泌体的形态特征
TEM 镜下可见,两种方法均能获得具有双层膜、茶托样结构的外泌体,内部含有低电子密度物质,直径为30~150 nm。超速差速离心法提取的外泌体背景清晰,ExoQuick-TCTM法提取的外泌体背景杂乱,可见大量无立体结构特征的白色颗粒,见图4。镜下随机取5 个视野计数,超速差速离心法提取的外泌体数量高于ExoQuick-TCTM法(P<0.05),见表1。
表1 两种方法提取BMMSCs 外泌体的浓度比较( ±s)

表1 两种方法提取BMMSCs 外泌体的浓度比较( ±s)
与超速差速离心法相比*P<0.05。
方法 n 电镜下数量/个 蛋白浓度/(mg·mL-1)超速差速离心法 3 13.53±2.55 12.43±0.98 ExoQuick-TCTM 法 3 1.60±0.20* 4.30±0.48*
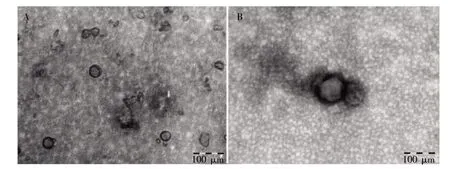
图4 TEM 下观察两种方法提取的BMMSCs 外泌体的形态特征(bar=100 nm)
2.5 BMMSCs 外泌体蛋白检测结果
根据蛋白标准曲线计算样品浓度。标准曲线为y=18.844x(x为样品吸光值,y为样品蛋白浓度),r2=0.999 5。超速差速离心法提取的外泌体的蛋白浓度高于ExoQuick-TCTM法(P<0.05),见表1。
2.6 Western blot 鉴定
Western blot 结果显示,超速差速离心法提取的外泌体高表达标志蛋白CD63 和CD81,结果与外泌体的生物学特性相符。ExoQuick-TCTM法提取的外泌体不表达标志蛋白CD63 和CD81,见图5。
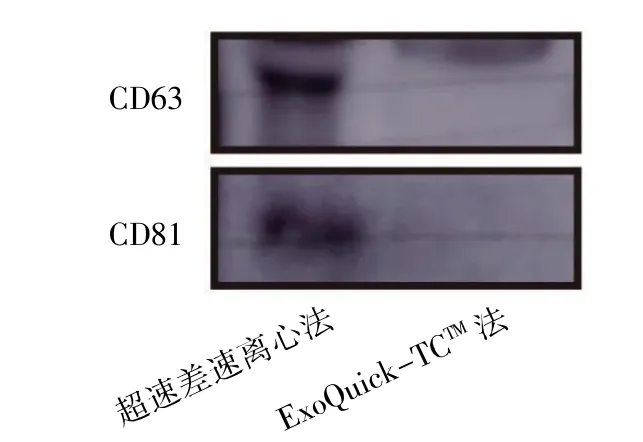
图5 Western blot 检测两种方法提取的BMMSCs 外泌体表面标记物
2.7 NTA 分析外泌体的颗粒浓度及粒径大小
NTA 分析超速差速离心法和ExoQuick-TCTM法所得外泌体颗粒浓度分别为(399.00±55.56)×108particles·mL-1和(7.94±0.50)×108particles·mL-1,均为单峰,峰值分别为(109.53±6.45)nm 和(139.27±1.45)nm,呈正态分布特征,见图6。两种方法提取的外泌体都符合外泌体的正常粒径大小。超速差速离心法提取的外泌体粒径较ExoQuick-TCTM法偏小,颗粒浓度较ExoQuick-TCTM法高(P均<0.05)。

图6 NTA 分析检测两方法提取的BMMSCs 外泌体
3 讨论
50 多年前,研究人员首次在小鼠骨髓中发现了成纤维细胞样的细胞(后被Arnold L. Caplan命名为MSCs),并证明其能够形成集落样结构,并分化为骨组织、软骨和脂肪[1,14]。随着研究深入,研究人员在机体不同的组织来源中发现MSCs,如脂肪组织、脐带、牙髓等[2]。由于MSCs 具有多向分化潜能,同时具有易获取、抗炎、可分泌营养因子等优点[15],且在临床中应用胚胎干细胞(embryonal stem cells,ESCs)不存在引起伦理问题和致癌风险。因此,MSCs 为再生医学研究带来了新的希望。BMMSCs 是较早发现并研究较为深入的一种MSCs[16]。为满足研究需求,本研究采用全骨髓贴壁细胞分离法分离培养原代大鼠BMMSCs[17-18],建立BMMSCs 的原代和传代培养方法,并进行鉴定。在本实验中,镜下形态学结果显示,原代分离的BMMSCs 细胞呈贴壁、集落趋化性生长,符合MSCs 的特性,流式细胞仪检测3 代BMMSCs 标志蛋白的表达,结果显示,BMMSCs 高表达多能干细胞标记物CD44、CD90,而低表达造血干细胞标记物CD34、CD45。此外,对MSCs 多向分化潜能进行鉴定,茜素红染色和油红O 染色结果表明,BMMSCs 具有向成骨细胞和成脂细胞分化的潜能。综上可知,本研究成功地建立了BMMSCs 原代分离和传代培养方法,为后续实验的顺利进行提供了保障。
虽然MSCs 免疫原性低,但静脉输注后绝大部分都归巢至肺[19],能成功迁移并定向分化修补受损组织的比例非常有限,而且细胞存活时间短,所以推测MSCs 主要通过旁分泌某种生物因子,从而发挥修复作用[17-19]。外泌体是由大多数细胞分泌的纳米级囊泡,直径为30~150 nm,其内包含microRNA、mRNA、膜蛋白和细胞内蛋白质[20],所以外泌体可通过表面抗原与靶细胞受体的相互作用或外泌体中RNA 和蛋白质向靶细胞的转运功能,从而在细胞间通讯中发挥作用[21-23]。研究[24]发现,外泌体表面分布着一些具有特殊功能的蛋白质和脂质,如抗原结合蛋白、细胞外信号调节激酶等。外泌体还可将其携带的生物分子运输到靶细胞,进而触发相关生物因子的释放,维持机体内正常生理功能。因此,外泌体为许多疾病的治疗提供了新的可能性[25]。研究[10]证明,MSCs 来源的外泌体可发挥MSCs 相似的功能,且与MSCs 相比,MSCs 外泌体具有稳定性好、易量化和保存、能通过血脑屏障等优点。如何根据实验所需选择有效的外泌体提取方法是进行深入研究的基础。本研究收集BMMSCs 培养上清液,采用超速差速离心与ExoQuick-TCTM两种方法提取外泌体。超速差速离心法主要是利用细胞分泌囊泡的沉降率不同,梯度离心,分别去除残留细胞和细胞碎片,并经0.22 μm 滤筛纯化,进一步去除上清液中的微生物及大囊泡,再超速离心提取外泌体。ExoQuick-TCTM法主要是加入一种聚合物,该聚合物具有网状结构,可将上清液中一定直径的囊泡捕获,从而提取外泌体。本研究结果表明,超速差速离心法和ExoQuick-TCTM法均可成功提取出一定量的BMMSCs 外泌体。但两种提取方法相比,超速差速离心法提取的BMMSCs外泌体颗粒数量更多、浓度及纯度更高。TEM 及NTA 检测分析表明,ExoQuick-TCTM法提取的外泌体粒径较超速差速离心法提取的外泌体粒径大,可能因ExoQuick-TCTM法加入的聚合物与外泌体结合形成复合物,致其粒径增大。采用外泌体中常见的两种标志蛋白CD63 和CD81 对两种方法提取的BMMSCs 外泌体进行Western blot检测[12,26-28],结果表明,ExoQuick-TCTM法提取的外泌体不表达标志蛋白CD63 及CD81。其原因可能为:1)虽然BCA 测得的ExoQuick-TCTM法提取的外泌体蛋白浓度为(4.30±0.48)mg·mL-1,但其纯度较低,正如TEM 镜下所见,ExoQuick-TCTM法提取的外泌体存在大量无立体结构的白色颗粒,考虑为细胞碎片或其他囊泡等杂质;2)Exo-Quick-TCTM法提取外泌体时加入的聚合物包裹在外泌体外部,且此聚合物较难去除,可能会影响外泌体的表征的鉴定。
综上所述,超速差速离心法提取的BMMSCs外泌体,虽然程序繁杂、用时长,但在提取过程中无须额外添加化学物质,不存在潜在未知的杂质污染等因素影响外泌体质量的不稳定,而且相较于ExoQuick-TCTM提取法,超速差速离心法提取的外泌体含量和纯度相对较高、成本较低,在实际研究中更具有可重复性,可作为一种合理的分离方法。

