两性霉素B制剂细胞毒性测定法
毛文学 余音 李欣钰 余丹丹
(上海研诺医药科技有限公司 上海 201114)
两性霉素B(AmB)是一种多烯类广谱抗真菌抗生素,是治疗敏感深部真菌感染的首选药物之一[1-3],但AmB 的作用机制决定了其在破坏真菌细胞的同时也会导致人体正常细胞损伤,影响细胞膜的运输,长期使用还会造成肾损伤及循环系统的损伤,表现出蛋白尿、氮质血症、低血钾、贫血等症状[4]。Kagan 等[5]在研究AmB制剂时以酵母细胞为模型,通过酵母的存活率和细胞内K+浓度来评价AmB 制剂及AmB-阿拉伯半乳聚糖共轭物(AmB-arabinogalactan conjugate,AmB-AGC) 联合用药的毒性变化。Gruda 等[6]以红细胞中K+的保留量为指标,证明蔗糖单月桂酸酯能够在不降低AmB 抑制真菌能力的同时消除其对红细胞的毒性。de Araújo 等[7]的研究表明AmB 胶束对红细胞的毒性与K+的泄漏呈浓度依赖性。
国内外诸多围绕AmB 剂型改良、联合用药及拓展应用的研究都以其毒性为重要评价指标[8-10],利用AmB增加细胞膜通透性导致单价阳离子泄漏的特点,以泄漏的K+含量表征AmB 制剂毒性。在其他相关研究中,K+含量的测定多使用火焰光度计、原子吸收分光光度计、电解质分析仪及生化分析仪等设备[7,11-12]。实验结果的精确度会受设备及样本处理方法等因素的影响,如火焰光度计无法测出元素的绝对浓度值,而生化分析仪由于样本处理中使用肝素抗凝剂,会影响静脉血清K+测定,导致测得的K+含量偏高。本研究选择红细胞为载体,以HPLC 法对红细胞渗漏的K+浓度进行检测,建立了一套针对AmB 制剂的毒性评价方法。此方法能够准确高效地评价工艺及处方对细胞毒性的影响,为AmB 制剂的研究应用拓宽了道路。
1 材料和方法
1.1 材料与试剂
10%大鼠红细胞(批号:BC20200809、BC20200813、BC20200818,南京生航生物技术有限公司;批号:20200811、20200814、20200823,南京森贝伽生物科技有限公司);AmB 原料药[梯希爱(上海)化成工业发展有限公司]、AmB 脂质体冻干制剂(自制);其余化学制剂均为市售分析纯。
1.2 仪器
E2695 高效液相色谱仪(Wasters 公司,带检测器2424 ELS Detector);XS205 型分析天平(Mettler Toledo公司);MX-RD-Pro 型旋转混匀仪[大龙兴创实验仪器(北京)股份公司];GNP-9050 型恒温箱(上海精其仪器有限公司);TGL-16.5M 型离心机(上海卢湘仪离心机仪器有限公司)。
1.3 溶液配制
1)PBS 溶液 配制含147 mmol/L 氯化钠、3 mmol/L氯化钾、10 mmol/L 磷酸氢二钠的PBS 溶液,以1 mol/L HCl 调节pH 至7.4±0.1 保存备用[9]。
2)阳性对照液 准确称取AmB 原料药50 mg、脱氧胆酸钠41 mg、磷酸钠 20.2 mg,加入纯化水10 mL溶解,得5 mg/mL AmB 脱氧胆酸盐溶液,以PBS 稀释至1 mg/mL。
3)供试品溶液 取AmB 脂质体冻干制剂1 支(每支含AmB 50 mg),加入纯化水10 mL 复溶,得约5 mg/mL AmB 脂质体溶液,以PBS 分别稀释至1 mg/mL、500 和250 μg/mL。
4)阴性对照液 PBS 溶液。
1.4 红细胞预处理及样品孵化
1)红细胞洗涤浓缩 取市售10%大鼠红细胞45 mL,用PBS 溶液离心洗涤(500 g,10 min,4 ℃)4 次至上清澄清后加入PBS 溶液分散并定容至10 mL,得45%大鼠红细胞悬液。
2)红细胞孵化 取45%大鼠红细胞450 μL 于1.5 mL 离心管内,分别加入阳性对照、供试品或阴性对照50 μL,混匀。将离心管固定于旋转混匀仪上,于37 ℃恒温箱内以12 r/min 水平旋转孵化。于取样时间点取出样品,离心(1 000 g,10 min,4 ℃)后取200 μL 上清液于液相进样小瓶中,加超纯水800 μL,混匀得稀释5倍的供试品溶液,按HPLC 条件进行分析。
1.5 HPLC 钾离子含量检测色谱条件
采用Waters XBridge Hilic 色谱柱(4.6 mm×250 mm,5 μm);流动相为0.1 mol/L 乙酸铵- 乙腈=15 ∶85;流速1 mL/min;进样量10 μL;载气206.84 kPa;漂移管温度80 ℃;运行时间20 min。
2 结果
2.1 K+释放与红细胞孵育时间关系考察
阴性对照的K+释放浓度未随孵育时间而增加,表明本研究采用的孵化条件对大鼠红细胞细胞膜通透性无显著影响,不会造成K+额外渗漏。作为阳性对照的1 mg/mL AmB 脱氧胆酸盐溶液于孵育后0.5 h 内快速释放K+并于1 h 时达平台浓度。相较于阳性对照,不同浓度的AmB 脂质体对大鼠红细胞的急性毒性显著减小,且K+释放呈时间与浓度依赖性,并于4 h 时达到最大K+释放浓度(图1)。为保证实验结果准确性,后续研究中将4 h 作为考察AmB 制剂细胞毒性的孵育时间。
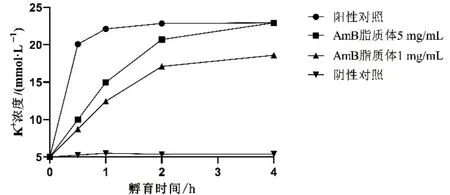
图1 孵育时间对大鼠红细胞K+释放的影响
2.2 大鼠红细胞K+释放重复性考察
为考察方法重复性,分别使用了阳性对照液、不同浓度AmB 脂质体溶液及阴性对照液按前述方法进行实验,并检测红细胞K+释放浓度,实验结果显示,经过4 h 孵育,阳性对照组红细胞K+释放浓度最高,AmB 脂质体引起的红细胞K+释放浓度随AmB 浓度的降低而降低,表明大鼠红细胞K+释放浓度与供试品溶液中AmB浓度正相关(表1)。同组平行孵育的4 管样品除AmB脂质体250 μg/mL 组RSD 大于5%外,其余各组RSD均小于4%(表1),样品组内平行性好,证明本方法重复性良好,能够满足考察AmB 及其制剂细胞毒性评价的要求。

表1 孵育4 h后不同浓度AmB脂质体溶液对K+释放的影响(n=4)
2.3 大鼠红细胞K+释放批间差异考察
为研究大鼠红细胞质量对实验结果的干扰程度,我们分别对两个公司各3 批市售10%大鼠红细胞进行了对比研究。实验结果显示,购自南京生航的3 批大鼠红细胞在分别给予阳性对照液和阴性对照液4 h 后K+释放浓度稳定,批间差异小,仅1 mg/mL AmB 脂质体溶液孵育的红细胞样品表现出了较大批间差异(表2);南京森贝伽3 批大鼠红细胞K+释放浓度均表现出较大批间差异,其中批次3 的AmB 脂质体溶液组K+释放浓度显著高于同组其余2 批红细胞且高于阳性对照组,导致批间RSD达26.69%;同时,批次3 阳性对照组K+释放浓度低于同组另2 个批次(表3)。综合对比南京森贝伽各组别实验结果,提示批次3 大鼠红细胞质量可能是导致出现不符合不同AmB 制剂间细胞毒性规律结果的原因。

表2 南京生航3批次大鼠红细胞孵化4 h后K+释放浓度

表3 南京森贝伽3批次大鼠红细胞孵化4 h后K+释放浓度
2.4 红细胞储存时间与细胞毒性变化考察
对于细胞水平的体外毒性研究而言,除了细胞来源与批次之间的差异,细胞在储存过程中的变化对于实验结果的准确性也会产生一定影响。因此,对同一厂商的3 批大鼠红细胞分别在入库当日于2 ~8 ℃保存7 d 后,与AmB 脱氧胆酸盐溶液(1 mg/mL)孵育进行对比。3批次红细胞在入库当日(0 day)K+释放浓度无显著差异,保存7 d 后3 批次红细胞K+释放量均有不同程度的下降(图2)。根据实验结果推测,部分红细胞在储存过程中失活皱缩,且市售红细胞的保存液不能完全阻止其缓慢释放K+,致使部分K+在洗涤浓缩过程中被去除,从而导致红细胞内K+浓度随储存时间延长而下降。这可能是保存7 d 后大鼠红细胞K+释放浓 度整体降低的原因。

图2 大鼠红细胞实验前保存时间对K+释放的影响
3 讨论
实验结果表明,本研究建立的方法可以精确测定出不同剂型、不同浓度、不同孵育时间红细胞释放的K+含量,并且不受其他杂质离子的干扰。相较于使用实验动物为模型的毒性半数致死剂量实验、细胞毒性实验的MTT 法、细胞毒性克隆实验等传统毒性评价手段[13],本方法不需要流式细胞仪和荧光标记物等特殊仪器设备及耗材,具有成本低、周期短、易操作、对实验环境要求低等特点。同时,红细胞作为血液中占比高达40%~45%的细胞,来源广泛,易于获取;其具有完整的细胞膜结构,且细胞内含有高浓度的K+,结合HPLC 检测,实验结果精确度高,更适合作为制剂处方、工艺变更的快速安全评价方法。
值得注意的是,细胞作为一种活体评价载体,会因种属来源、采集方式、储存及运输等不同因素而造成细胞生理活性上的差异。因此,为保证实验结果的准确性,应在实验中适当增加空白样、平行样或对照样。还应严格控制红细胞从采集到使用的各中间环节,包括避免长时间远距离运输、将红细胞于2 ~8 ℃低温保存但不可冻融、运输及使用过程中避免剧烈震荡引发的溶血、保持无菌状态并在开封后尽快使用完毕等注意事项。如有条件,宜从可靠的动物中心采购固定种属的大鼠或采用固定来源的现制红细胞,即于实验当日在无菌条件下采血提取红细胞进行药物细胞毒性实验,以消除种属间差异及运输储存条件对实验结果的干扰。
综上所述,本方法不仅可以用于AmB 原料药和脂质体注射剂细胞毒性的快速测定,根据其实验原理还能应用于其他AmB 剂型和能够导致K+泄漏的药物及其制剂的研究中,是一种具有良好前景的药物细胞毒性评价方法。

