从腹泻实验兔分离的一株大肠埃希菌的生物学特性研究
董 浩 刘志国 李 楠 邢 进 许中衎 邢壮壮 冯育芳 马丽颖
(中国食品药品检定研究院 国家啮齿类实验动物资源库,北京 102629)
大肠埃希菌是兔肠道内的常见菌,在正常情况下并不会引起动物的发病,但是在饲养管理不善或气候环境突变等应激因素的作用下,常会导致兔的肠道菌群紊乱,机体抵抗力降低而引发大肠埃希菌病。发病兔排出的大肠埃希菌污染了饲料、饮水和环境等,又经消化道等途径感染同群健康兔,严重时可以造成大批死亡。各种年龄和性别的兔均有易感性,尤其是仔兔和幼兔最易感,发病率、死亡率都较高。
目前,在临床上兔大肠埃希菌病的报道较多,尤其是大肠埃希菌与球虫共感染的情况比较常见[1-3],但是屏障设施内饲养的SPF级实验兔感染大肠埃希菌的报道却并不多见。在前期研究中,对本单位屏障设施内饲养的发生腹泻的SPF级实验兔进行剖检,从病变脏器中分离到了一株大肠埃希菌[4]。鉴于大肠埃希菌是引起兔腹泻的病原菌之一,因此对该细菌的生化特性、遗传谱系、毒力基因、消毒液敏感性、抗生素敏感性、以及细菌携带的耐药基因进行较为全面的研究,为屏障设施内有效预防实验兔的大肠埃希菌感染提供数据支持。
1 材料和方法
1.1 材料
1.1.1试剂与耗材:新洁尔灭消毒液(山东安捷高科消毒科技有限公司),消毒液原液的苯扎溴铵含量为2.7%~3.3 %(W/V);健之素消毒泡腾片(北京长江脉医药科技有限责任公司),有效氯含量为(35±3.5)%;百毒杀消毒液(癸甲溴铵溶液)(上海派斯德生化有限公司),规格为100 mL:10 g;百胜-30(碘酸混合溶液3.0 %)由Evans生产厂生产,成分为醇乙氧基化物20%~25%,硫酸5%~10%,磷酸5%~10%,碘1%~3%;75 %乙醇(北京鸿志伟达工贸有限公司)。胰酪大豆胨液体培养基(Trypticase Soy Broth)、D/E中和肉汤培养基和吐温80(青岛高科技工业园海博生物技术有限公司)。药敏纸片(杭州微生物试剂有限公司)。2×Taq PCR StarMix(北京康润诚业生物科技有限公司);DNA marker DL2000(大连宝生物公司)。大肠埃希菌耐药基因和毒力基因的扩增引物由生工生物工程(上海)股份有限公司合成。
1.1.2菌株:大肠埃希菌(ILAREc-01)分离自中国食品药品检定研究院动物实验室饲养的一只腹泻的SPF级实验兔。
1.1.3主要仪器:生物安全柜(Nuaire公司);恒温培养箱(Thermo公司);全自动细菌鉴定仪(BD公司);Veriti 96孔PCR仪(Applied Biosystems公司);电泳仪和凝胶成像仪(伯乐公司)。
1.2 方法
1.2.1细菌的生化鉴定:将冻存的ILAREc-01菌株在TSA培养基上划线复苏,使用全自动细菌鉴定仪进行细菌各项生化指标的鉴定。
1.2.2细菌的遗传谱系分析:根据文献[5]报道的Clermont四重PCR方法对分离到的ILAREc-01菌株进行遗传谱系分析。根据文献[5]进行引物合成,以灭活的ILAREc-01菌液为模板,进行PCR扩增。PCR反应程序为:预变性94 ℃ 4 min;变性94 ℃ 5 s, 退火59 ℃ 20 s, 延伸72 ℃ 30 s,30个循环;延伸72 ℃ 5 min。PCR产物使用1 %的琼脂糖凝胶进行电泳分析。
1.2.3消毒剂敏感性分析
1.2.3.1消毒剂的配置:百毒杀消毒液:将百毒杀原液进行600倍稀释;健之素消毒液:1片健之素泡腾片(250 mg)加入500 mL蒸馏水中混匀;新洁尔灭消毒液:按照使用说明将新洁尔灭消毒液原液与蒸馏水按照1∶4的比例混合;75%乙醇:直接使用产品原液;百盛-30消毒液:使用蒸馏水将百盛-30原液进行1 000倍稀释。
1.2.3.2悬液定量杀菌实验:参考《消毒剂实验室杀菌效果检验方法》(GB/T 38502—2020),略有改动。取0.3 mL的大肠埃希菌ILAREc-01细菌悬液分别加入1.2 mL的百毒杀消毒液、健之素消毒液、新洁尔灭消毒液、75 %乙醇和百盛-30消毒液中,混匀后室温孵育1.5、5 和10 min。随后,分别取出0.5 mL的上述混合液加入4.5 mL D/E中和肉汤培养基,并进行充分混匀。室温放置10 min后,进行细菌涂板,16~24 h培养后计数。上述实验进行3次重复。
1.2.4药物敏感性分析:参照卫生行业标准《抗菌药物敏感性试验的技术要求》(WS/T 639—2018)的要求,将ILAREc-01菌液浓度调整至1×108CFU/mL,均匀涂布与MH固体培养基上,依次贴药敏纸片,37 ℃培养18 h后测量抑菌环的直径。结果判定按照杭州微生物试剂有限公司官网提供的药敏实验纸片法的抑菌范围解释标准执行。
1.2.5耐药基因和毒力基因的PCR检测:根据相关参考文献[6-7],分别合成了耐药基因和毒力基因的扩增引物。其中,耐药基因的检测包括耐受氨基糖苷类抗生素基因aacC2、aph(3’)-Ia、aadA1和aadB;耐受β-内酰胺类抗生素基因blaTEM、blaSHV和blaCTX-M;耐受四环素类抗生素基因tetA、tetB和tetC;耐受喹诺酮类抗生素基因qnrA、oqxAB、aac(6’)-Ib和gyrA;耐受磺胺类抗生素基因sul1、sul2和sul3。毒力基因包括产肠毒素大肠埃希菌黏附素K88、K99、F41和987P基因,肠致病性大肠埃希菌的毒力基因eaeA和bfpA,肠出血性大肠埃希菌的特征性毒力因子基因stX1和stX2。PCR扩增体系为:模板2 μL,PCR mix 25 μL,上下游引物各0.5 μL,加入双蒸水补齐50 μL体系。PCR反应程序为:预变性94 ℃ 5 min;变性94 ℃ 30 s, 退火54 ℃ 30 s, 延伸72 ℃ 45 s,30个循环;延伸72 ℃ 10 min。PCR产物使用1 %的琼脂糖凝胶进行电泳分析。
2 结果
2.1 分离细菌的生化鉴定
采用BD公司的全自动细菌鉴定仪进行大肠埃希菌ILAREc-01的生化特性鉴定,全自动细菌鉴定仪共进行了16 h的检测,实验结果如表1所示。
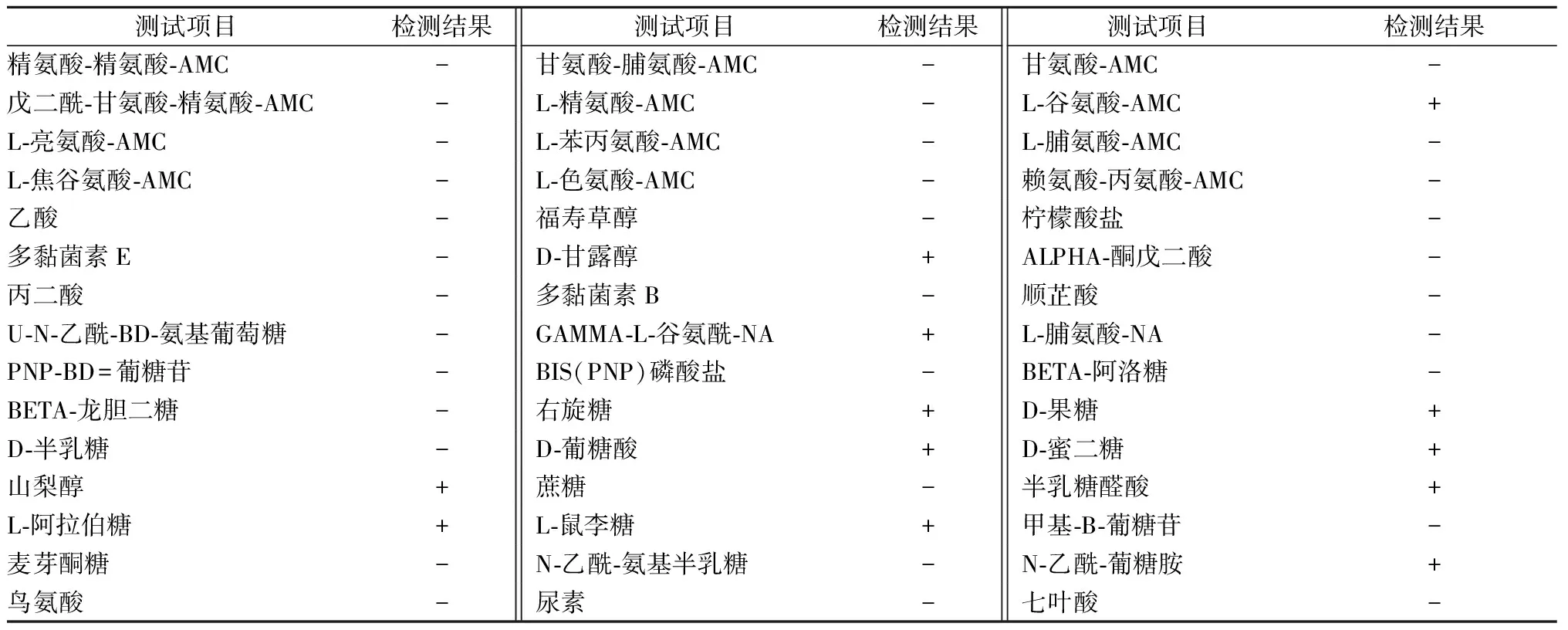
表1 大肠埃希菌ILAREc-01的生化鉴定结果
2.2 细菌的遗传谱系分析
基于Clermont四重PCR方法对ILAREc-01菌株进行遗传谱系分析,PCR扩增结果如图1所示,未扩增出chuA和yjaA基因的目的条带,而扩增获得TspE4.C2和arpA基因相应大小的PCR产物。上述结果表明,ILAREc-01属于大肠埃希菌的B1型遗传谱系。
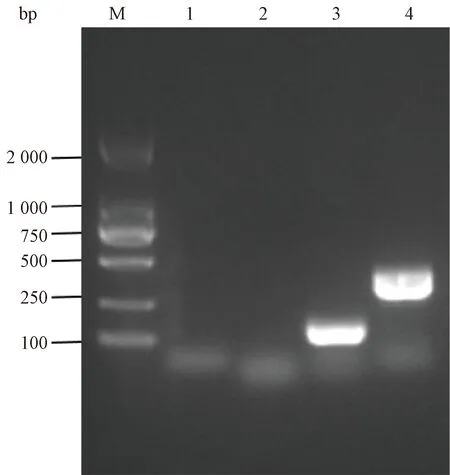
注:M.DL2000 Marker;1.chuA基因的PCR扩增结果;2.yjaA 基因的PCR扩增结果;3.TspE4.C2基因的PCR扩增结果;4.arpA基因的PCR扩增结果
2.3 毒力基因的PCR扩增结果
对产肠毒素大肠埃希菌黏附素K88、K99、F41和987P基因,肠致病性大肠埃希菌的毒力基因eaeA和bfpA,肠出血性大肠埃希菌的特征性毒力因子基因stX1和stX2进行PCR扩增的结果如图2所示,在ILAREc-01菌株中只扩增到了eaeA基因,而其他毒力基因的扩增结果均为阴性。由于eaeA基因是肠致病性大肠埃希菌的标志性毒力基因,因此,ILAREc-01菌株是一株肠致病性大肠埃希菌。
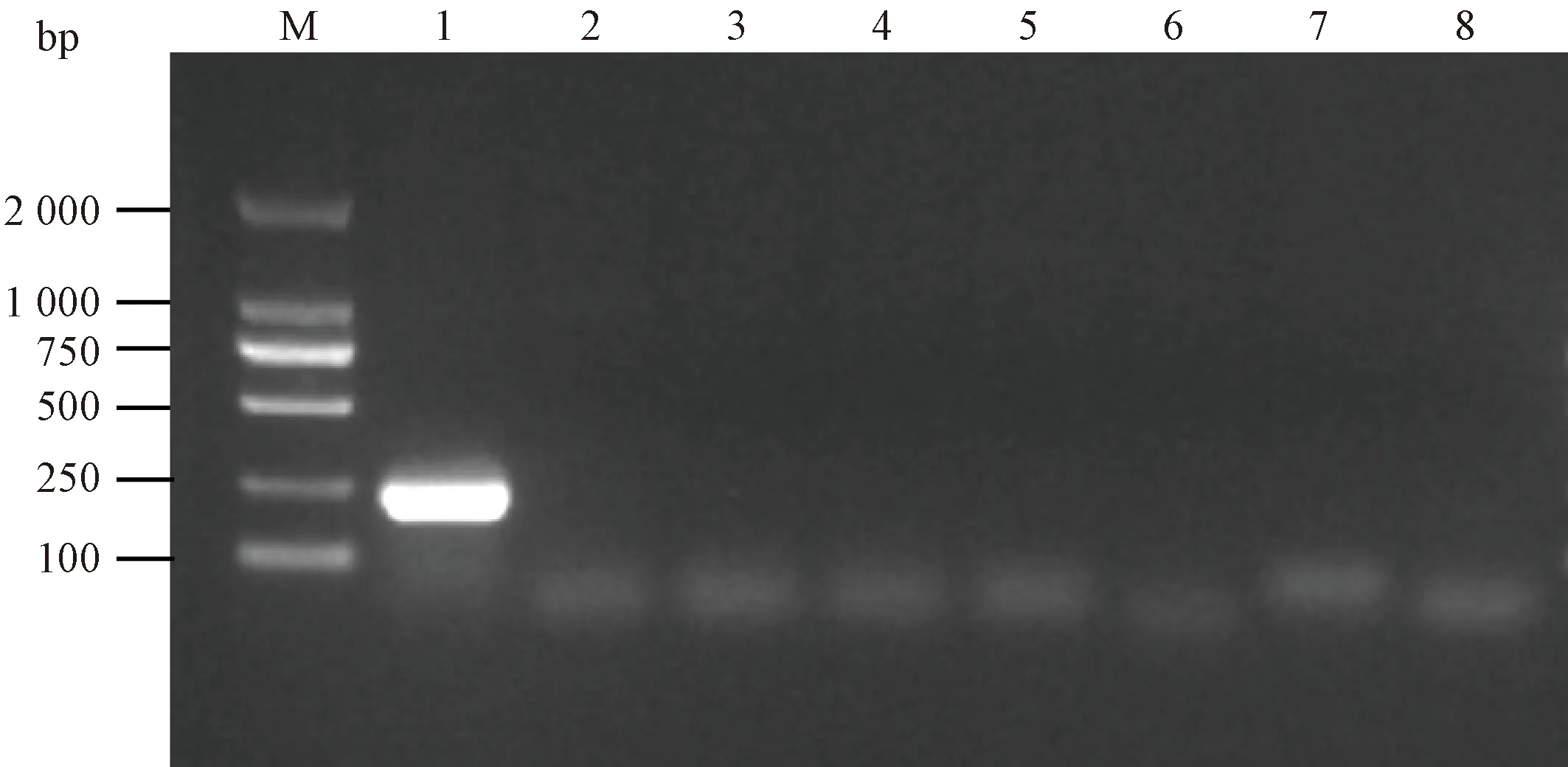
注:M.DNA maker DL2000; 1~8.eaeA基因、bfpA基因、stX1基因、stX2基因、黏附素K88、K99、F41和987P基因的扩增结果
2.4 不同消毒液对大肠埃希菌的消毒效果
为了检测不同消毒液对引起家兔腹泻的大肠埃希菌的杀灭效果,将大肠埃希菌从单菌落接种至TSB培养基37 ℃培养12 h后稀释至1×109CFU/mL,测试5种消毒液在室温下对大肠埃希菌的杀菌效果。5种消毒液在作用1.5、5 和10 min后,取200 μL涂板,经过16~24 h培养后培养基上没有任何菌落生长,此时细菌的浓度小于5 CFU/mL,这5种消毒液的杀灭效果均符合《消毒剂实验室杀菌效果检验方法》(GB/T 38502—2020)的要求,说明5种消毒液对该大肠埃希菌的杀灭效果均比较理想。
2.5 药物敏感性实验结果
药敏实验的结果按照杭州微生物试剂有限公司官网提供的药敏实验纸片法的抑菌范围解释标准判定如下:ILAREc-01菌株对于青霉素、氨苄西林、头孢氨苄、头孢拉定、四环素、多西环素、米诺霉素、红霉素、麦迪霉素、万古霉素、复方新诺明等11种抗生素耐药(R),对哌拉西林、头孢唑啉、头孢呋辛、头孢他啶、头孢曲松、头孢哌酮、丁胺卡那、庆大霉素、氧氟沙星等9种抗生素敏感(S)(表2)。
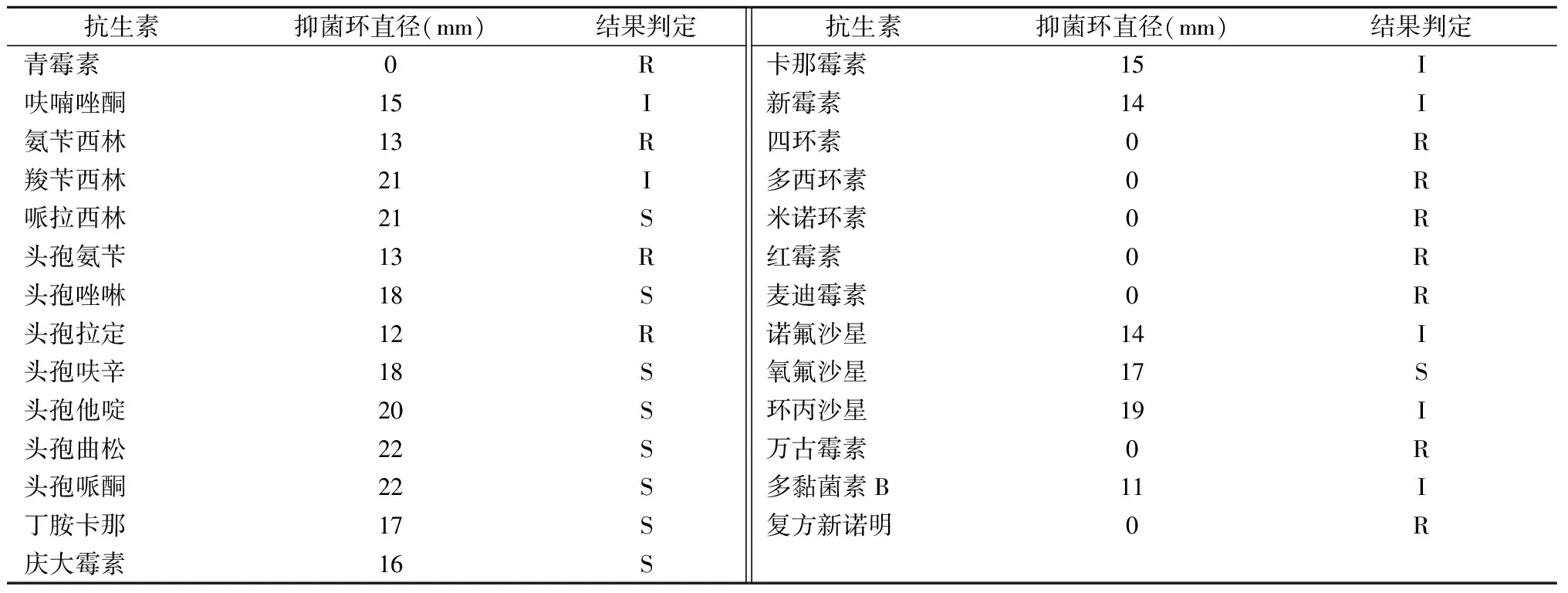
表2 大肠埃希菌ILAREc-01的药物敏感性实验结果
2.6 耐药基因的PCR扩增结果
对17种抗生素耐药基因的PCR扩增结果如图3所示,白色箭头从左向右依次指示了ILAREc-01中耐受氨基糖苷类抗生素基因aadA1,耐受喹诺酮类抗生素基因gyrA,耐受磺胺类抗生素基因sul1和耐受四环素类抗生素基因tetA等4个耐药基因的PCR阳性产物的电泳结果。第1泳道的aacC2基因的PCR扩增产物略大于目的片段(697 bp)长度,经过测序分析为非特异性扩增产物。其他11个耐药基因均未扩增出目的片段大小的产物。

注:1~17:aacC2、aph(3′)-Ia、aadA1、aadB、blaTEM、blaSHV、blaCTX-M、qnrA、oqxAB、acc(6)-Ib、gyrA、sul1、sul2、sul3、tetA、tetB、tetC基因的扩增结果; M:DL2000 Marker
3 讨论
兔的大肠埃希菌病是危害家兔养殖业的主要传染病之一[8],研究表明,在自然感染病例中该病的发病率为50%~68%,病死率可以达到50%~92.3%[9]。兔大肠杆菌病的主要临床症状主要表现有腹泻型、败血型和混合型3种。病程短的在1~2 d内死亡,长的经7~8 d死亡。急性发病的病例突然死亡而不显示任何症状。患病兔会出现精神沉郁、被毛粗乱、脱水、消瘦、腹胀、剧烈腹泻、肛门和后肢被毛常沾有大量黏液或水样粪便,有时会排除两头尖的干粪球,最终往往因衰竭而死亡[10]。在本研究中,SPF级实验兔发病后也出现了精神沉郁、食欲和饮水明显下降、脱水、消瘦和排出水样粪便等临床症状,未经过及时治疗的实验兔发生腹泻后72 h内以死亡转归。经过对腹泻死亡实验兔进行剖检,从病变脏器中分离到了一株大肠埃希菌(ILAREc-01)。经过大肠埃希菌毒力因子鉴定,发现ILAREc-01中含有eaeA基因,表明其属于肠致病性大肠埃希菌,而这一类大肠埃希菌是引起兔大肠杆菌病的主要病原体。
在同一个环境内长期使用一种消毒剂,会使细菌产生耐药性,导致消毒效果下降[11],在临床养殖环节和食品生产加工环节都有耐受不同类型消毒剂的大肠埃希菌的相关报道[12-13]。为了测定ILAREc-01菌株是否对设施中常用的几种消毒剂具有耐受性,本实验参考《消毒剂实验室杀菌效果检验方法》(GB/T 38502—2020)进行了杀菌效果的测试,结果表明新洁尔灭、百毒杀、健之素泡腾片、百胜-30和75%乙醇均可以有效杀灭大肠埃希菌ILAREc-01。使用上述消毒剂加强设施环境的消毒,可以有效切断ILAREc-01菌株的传播,保护易感动物。
由于抗生素滥用,使得临床上分离到的致病性大肠埃希菌常具有多重耐药性。有研究[14]从肉鸡舍中分离到的大肠埃希菌对林可霉素、青霉素、卡那霉素、磺胺异噁唑的耐药性较高。有研究[15]对一株引起仔猪腹泻的大肠埃希菌进行耐药性分析,发现其对四环素和环丙沙星具有耐药性。有研究[16]对某奶牛场引起犊牛腹泻的大肠埃希菌进行研究发现,其对阿莫西林、红霉素、四环素、青霉素、利福平、林可霉素、头孢噻呋具有耐药性。在本研究中,通过药敏实验发现,ILAREc-01菌株对9种抗生素敏感,对多达11种抗生素耐药。
针对ILAREc-01菌株耐药基因检测结果表明,该菌株携带了耐受氨基糖苷类抗生素基因aadA1,耐受四环素类抗生素基因tetA,耐受喹诺酮类抗生素基因gyrA和耐受磺胺类抗生素基因sul1,上述结果与该菌株对于部分四环素类抗生素(四环素、多西环素和米诺环素)和磺胺类抗生素(复方新诺明)耐药存在一定关联。有研究[17]对28株河南省分离的兔源大肠埃希菌氨基糖苷类、四环素类和磺胺类耐药基因检测结果也发现,tetA基因的阳性率为85.71%,sul1基因的检出率为100%。有研究[8]对兔源大肠埃希菌、喹诺酮药物耐药性及质粒介导的耐药基因进行了检测,发现acc(6)-Ib基因检出率最高为80.4%,qnrD、qnrS、oqxA和oqxB检出率分别为59.8%、59.8%、63.9%和51.5%,未检出qnrA、qnrB、qnrC、qnrVC和qepA,但是该研究未进行喹诺酮类抗生素耐药基因gyrA的检测。有研究[18]对15株水貂源致病性大肠埃希菌的喹诺酮类药物耐药基因检测表明,耐药基因gyrA、gyrB、qnrA和pare检出率高达为100%。有研究[19]对216株禽致病性大肠埃希菌的氨基糖苷类耐药基因的分子流行病学检测表明,aadA1基因的阳性率高达49.1%。由此可见,在本研究中ILAREc-01菌株检测出的4个耐药基因,在临床上分离的致病性大肠埃希菌中分布也是十分普遍的。
考虑到本研究中分离的大肠埃希菌为一株B1型遗传谱系的肠致病性大肠埃希菌且具有多重耐药性,因此进行了菌株的初步溯源分析。使用PCR方法对18份采自SPF兔生产群的新鲜粪便样品进行了eaeA基因检测,结果均为阴性(该数据未展示)。由此分析该肠致病性大肠埃希菌并非来自SPF兔的生产群,而有可能是由实验人员或其携带物品带入动物实验室屏障设施。

