扩张型心肌病动物模型的建立与评估
张 冬 朱瑾彦 张 敏 李 彬
(1.首都医科大学附属北京积水潭医院,胸外科 北京 100037)(2.中国医学科学院,北京协和医学院,国家心血管病中心,阜外医院,心血管疾病国家重点实验室,心血管植入材料临床前评价北京市重点实验室,动物实验中心,北京 100037)
扩张型心肌病(dilated cardiomyopathy, DCM),是指以单侧或双侧心腔扩大、心肌收缩期功能减退、伴或不伴有充血性心力衰竭为主要特征的心肌病[1]。在我国发病率为13/10万~84/10万不等。迄今为止,病因不明[2-4]。其明显的病理改变主要以心腔扩张为主,可见室壁变薄,心肌纤维化加重并伴有癜痕形成。病理组织学表现为:心肌细胞的非特异性肥大、变性,特别是程度不同的纤维化等病变混合存在[5-7]。
本病的病程长短不等,可表现为充血性心力衰竭,以往认为症状出现后5年的存活率只有40%左右[8]。因为DCM病因不明,预后较差,且目前除心脏移植,并无特异、有效的治疗方法,故临床上对于DCM的研究必要而迫切。为深入研究DCM的发生发展特点,建立相关实验动物模型是一种十分有效的手段。为此,旨在探索建立DCM的犬动物实验模型,并对其模型的有效性及稳定性予以评估。
1 材料和方法
1.1 材料
1.1.1实验动物及分组:实验动物采用成年比格犬10只(雌雄不限,体质量10~20 kg), 购于北京金牧阳实验动物养殖有限责任公司, 生产许可证号【SCXK(京)2015-0005】,饲养于中国医学科学院阜外医院动物实验中心,使用许可证号【SYXK(京)2017-0015】。实验室温度20~25 ℃,相对湿度50%~70%,换气次数每小时8~10次,采用12 h/12 h昼夜间断照明。实验动物耳标编号,自由摄食、饮水,实验方案通过阜外医院实验动物福利与伦理委员会审查,伦理审批号:0092-3-20-ZR(X)。
实验动物分组:正常对照组(CTL组):4只;扩张型心肌病模型组(DCM组):6只。
1.1.2主要仪器设备:麻醉机(ACM619,北京航天长峰股份有限公司医疗器械分公司)、心电监护仪(MP50)、彩色多普勒超声心动仪(IE33)(飞利浦公司)、ACT测量仪及耗材(ACTⅡ,HEMOCHRON)、24 h动态心电图机(Reveal XT 9529)、植入式心电事件监测器(ICM)(LNQ11,美敦力)、心脏电生理刺激仪(DF-5A,苏州东方电子仪器厂)。
1.1.3实验试剂:异氟烷(山东科源制药有限公司)、丙泊酚中/长链脂肪注射液(北京贾森尤斯卡比医药有限公司)、盐酸利多卡因注射液(中国大冢制药有限公司)、地高辛(江苏恒瑞医药股份有限公司)、呋塞米(常州千红生化制药股份有眼公司)、注射用头孢氨苄(华北制药股份有限公司)、华法林(Orion)、氯化钾注射液(中国大冢制药有限公司)等。
1.2 方法
1.2.1DCM动物模型的建立:实验动物麻醉采取气管插管及全身麻醉,麻醉试剂使用丙泊酚(4~12mg/kg)诱导麻醉和异氟烷(2%~4%)吸入维持麻醉。呼吸机辅助呼吸,潮气量12 mL/kg,维持血氧饱和度100%。
动物常规麻醉后,股动脉穿刺,穿刺顺利后置入5F鞘管,透视下将5F的Judkins导管置入左冠状动脉,在左主干注入阿霉素(多柔比星)。阿霉素溶解于20 mL 0.9%氯化钠溶液中,每次的注射剂量为0.7 mg/kg。每周注射一次,连续注射5周。
正常对照组同样进行麻醉,麻醉后同样置入导管,在相同位置注射等量不含阿霉素的0.9%氯化钠溶液。每周注射一次,连续注射5周。成模标准:LVEF<30%。
1.2.2超声心动图检查:末次注射4周后对全部分组动物进行超声心动图检查。
动物在麻醉状态下,取胸骨旁长轴切面, 在二维超声引导下用M 型超声进行测量,计量资料连续测量3个心动周期取平均值。测定指标包括:左房内径(LA)、左室舒张末内径(LVEDD)、左室收缩末内径(LVESD)、室间隔厚度(IVSD)。每搏输出量(SV)、左室射血分数(EF)及左室短轴缩短率(FS)。
1.2.3血流动力学参数的测定:动物在麻醉状态下进行血液动力学监测。采用多导生理记录仪及心导管技术测量左室压力曲线,测定左室收缩压(LVSP)、左室舒张末压(LVEDP)、左室内压最大上升/下降速度(dp/dtmax)。每次测量均取连续10个心动周期的平均值。
1.2.4血液学检测:末次注射4周后对全部动物抽6 mL静脉血完成血常规、生化检查、凝血及心脏相关检查。
1.2.5心室重构评价
1.2.5.1组织病理学纤维化程度检测:病理学检查均为左心室心尖部同一位置处心肌结构的对比,从而排除不同部位心肌结构改变所带来的影响;同时对同一位置处心肌结构多点(>3)取材进行病理切片检查,进而排除病理切片制片过程中的影响。
将动物安乐死,取出心肌组织于4% 多聚甲醛溶液固定,常规石蜡包埋,组织切片后行常规HE染色和Masson染色,于光镜下观察心肌组织纤维化及病理形态改变。应用Image Pluse 5.1 计算机软件分析检测心肌组织胶原容积分数(CVF),CVF 为心肌纤维化面积与心肌总面积比值。
1.2.5.2免疫组化检测组织Collagen I/III水平:对组织内的Collagen I/III进行免疫组化检测,半定量测定。采用蛋白免疫印迹(Western blot)法:处死实验动物后取心肌组织标本100 mg, 剪碎、离心,用BCA 法测定蛋白浓度,经非连续梯度SDS-聚丙烯酰胺凝胶电泳分离蛋白,将凝胶上的蛋白转移至硝酸纤维膜上置于封闭液中,室温温育1 h,再加入一抗,Ⅰ型胶原蛋白抗体、Ⅲ型胶原蛋白抗体、4 ℃冰箱摇床上过夜,应用洗液漂洗,再加入二抗,室温摇床上培育1 h,然后用洗液漂洗。最后将显色剂加入硝酸纤维膜上,1 min 后放入暗室曝光。经软件分析。
1.3 统计学分析

2 结果
2.1 DCM动物模型的建立
DCM动物模型冠脉造影及药物注射过程如图1所示。
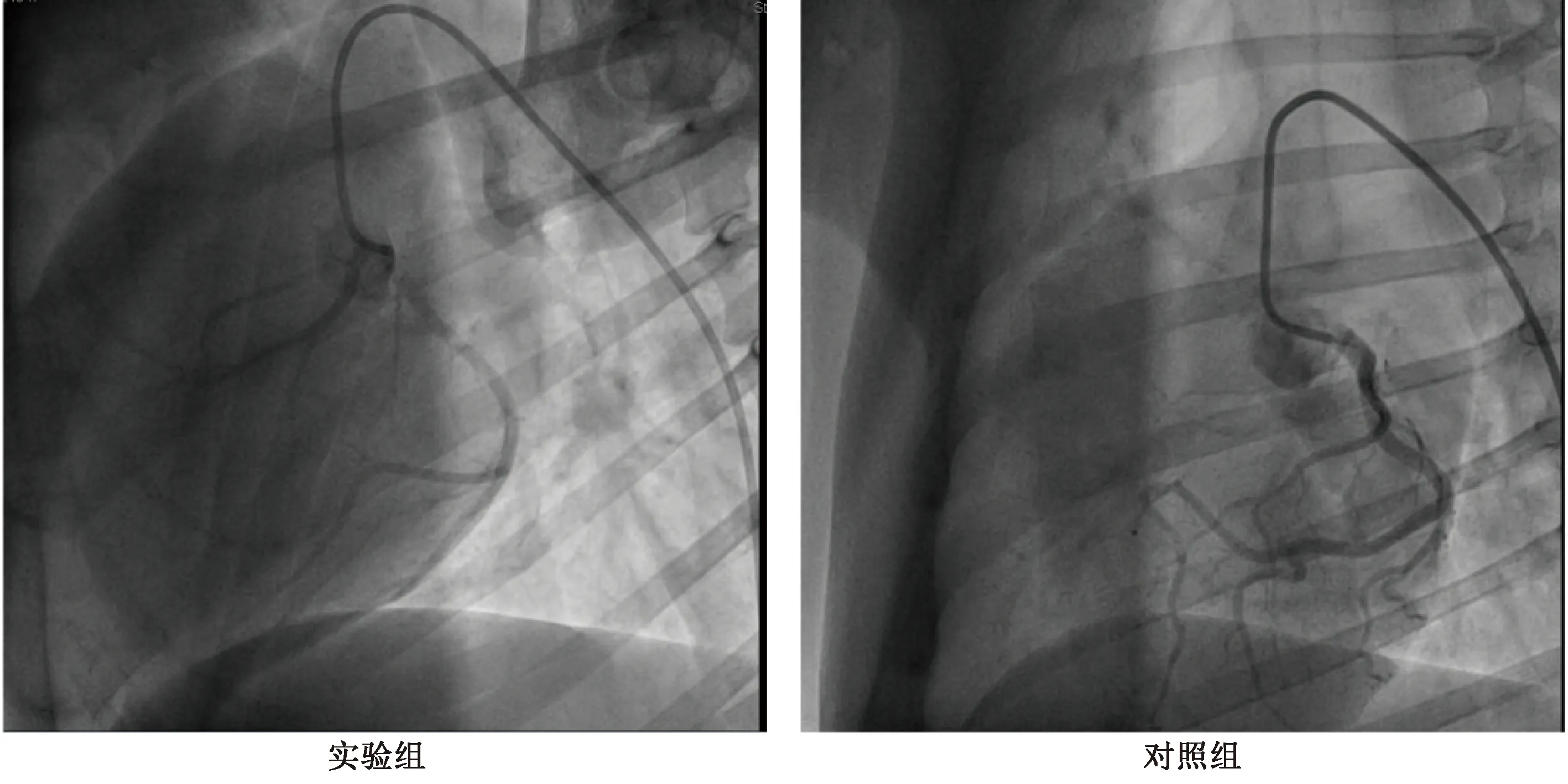
注:冠脉造影确定左冠状动脉开口位置,自左冠脉动脉主干注射多柔比星(实验组)或者等量的0.9%氯化钠溶液(对照组)
2.2 DCM动物模型的评价结果
2.2.1心脏超声及血液动力学检测结果:如图2所示,与对照组相比,实验组在建模后左房内径(LA)、左室舒张末内径(LVEDD)、左室收缩末内径(LVESD)、室间隔厚度(IVSD)均出现明显增大(P<0.05);每搏输出量(SV)、左室射血分数(EF)、左室短轴缩短率(FS)、左室收缩压(LVSP)、左室舒张末压(LVEDP)、左室内压最大上升/下降速度(dp/dtmax)均出现明显降低(P<0.05),详见表1。
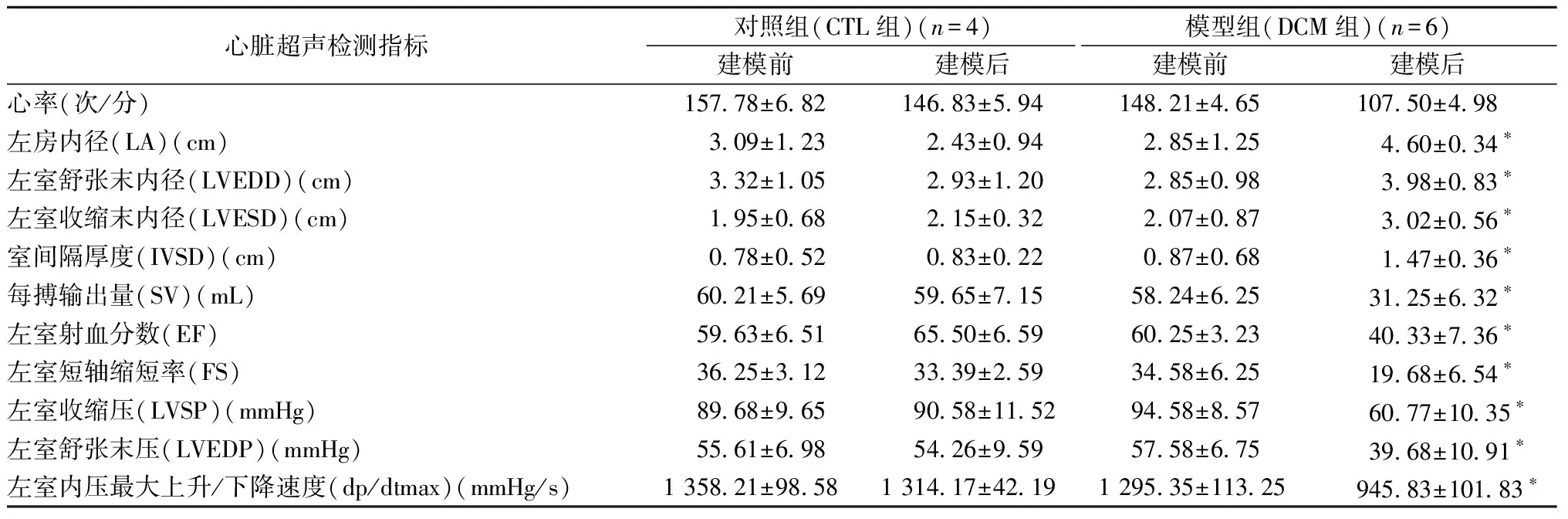
表1 末次注射4周后心脏超声检测结果
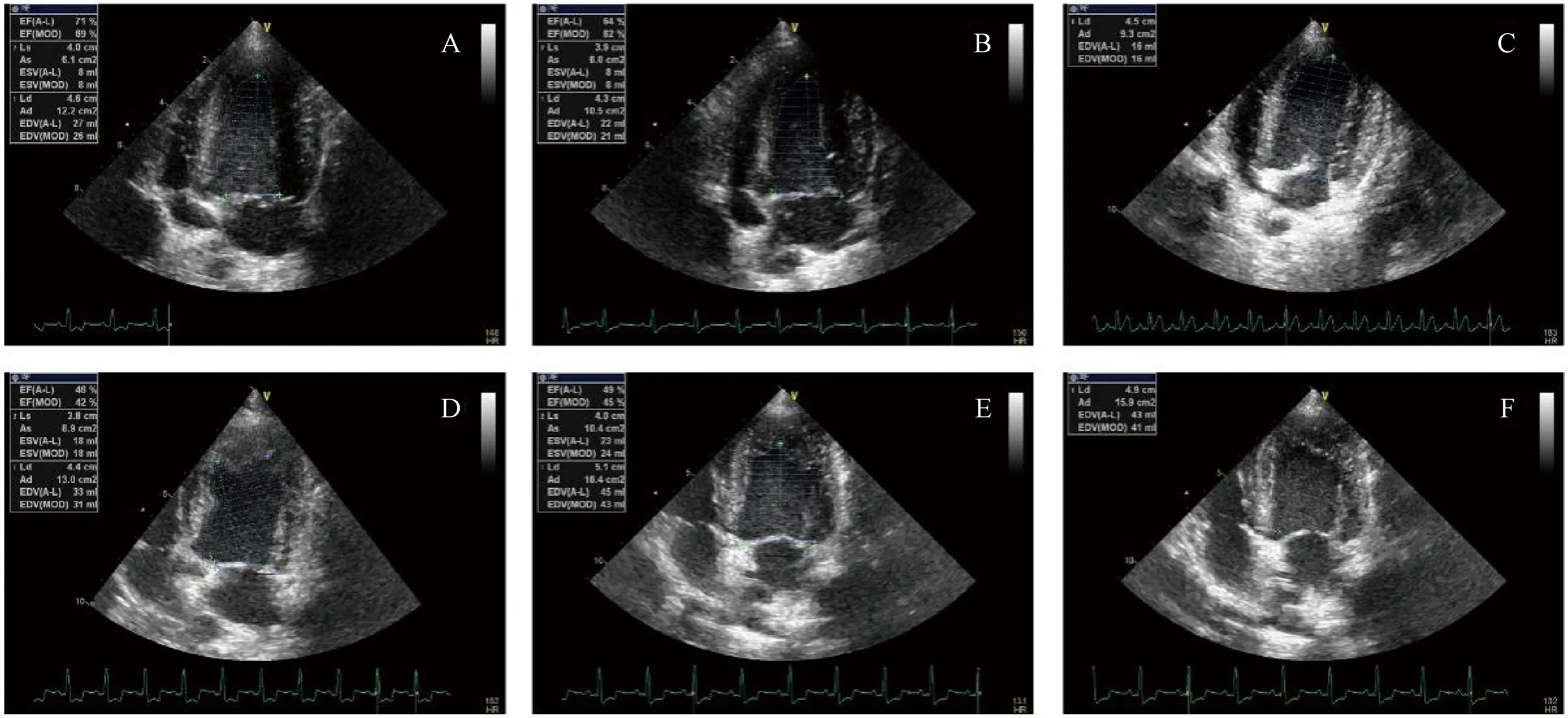
注:A~C.对照组,D~F.模型组,与对照组相比,模型组左室射血分数(EF)、左室短轴缩短率(FS)等出现明显降低,左房内径(LA)、左室舒张末内径(LVEDD)、左室收缩末内径(LVESD)等出现明显扩大
2.2.2血液学检测结果:血液学检测结果显示:与对照组相比,除白细胞计数外,其余各项指标,DCM组建模后均出现明显差异(P<0.05),详见表2。
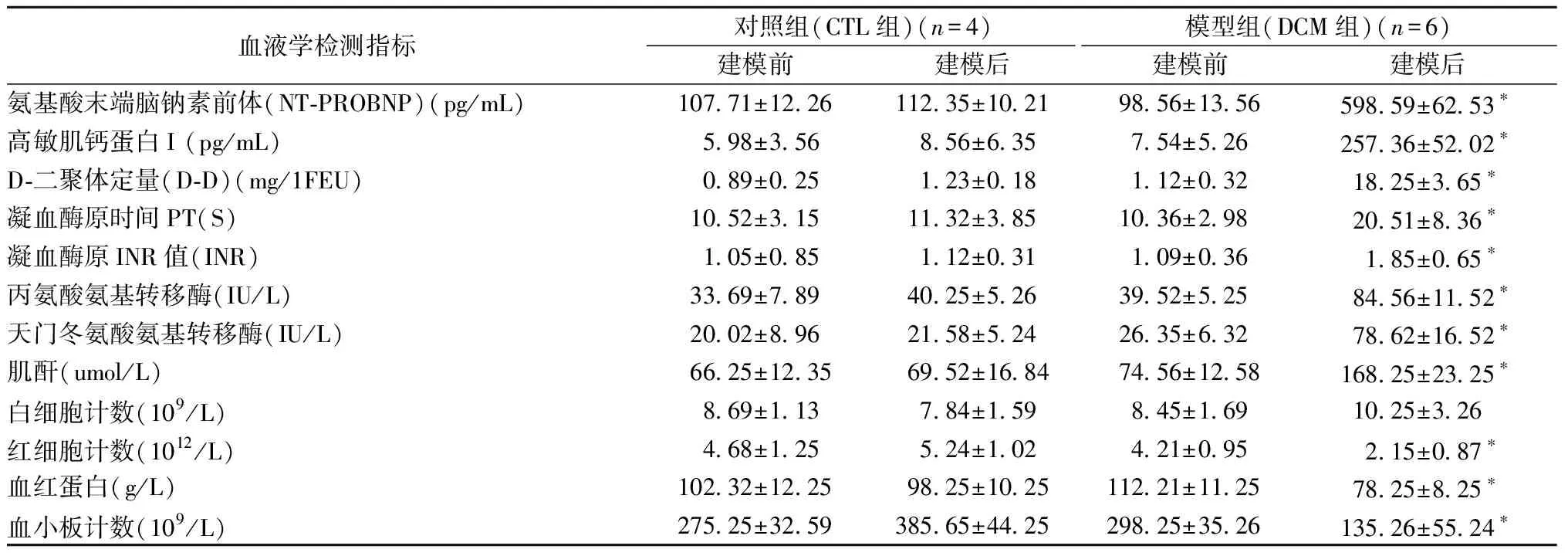
表2 末次注射4周后血液学检测结果
2.3 心室重构评价结果
2.3.1组织病理学纤维化程度检测:如图3所示,实验动物取材后进行实验标本的大体观察:与对照组相比,实验组各组实验动物均出现了不同程度的心脏扩大,部分实验动物出现左心耳陈旧性血栓,左房出现明显扩张,心房肌菲薄,左心室内壁出现部分纤维增生。
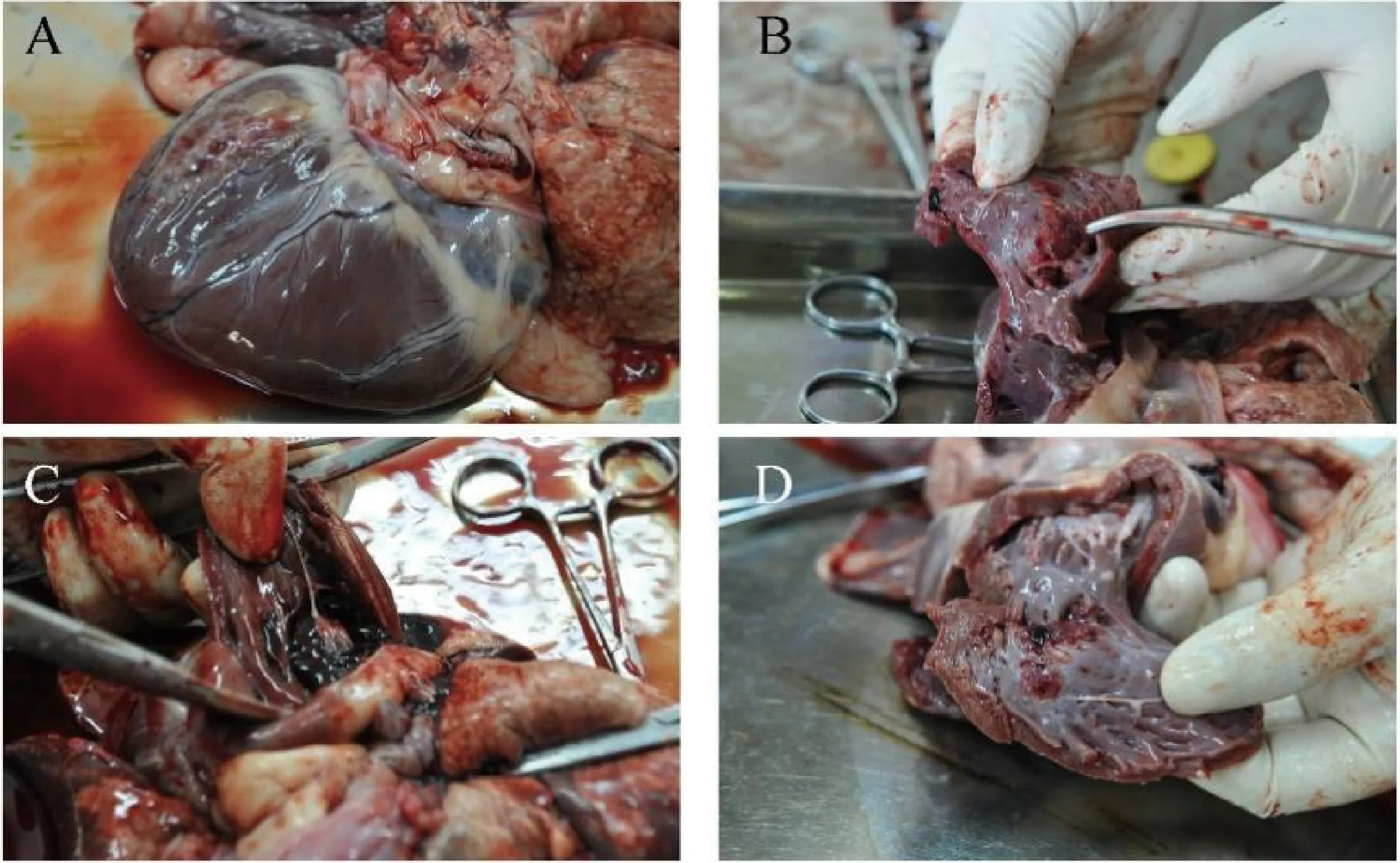
注:A.DCM组标本大体观;B.DCM组左心房:左房出现明显扩大,左房心肌菲薄;C.DCM组左心耳:左心耳出现陈旧性血栓;D.DCM组左心室:心室扩大,出现部分纤维结构样增生
如图4所示,实验动物取材后进行常规HE染色和Masson染色:与对照组相比,实验组可见明显的结构损伤,例如:心肌断裂等结构损伤。与对照组相比,实验组心肌纤维化程度明显增加(P<0.05)。
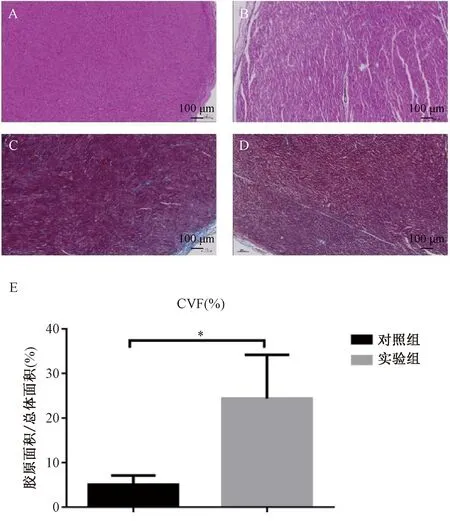
注:A.对照组HE染色;B.实验组HE染色;C.对照组Masson染色;D.实验组Masson染色;E.与对照组相比,实验组出现明显的纤维化,*P<0.05
2.3.2免疫组化组织Collagen I/III结果:如图5所示,实验动物取材后对心肌组织进行Collagen I/III的定量检测,与对照组相比,DCM组心肌组织内的Collagen I/III含量明显升高,说明DCM组的心肌纤维化程度明显升高(P<0.05)。
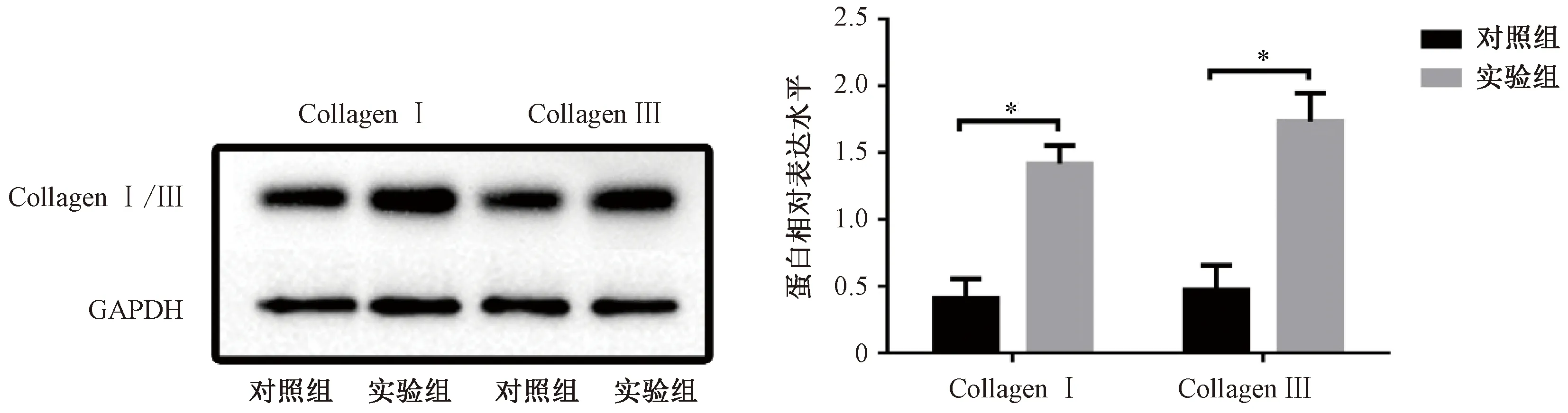
*P<0.05
3 讨论
扩张型心肌病,其病因较复杂,且目前临床上仍缺少有效治疗方法,患者愈后较差。因此建立理想的动物模型,模拟人类 DCM 的病理变化及病情发展,对于DCM 的发病机制、治疗效果等临床研究非常重要。
扩张型心肌病的建模方法较多,有通过转基因的技术实现的,例如把cTnTR14IW基因克隆入心脏特异表达的 c-MHC 启动子下游,构建转基因表达载体[9];也有研究[10]用同种方法成功构建cTnCi59转基因小鼠模型。与cTnTR141W转基因小鼠模型相比,该模型发病时间较晚,12月龄时才出现明显表现,且无猝死发生,故可作为老年发病的 DCM 模型;另外还可以通过自身免疫性缺陷来实现,例如将7周龄 SPF 级雄性Lewis大鼠,随机分为模型组和正常对照组。DCM组将10 mg/mL的猪心肌球蛋白与等体积的弗氏完全佐剂(含有结核分支杆菌H37Ral mg/mL)进行充分乳化后,在实验第1天和第8天在大鼠左右后肢足垫皮下各注射上述乳化液0.1 mL。结果显示:DCM组大鼠均出现足部溃疡,且心腔扩大,心室壁回声增强、运动减弱,甚至出现矛盾运动;心肌细胞变性、肥大,局灶性坏死,心肌间质胶原纤维增生等DCM表现[11];还有利用柯萨奇病毒进行的建模实验,例如采用4周龄小鼠,腹腔内注射0.1 mL 10-柯萨奇病毒,以后每4周腹腔内重复接种,结果显示:心脏彩色超声心动图检测病毒组小鼠心腔普遍扩大,呈普大心型,心室壁活动度明显减弱。组织病理学特征与人类扩张型心肌病的病理形态特征极为相似[12];还有利用呋喃唑酮建立DCM模型的方法将哺乳至2周龄的近交系SD 大鼠随机分为呋喃唑酮组和对照组。将呋喃唑酮配成43 mg/mL的溶液,按0.3 mg/g体质量,下胃管喂饲,每日1次,每周按体质量调整用药剂量,喂饲8周。实验结果显示:DCM 模型不仅出现与人类相同的活体形态学改变、组织病理改变而且具有相同的神经内分泌变化[13]。
DCM 造模方法多种多样,但是以小动物模型居多,大动物模型建模周期较长,或者建模方法较复杂,均一性较差。目前国内仍缺乏DCM大动物模型建立与评估的相关报道。
有研究[14]将出生4周的雌性SD大鼠,随机分成实验组和对照组。实验组给予多柔比星腹腔内注射,每周2 mg/kg ,连续8周。对照组腹腔内注射与实验组等量的0.9%氯化钠溶液,每周1次,连续8周。大鼠在用药第9周时麻醉,进行超声心动图检查及心肌组织切片。结果显示,实验组3只大鼠出现心包积液,均有不同程度的心腔扩张和射血分数下降,心肌细胞变性、坏死,并有明显心肌间质纤维化。还有学者[15]采用短期3周大剂量腹腔注射多柔比星(15 mg/kg)的方法成功建立了 DCM 模型,但死亡率较高,发病较急,与DCM 慢性发展过程不相符合。利用多柔比星建立小动物模型的报道较多,但是目前仍缺少DCM大动物模型的建模经验与方法[16-18]。
本实验旨在探索建立犬的DCM动物模型,通过冠脉造影确定左冠状动脉主干开口,予以多次冠脉注射多柔比星,每周一次,连续注射5周,末次注射4周后予以取材评估。实验结果显示:与对照组相比,DCM动物模型组出现了明显的全心扩大,且心肌收缩力出现明显的降低;血液学检查显示DCM动物模型组内环境出现了紊乱,其肝、肾功能的各项指标均出现了明显的升高,血色素、血小板出现了明显降低;动物取材时发现其心脏出现扩大,部分实验动物左心耳可见血栓,病理学检测及Collagen I/III的定量检测发现,DCM动物模型组出现了明显的心肌纤维化,心室重构较对照组明显加重。
扩张型心肌病动物模型的建立常使用阿霉素药物建模,既往研究中小动物模型较多,如小鼠或者大鼠,大动物模型建模较少,如犬或者猪。阿霉素具有毒性反应,其建立扩张型心肌病的动物模型会产生全身毒性反应,如肝、肾毒性损伤,所以在大动物模型建立时我们选择了冠脉给药,药物由冠脉注射,可以最大程度的降低全身反应情况,加重心肌毒性反应,进而完成扩张型心肌病建模。但即便是冠脉给药也会出现肝、肾毒性,其无法避免阿霉素的全身毒性反应。目前在国内外相关研究中,扩张型心肌病小动物模型冠脉给药困难,所以仍选择外周静脉或者是腹腔内注射给药。本次建模选择了阿霉素冠脉给药途径,其建模效果良好,成功建立扩张型心肌病模型。因阿霉素冠脉给药建模效果良好,故未再设立外周静脉或者腹腔内注射的建模模型组,后期我们将进一步探究模型的相关建立方法,并进一步对比分析其建模效果。
采用冠脉多次注射阿霉素(多柔比星)的方法建造DCM动物模型,具有可行性及有效性,其周期较短、简单易行,并且更接近于人类 DCM 病理生理过程。

