外源信号分子AI-2 对发酵乳杆菌TG4-1-1 和乳酸片球菌11-3产胞外多糖的影响
王 艳,顾 悦,郑砚学,张 悦,贺银凤
(内蒙古农业大学食品科学与工程学院 呼和浩特 010018)
群体感应(quorum sensing,QS)是细菌通过感知周围环境中菌群浓度的变化,释放信号分子,进而启动相关基因表达来实现调控菌体行为的一种生理活动[1]。目前发现QS 系统可以调控细菌多种生理行为,如毒力因子的表达、生物膜的形成、胞外多糖的产生、生物发光、细菌自溶以及细菌素的生物合成和对各种环境压力的抗性等[2-6]。乳酸菌是一类兼性厌氧,能够将碳水化合物发酵产生乳酸的革兰氏阳性菌,其群体感应类型包括自身诱导和双组分信号系统[7]。乳酸菌的信息交流分为种间交流信号分子AI-2 和种内调节信号分子AIP,其中,信号分子AI-2 是呋喃酮酰硼酸二酯,LuxS/AI-2 群体感应系统在多种细菌信息交流中都起着重要的作用[8-9]。
前期研究表明LuxS/AI-2 群体感应系统可调控乳酸菌形成生物膜,且对生物膜的形成能力具有一定的影响[10-11]。乳酸菌的生物膜主要是菌体外的大量胞外聚合物与细菌粘连形成的菌落聚集体[12]。胞外聚合物主要指细菌分泌的各种生物大分子物质,如胞外多糖(exopolysaccharide,EPS)和蛋白质、核酸等。EPS 是指细菌在生长发育过程中通过自身代谢,将环境中含碳化合物通过一系列的反应合成并分泌到细胞外的高分子、长链糖类聚合物。EPS 在生物膜中的比例占总有机物的50%~90%[13]。EPS 在微生物抵抗不良环境时发挥作用,助其存活[14],具有改善肠道微生物的菌群结构,促进肠道健康,调节免疫功能,抗肿瘤及抗氧化等益生功能[15]。
目前研究主要集中在QS 系统对乳酸菌生物膜的形成,在研究QS 系统与生物膜的调控机制过程中发现QS 系统与细菌分泌EPS 在一定程度上存在某种联系。吴荣[16]通过研究发现添加终浓度为60 μmol/L 的外源信号分子AI-2 时,植物乳杆菌5-4-1 各生长阶段EPS 生成量均显著提高。Smritikana 等[6]研究发现,霍乱弧菌MO10 合成EPS 过程涉及群体感应系统,该菌的群体感应自诱导剂缺失会引起EPS 过度表达。杨维等[17]研究发现在不同浓度溴化呋喃酮作用下,单增李斯特菌EPS 含量均低于空白组,且随着浓度的增加,EPS 含量逐渐减小。以上结果表明QS 系统对细菌EPS 合成有一定的影响,然而是否存在调控关系还需验证。
本研究首先通过测定发酵乳杆菌(L.fermentum)TG4-1-1 和乳酸片球菌(P.acidilactici)11-3不同培养时间EPS 分泌量和AI-2 活性,得出菌株分泌EPS 和AI-2 活性的变化规律;其次,采用添加外源AI-2 的方法,以两株菌在外源AI-2 作用下生长量、菌体形态、EPS 分泌量以及微观表面结构的变化为指标,研究信号分子AI-2 是否可以调控乳酸菌分泌EPS。最后,明确信号分子AI-2和乳酸菌产EPS 之间是否存在相关性,为LuxS/AI-2 群体感应系统调控EPS 的研究提供一定的数据支撑。
1 材料与方法
1.1 试验菌株
哈维氏弧菌(Vibrio harveyi)BB170、发酵乳杆菌(Lactobacillus fermentum)TG4-1-1、乳酸片球菌(Pediococcus acidilactici)11-3 均由内蒙古农业大学食品科学与工程学院食品生物技术团队提供。
1.2 试剂与材料
氯化钠、七水合硫酸镁、三氯乙酸,国药化学集团;透析袋(MD34,截留分子质量为8 000~14 000 d),北京索莱宝科技有限公司;L-精氨酸、酸水解酪蛋白,Coolaber 公司;MRS 肉汤,广东环凯微生物科技有限公司。
1.3 仪器与设备
HF-SAFE 1500 型生物安全柜、SMART-N 纯水机,力康生物医疗科技控股有限公司;SX-500全自动高压灭菌锅,日本TOMY 公司;PB 10 型酸度计,德国Satorius 公司;5810 型高速低温离心机,德国Eeppendorf 公司;Neofuge 18R 高速冷冻离心机,上海力申科学仪器有限公司;Free Zone真空冷冻干燥机,美国Laconco 公司;紫外分光光度计,北京普析通用仪器有限责任公司。BioTek Epoch 全波长酶标仪,美国BioTek 公司;Perkin Elmer victor X 酶标仪,美国Perkin Elmer 公司;TM4000 形桌上显微镜,日本株式会社日立高新技术那珂事业所。
1.4 试验方法
1.4.1 菌株不同生长阶段EPS 产量的测定 将发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 以2%(体积分数)接种比接种于MRS 液体培养基中,在37℃下活化培养二代,将二代菌液制备成供试菌液[18]。将供试菌液以2%(体积分数)接种比接种于新鲜的MRS 液体培养基中培养0,4,7,10,13,16,19,22,25 h 后测定不同时间点菌株的生长量、EPS 产量、AI-2 活性。
1.4.1.1 EPS 的粗提取 EPS 的粗提取参照纪亚楠[19]的试验方法。
1.4.1.2 EPS 的测定 采用苯酚-硫酸法测定乳酸菌EPS 含量,取稀释后的透析样品200 μL,依次加入6%苯酚溶液200 μL,浓硫酸1 mL,摇匀,室温放置30 min 使用酶标仪测OD490nm值。将不同培养时间粗多糖的OD490nm代入标准曲线中即可算出EPS 的含量。
葡萄糖标准曲线绘制:以无水葡萄糖为标准品,采用苯酚-硫酸法绘制标准曲线[20]。配制100 μg/mL 的葡萄糖标准液,按表1 加入各种试剂,混匀,静置30 min,以1 号管为空白对照,在490 nm处测定吸光度,绘制葡萄糖标准曲线。

表1 苯酚-硫酸法标准曲线绘制Table 1 Standard curve drawing by phenol-sulfuric acid method
以糖含量(mg/L)为横坐标,吸光度(A490nm)为纵坐标绘制标准曲线,建立回归方程,回归线性方程为Y=0.0112X-0.0064,R2=0.999。R2>0.99,表示具有可行度和线性关系,R2值越接近1,吻合程度越高。
1.4.2 菌株不同生长阶段AI-2 活性测定
1.4.2.1 无细胞发酵上清液的制备(cell-free fermentation supernatant,CFS)将试验菌株以1.4.1节的方法进行培养,待测培养液8 000 r/min 离心5 min(4 ℃),使用0.22 μm 水系滤膜对上清液过滤除菌,即得到试验菌株的CFS。将哈维氏弧菌BB170 以2%(V/V)接种于AB 培养基中培养3 代至OD600nm为0.9~1.1,4 ℃ 4 000 r/min 离 心10 min,使用0.22 μm 水系滤膜对上清液过滤除菌,即得到阳性对照。AB 培养基过滤除菌即得到阴性对照,MRS 培养基过滤除菌即得乳酸菌介质对照。所取上清液与对照样品于-80 ℃保存。
1.4.2.2 信号分子AI-2 活性的测定 将哈维氏弧菌BB170 接种到AB 培养基中,30 ℃100 r/min振荡培养活化二代,以2%接种比培养3 代至OD600nm为0.9~1.1,按1 ∶5 000(V/V)将菌液和AB培养基混合,得到稀释后约为105 CFU/mL 的哈维氏弧菌BB170 菌液。阳性对照为哈维氏弧菌BB170 的CFS,阴性对照为无菌的AB 培养基,介质对照为无菌MRS 培养基。将待测样品、阳性、阴性、介质对照与稀释后的哈维氏弧菌BB170 菌液以1 ∶100(V/V)进行混合,30 ℃100 r/min 振荡培养。在0~6 h 内,每隔30 min 取200 μL 混合液在化学发光模式测定其荧光强度值。在阴性对照荧光强度值达到最低点时对各个样品的荧光强度进行测定,计算其相对荧光强度用以代表信号分子AI-2 的活性。计算公式如下:
待测样品相对荧光强度=待测样品的荧光强度值/介质对照的荧光强度值[21]
1.4.3 外源信号分子AI-2 最佳添加浓度的确定 根据顾悦[22]的试验方法,完成了信号分子AI-2的体外合成。反应体系为:1 mmol/L 的SAH 与1 mg/mL 的LuxS 和Pfs 蛋白在10 mmol/L 磷酸钠缓冲液(pH 7.5)中,37 ℃水浴反应1 h。使用10 ku超滤管以除去未反应的蛋白,使用0.22 μm 水系滤膜过滤除菌,保藏于-80°C。利用埃尔曼试剂测定AI-2 浓度可达1.362 mmol/L,同时采用哈维氏弧菌BB170 生物发光法测得合成AI-2 的相对荧光强度可达139.350±0.384。
将外源信号分子AI-2 添加到MRS 培养基中至终浓度分别为50,100,150 μmol/L,将活化培养至二代的发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 按2%(V/V)接种比接入含有不同浓度外源AI-2 的MRS 培养基中作为试验组,将菌按2%(V/V)接入含有等体积pH 7.5 磷酸钠缓冲液的MRS 培养基中作为对照组,测定AI-2 活性最高点时处理组生长量和AI-2 活性变化,测定EPS 产量最高点时生长量和EPS 产量变化,筛选出最佳外源AI-2 添加浓度便于后续试验。
1.4.4 外源信号分子AI-2 对菌株的影响 将1.4.3 节中筛选得到的最佳浓度作为试验浓度,同时以未添加外源AI-2(0 μmol/L)为对照,分别培养0,4,7,10,13,16,19,22,25 h 后,测定外源AI-2对菌株TG4-1-1 和11-3 不同培养时间生长量、EPS 产量的影响。同时利用扫描电镜观察两株菌培养13 h 的菌体形态以及培养22 h 的多糖冷冻干燥后的表面结构。
1.5 数据处理及分析
每组试验重复3 次,用SPSS19.0 对试验数据进行统计分析,所有数值用平均值±标准差表示,P<0.05 表示差异显著。
2 结果与分析
2.1 不同培养时间EPS 产量和AI-2 活性的变化规律
2.1.1 发酵乳杆菌TG4-1-1 和乳酸片球菌11-3不同培养时间EPS 产量的变化规律 不同培养时间发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 EPS产量和生长量的变化规律如图1 所示。由图1a 可知,发酵乳杆菌TG4-1-1 的延滞期较短,培养4 h以后进入对数生长期;13 h 以后开始进入稳定期,且稳定期持续时间较长;培养16 h 时生长量达到最大(OD595nm=2.153±0.019),22 h 以后生长量逐渐降低进入衰亡期。发酵乳杆菌TG4-1-1 不同时间点粗多糖产量差异较大,随着培养时间延长,菌株粗多糖的产量呈逐渐上升的趋势。0~4 h 为发酵乳杆菌TG4-1-1 EPS 合成的起始阶段,4~13 h 内是EPS 快速合成阶段,13~22 h 进入EPS 合成的稳定期,培养22 h 后EPS 产量最高达到(195.863±1.643)mg/L,之后在25 h 时EPS 产量略有下降。由图1b 可知菌株11-3 与菌株TG4-1-1 随不同培养时间的生长量和EPS 产量的变化规律具有相似性,其在培养16 h 时OD595nm为2.061±0.022 达到最大,培养22 h 后EPS 产量为(125.179±1.458)mg/L 达到最大。说明菌株TG4-1-1 和11-3 从延滞期开始一直到稳定期前期的生长量和EPS 产量都随着时间的延长呈现大幅上升的趋势,是因为菌株在这段时期内生长旺盛导致其代谢产物也增多;当菌株的生长量稳定时,EPS 产量在小幅增加;当菌株进入衰亡期时,EPS 产量也随之减少,推测可能是由于培养后期培养基营养物质不充分,菌体会分解一定量自身所产EPS,也可能是菌体发酵过程中产生的酶如糖苷水解酶将EPS 降解,导致后期出现EPS 产量减少现象[23]。

图1 菌株不同培养时间的生长量和EPS 产量的关系Fig.1 Growth and EPS yield of strains at different culture time
2.1.2 发酵乳杆菌TG4-1-1 和乳酸片球菌11-3不同培养时间AI-2 活性的变化规律 利用哈维氏弧菌BB170 生物发光法对发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 培养不同时间下产AI-2 活性进行检测。结果如图2a,发酵乳杆菌TG4-1-1随着培养时间的延长AI-2 活性逐渐增强,达到最强后又减弱。在0~10 h 内随着时间的延长发酵乳杆菌TG4-1-1 的生长量(OD595nm)逐渐增大、AI-2活性逐渐增强;菌株在10 h 时AI-2 活性达到最大;之后菌株的生长量还在逐渐上升直至稳定后又略有下降,在此期间菌株AI-2 活性则一直呈现下降趋势。从图2b 可知乳酸片球菌11-3 所产AI-2 活性随着培养时间的延长在10 h 时达到最强,之后AI-2 活性减弱。发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 均在10 h 时所产AI-2 活性最强,这与其它研究证实细菌信号分子AI-2 产生的最强时期一般发生在对数末期和稳定初期[24-25]的结果一致;后期AI-2 活性减弱可能与AI-2 不稳定易分解的性质有关[26],也可能是因为AI-2 附着在菌体细胞膜上导致其环境中减少[27]。

图2 菌株不同培养时间的生长量和AI-2 活性的关系Fig.2 Growth and AI-2 activity of strains at different culture time
2.1.3 发酵乳杆菌TG4-1-1 和乳酸片球菌11-3不同培养时间EPS 和AI-2 的关系 从图1 和图2 可以看出,在0~10 h 试验菌株的EPS 产量、AI-2 活性随时间的延长而呈现上升的趋势。10 h 之后试验菌株的AI-2 活性开始逐渐下降,可能是被菌株内化吸收后参与调控某些生理活动[28],如EPS的产生,与此同时EPS 产量仍在不断积累,因此可证明这一猜测合理。
2.2 最佳外源信号分子AI-2 添加量的确定
根据前期试验得出发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 均在培养10 h 时AI-2 活性最强以及22 h 时EPS 产量最高。为筛选出发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 最佳的外源信号分子AI-2 添加浓度,选取试验菌株10 和22 h 测定菌株生长量、信号分子AI-2 活性和EPS 产量。
2.2.1 不同浓度外源信号分子AI-2 对菌株生长量的影响 加入不同浓度外源信号分子AI-2 对发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 分别培养10 h 和22 h 的生长量的影响如图3 所示。从图3 中可以看出添加外源信号分子AI-2 对菌株TG4-1-1 和11-3 的生长量有一定的影响。添加终浓度为0,50 μmol/L 和100 μmol/L 时,发酵乳杆菌TG4-1-1 和乳酸片球菌 11-3 在10,22 h 的OD595nm之间均无差异,表明0~100 μmol/L 外源信号分子AI-2 对该菌株的生长量均无显著影响(P>0.05);而添加浓度为150 μmol/L 时,发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 在10,22 h 的OD595nm则显著降低(P<0.05),表明两株菌的生长量受到明显抑制。随着外源信号分子AI-2 的浓度增加,其对菌株TG4-1-1 和11-3 10 h 和22 h生长量的影响逐渐显著,说明信号分子的作用范围受其浓度抑制,当超过一定范围后其作用效果受到影响[29]。出现这样的结果可能是因为浓度为150 μmol/L 时达到了菌体感受识别AI-2 的阈值,使得菌株的生长受到了影响造成其生长量低于未添加组。

图3 不同浓度外源信号分子AI-2 对菌株10,22 h 生长量的影响Fig.3 Effects of different concentrations of exogenous AI-2 on the growth of strains at 10 and 22 h
2.2.2 不同浓度外源信号分子AI-2 对菌株22h EPS 产量的影响 不同浓度外源信号分子AI-2对发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 培养22 h 时EPS 产量的影响如图4 所示。由图可知,不同浓度添加外源信号分子AI-2 对发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 EPS 产量有一定的影响。添加终浓度分别为0,50,100 μmol/L 和150 μmol/L 外源信号分子AI-2 后提取测定菌株TG4-1-1 的EPS 产量分别为(194.077±1.174),(197.119±1.380),(202.012±1.172)和(176.964±2.030)mg/L,菌株11-3 的 EPS 产量分别为(122.054±2.770),(127.262±1.034),(132.768±1.021)mg/L 和(114.167±2.011)mg/L,外源信号分子AI-2 终浓度为100 μmol/L 时,两株菌EPS 产量均得到促进并显著高于未添加组(P<0.05);当外源信号分子AI-2 终浓度为150 μmol/L 时,两株菌EPS 产量则受到抑制,显著低于未添加组(P<0.05)。
当外源AI-2 终浓度在0~100 μmol/L 范围内,随着外源信号分子AI-2 浓度增加,EPS 产量也略有增高,由此推测信号分子AI-2 的添加可能增强了乳酸菌的EPS 合成相关的生理活动,进而提高了菌株产EPS 的能力。但外源信号分子AI-2浓度为150 μmol/L 时因其影响菌株TG4-1-1 和11-3 的生长量从而可能影响了EPS 的产量。
2.2.3 不同浓度外源信号分子AI-2 对菌株10 h AI-2 活性的影响 不同浓度外源信号分子AI-2对发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 培养10 h 时所产AI-2 活性的影响见图5。从图5a 中可以看出不同浓度添加外源信号分子AI-2 对菌株TG4-1-1 AI-2 活性有一定的影响。与未添加外源AI-2(0 μmol/L)相比,当外源信号分子AI-2终浓度为50 μmol/L 和100 μmol/L 时,发酵乳杆菌TG4-1-1 所产AI-2 活性都得到增强,且100 μmol/L 时菌株所产AI-2 活性显著高于其它浓度(P<0.05);但当外源信号分子AI-2 终浓度增大到150 μmol/L 时,菌株所产AI-2 的活性被减弱,显著低于未添加时的AI-2 活性(P<0.05)。从图5b中可知添加50,100 和150 μmol/L 外源信号分子AI-2 均对乳酸片球菌11-3 10 h 时AI-2 活性有增强作用,且增强作用显著(P<0.05);100 μmol/L外源信号分子AI-2 对菌株11-3 AI-2 活性的增强作用最好。出现这样的结果可能是AI-2 对菌株的各种生理调控呈现浓度依赖,当AI-2 浓度超出菌株的识别阈值范围,导致部分AI-2 转入了菌体细胞内,对菌株的生理活动起到了负调控。

图5 不同浓度外源信号分子AI-2 对菌株AI-2 活性的影响Fig.5 Effects of different concentrations of exogenous AI-2 on AI-2 activity of strain cultured for 10 h
综合上述结果得出外源信号分子AI-2 终浓度为100 μmol/L 对发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 在10 h 的AI-2 活性以及22 h 的EPS 产量均有一定的促进作用,且促进作用显著(P<0.05)。因此,选择100 μmol/L 的信号分子AI-2 为用于后续试验。
2.3 100 μmol/L 外源信号分子AI-2 对菌株的影响
以100 μmol/L 为最终添加浓度,研究发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 不同培养时间下生长量、EPS 产量和AI-2 活性变化以探讨信号分子AI-2 对菌株TG4-1-1 和11-3 产EPS 的调控。
2.3.1 外源信号分子AI-2 对菌株不同培养时间生长量的影响 外源信号分子AI-2 终浓度为100 μmol/L 对发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 不同培养时间生长量的影响见图6。从图6 中可以得出,与未添加组(0 μmol/L)相比,外源信号分子AI-2 终浓度为100 μmol/L 时,菌株TG4-1-1 和11-3 各阶段的生长量(OD595nm)均未受到显著影响(P>0.05),且进入各生长阶段的时间也与未添加的保持一致,说明100 μmol/L 的外源信号分子AI-2 对菌株的生长无显著影响。
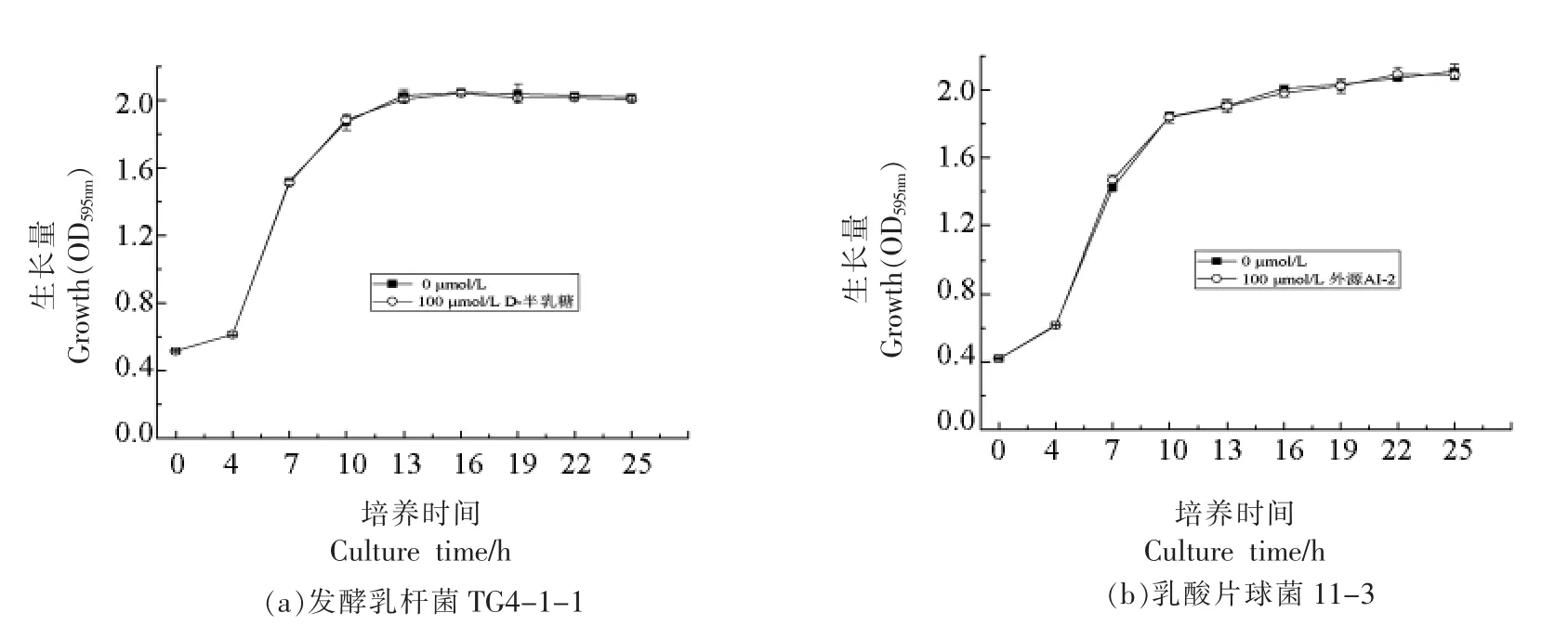
图6 外源信号分子AI-2 对菌株不同培养时间生长量的影响Fig.6 Effect of exogenous AI-2 on the growth of strains at different culture time
2.3.2 外源信号分子AI-2 对菌株不同培养时间EPS 产量的影响 外源信号分子AI-2 终浓度为100 μmol/L 时对发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 不同培养时间EPS 产量的影响见图7。由图可知,发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 在添加与不添加100 μmol/L 外源信号分子AI-2 的培养基中不同培养时间后产EPS 的变化趋势具有一致的相似性。与未添加外源AI-2(0 μmol/L)相比,100 μmol/L 外源信号分子AI-2 对发酵乳杆菌TG4-1-1 不同培养时间的EPS 产量均在一定程度上起到促进作用,产量均有所提高,相较于其它阶段16,19,22 h 的EPS 产量得到了显著提高(P<0.05)。从图7b 可知,100 μmol/L 外源信号分子AI-2 同样对乳酸片球菌11-3 13~22 h 各时间点EPS 产量均有显著促进作用(P<0.05)。以上结果表明100 μmol/L 外源信号分子AI-2 均对两株菌产EPS 有促进作用,可能是因为外源信号分子AI-2 促进菌株参与合成EPS 的相关基因的表达,但是本试验中并没有对测定与EPS 合成相关基因的表达量,具体调控机制还需进一步验证。Gu 等[30]研究发现添加外源信号分子AI-2 后,促进了乳酸菌EPS 的产生和抑制了多糖水解的相关基因lamC 和ftsH 的表达。
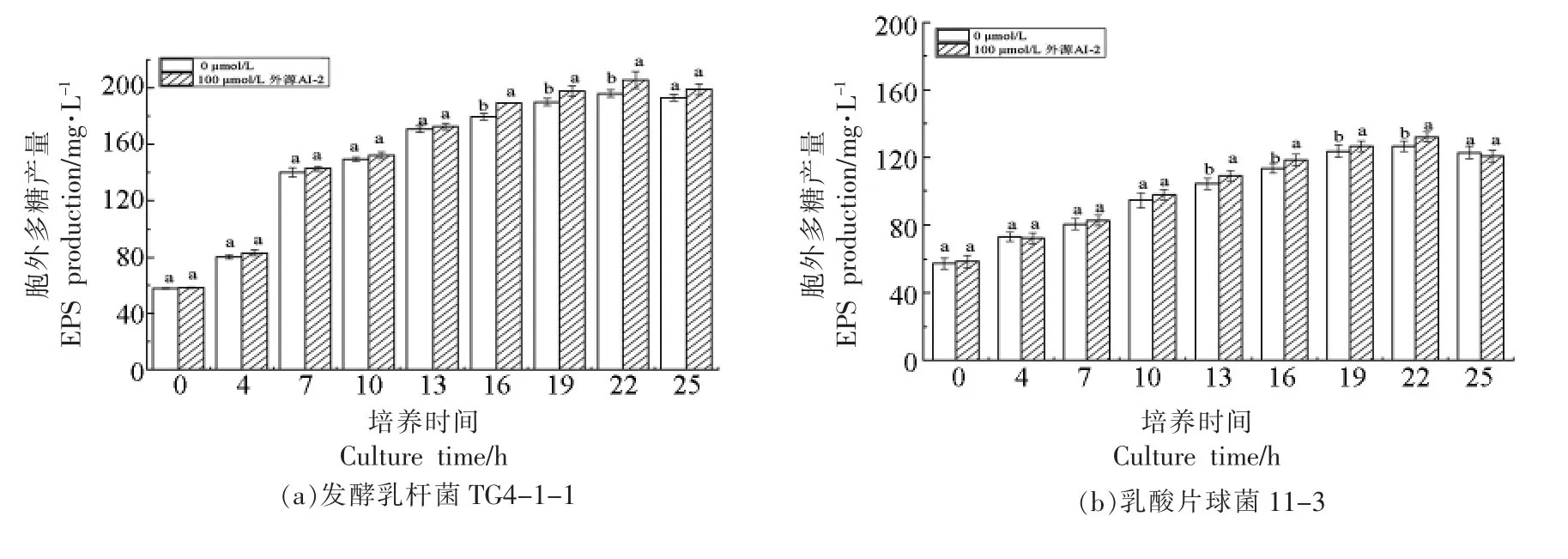
图7 外源AI-2 对菌株不同培养时间EPS 产量的影响Fig.7 Effect of exogenous AI-2 on EPS production of strains at different culture time
2.3.3 外源信号分子AI-2 对菌体形态的影响 发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 培养13 h后菌体放大5 000 倍的扫描电镜图见图8。由图8a可知,未添加外源AI-2 时,发酵乳杆菌TG4-1-1的菌体形态比较完整,个别菌表面不平整,菌体边缘比较圆滑,菌体之间空隙较多、分布松散;由图8b 可知,添加终浓度为100 μmol/L 外源AI-2 时,发酵乳杆菌TG4-1-1 的菌体形状更加规则、形态更加丰满、表面更加光滑,菌体之间的空隙较小使得其聚集生长,表明添加外源AI-2 有助于增加菌株产黏能力;菌体细胞体积相对变大,可能是因为菌体的胞外物质包裹导致的。由图8c、8d 可知乳酸片球菌11-3 的菌体形态也有相类似的变化。以上结果说明。两株试验菌株均在添加100 μmol/L外源信号分子AI-2 时表现出明显的聚集现象,进一步说明AI-2 可促进EPS 的产生。

图8 外源AI-2 对菌株菌体形态的影响Fig.8 The effect of exogenous AI-2 on bacterial morphology
2.3.4 外源信号分子AI-2 对多糖形态的影响 发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 在添加外源信号分子AI-2 后培养22 h 时所产EPS 冷冻干燥后的多糖表面结构见图9。从图9a、9c 中可看出发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 所产的EPS 结构比较疏松,排列分布许多小孔表面粗糙,具有片状和管状相结合的稳定和紧凑的三维网状结构,有的具有薄片紧的表面,有的具有褶皱而紧密的表面。添加终浓度为100 μmol/L 的外源信号分子AI-2 时,对两株菌多糖表面没有明显的影响。EPS 的微观结构和表面形貌的差异很可能是由于样品提取、制备、纯化和干燥方法的不同以及EPS 的组成和结构的不同造成的[31]。

图9 外源信号分子AI-2 对菌株多糖形态的影响Fig.9 Effect of exogenous AI-2 on polysaccharide morphology of strain EPS
3 结论
发酵乳杆菌TG4-1-1 和乳酸片球菌11-3 均在10 h 时AI-2 活性最强,22 h 时EPS 产量均达到最高;添加50 和100 μmol/L 外源AI-2 对两株试验菌株的生长量无明显影响,但EPS 产量随AI-2 浓度的增加而增加,当浓度为150 μmol/L时,菌株的生长量和EPS 产量反而受到抑制;100 μmol/L 外源信号分子AI-2 对试验菌株的生长量无影响,但却可以影响菌株的表面形态并能显著促进不同生长阶段EPS 的产量。综上所述,一定浓度的外源信号分子AI-2 对乳酸菌EPS 的产生具有调控作用,为进一步深入研究LuxS/AI-2 QS 系统调控EPS 的机理奠定基础。

