降N-亚硝胺乳酸菌的筛选及其降解特性研究
郭 进,晓 燕,刘培清,刘宗益,苏 琳,赵丽华,靳 烨*
(1 内蒙古农业大学食品科学与工程学院 呼和浩特 010018 2 呼和浩特市抽样监测与重大活动保障中心 呼和浩特 010018 3 乌兰察布市市场监督管理局 内蒙古乌兰察布 013750 4 乌拉特中旗农牧和科技局 内蒙古巴彦淖尔 015300)
N-亚硝胺(NAs)通常是由胺类物质的亚硝化反应生成[1],其分子式为R1NNOR2,根据分子质量和蒸汽压大小可分为挥发性亚硝胺和非挥发性亚硝胺[2],其中挥发性亚硝胺广泛存在于食品中,尤其是加工肉制品,是四大食品污染物之一[3]。大多数亚硝胺具有致癌、致畸、致突变性和很强的基因毒性,与多种器官癌症的发生相关,尤其是食管、肝脏和肾脏的癌症,并可通过胎盘传递给下一代而受到人们的高度关注[4-5]。
食品污染是一个严重影响食品安全和人类健康的问题。乳酸菌作为益生菌不仅能够提高食品的品质和营养价值,还可在人体中发挥重要生理功能,且近年来益生菌可控制食品中有害物质产生的重要功能已受到广泛关注[5]。有研究表明乳酸菌可通过吸附或降解途径直接减少食品加工过程中产生的生物胺[6]、亚硝胺[7]、苯并芘[8]和真菌毒素[9]等污染物。目前,降亚硝胺的乳酸菌主要通过抑制NAs 形成和清除已生成的NAs 降低NAs 的含量。李秀明[10]研究发现菌体碎片具有抑制NDMA 形成的作用。Kim 等发现乳酸菌可直接降低MRS 培养基中NDMA 的含量。Nowak 等[12]研究发现乳酸菌对NDMA 的抑制能力受环境因素和菌株的影响,且培养上清液、膜提取物和胞内提取物均能不同程度地降低NDMA 含量。然而,肖亚庆[13]研究发现菌株降解NAs 的有效成分为细胞壁上的假定蛋白。
为弄清降亚硝胺乳酸菌的特性,本研究以危害性最强的NDMA 和NDEA 作为筛选菌株的依据,采用HPLC 筛选具有高效降亚硝胺能力的乳酸菌,研究NAs 胁迫对菌株生长量的影响以及不同环境因素对菌株降亚硝胺能力的影响。
1 材料与方法
1.1 材料与仪器
16 株乳酸菌,分离自内蒙古传统发酵制品(酸奶、腌菜、风干肉),内蒙古农业大学肉品科学与技术团队提供;乙腈(色谱纯,Fisher),赛默飞世尔科技(中国)有限公司;EPA 8270/Appendix IX亚硝胺标品(纯度≥99%,产品编号:502138),Sigma-Aldrich 公司。
Centrifuge 5810R 型高速冷冻离心机,安徽中科中佳科学仪器有限公司;ZORBAX Eclipse Plus C18(4.6 mm×250 mm,5 μm)色谱柱、1260 安捷伦高效液相色谱仪,安捷伦科技有限公司;SCIENTZ-950E 型超声波细胞粉碎机,宁波新芝生物科技有限公司;SYNERGY H1 酶标仪,雷康恒泰北京商贸有限公司。
1.2 试验方法
1.2.1 菌株的培养与筛选 乳酸菌的活化:将实验室中甘油保藏的乳酸菌接种至MRS 培养基,以体积分数2%的接种量于28 ℃/37 ℃条件下经2次连续传代培养。降亚硝胺能力的测定:参照肖亚庆[13]的方法略作修改。将16 株活化好的乳酸菌按2%接种量分别接入MRS 培养基中,添加质量浓度为20 μg/mL 的NAs 标品,使其终质量浓度为1 μg/mL,放置于28 ℃/37 ℃培养箱中培养12 h,对照组中不接菌并同等条件下培养。参照方法GB 5009.26-2016 《食品中N-亚硝胺类化合物的测定》提取培养基中的NAs,测定其含量,筛选可高效降低NAs 含量的菌株。
式中:S0——对照组上清液亚硝胺含量;St——试验组上清液亚硝胺含量。
1.2.2 亚硝胺含量的测定 采用HPLC 测定NAs的含量。检测参考肖付刚等[14]的方法,采用ZORBAX Eclipse Plus C18(4.6 mm×250 mm,5 μm)色谱柱,二元梯度洗脱,水相流动相A 为乙腈,有机流动相B 为纯水,流速1 mL/min,进样体积10 μL,柱温为25 ℃,于240 nm 处紫外检测器进行测定。具体梯度洗脱程序如表1 所示。所有样品检测前均经过0.45 μm 膜过滤。利用HPLC 进行检测,NDMA 与NDEA 的保留时间分别为3.15 和4.34 min,其标准曲线方程分别为y=41.858x-1.8024(R2=0.9986)和y=24.861x+0.6011(R2=0.9993)(y为峰面积,x 为亚硝胺浓度)。

表1 梯度洗脱程序表Table 1 The gradient elution program
1.2.3 菌株在正常培养和NAs 胁迫下的生长曲线 将菌株以2%的接种量分别接种于普通MRS和NAs 浓度为1 μg/mL 的MRS 培养基中,在培养时间0,2,4,6,8,12,16,20 和24 h 取样,测定菌液OD600nm值,绘制生长曲线。
1.2.4 不同环境因素对菌株降亚硝胺能力的影响
1.2.4.1 时间对乳酸菌降亚硝胺能力的影响 参考1.2.1 节的方法,将活化后的乳酸菌与亚硝胺于MRS 培养基中共培养,通过HPLC 依次测定培养时间为0,12,24,36,48,72,96,120 和144 h 的NAs 含量,研究时间对菌株降亚硝胺能力的影响。
1.2.4.2 初始pH 值对菌株降亚硝胺能力的影响
参考1.2.1 节的方法,NAs 质量浓度为1 μg/mL的MRS 培养基在初始pH 值为3.5,4.5,5.5,6.5 和7.5 条件下,对照组中不接菌并同等条件下培养,通过HPLC 测定不同初始pH 值条件下NAs 的含量,计算菌株对NAs 的清除率。
1.2.4.3 培养温度对菌株降亚硝胺能力的影响参考1.2.1 节的方法,在共培养体系中培养温度为20,28,37 和45 ℃条件下,对照组中不接菌并同等条件下培养,通过HPLC 测定不同培养温度条件下NAs 的含量,计算菌株对NAs 的清除率。
1.2.4.4 接种浓度对菌株降亚硝胺能力的影响参考1.2.1 节的方法,在乳酸菌接种浓度为106,107,108,109和1010CFU/mL 条件下,对照组中不接菌并同等条件下培养,通过HPLC 测定不同接种浓度条件下NAs 的含量,计算菌株对亚硝胺的去除率。
1.2.5 不同细胞组分对菌株降亚硝胺能力的影响 参考Nowak 等[12]的方法略作修改,研究胞内提取物、胞外代谢物和细胞壁对NAs 的清除作用。将第3 代菌液在4 ℃,12 000 g 条件下离心15 min 得菌株胞外提取液与菌体沉淀。然后加入磷酸盐缓冲液(phosphate buffer saline,PBS)悬浮清洗菌体沉淀3 次,再经超声破碎(300 W,工作2 s,间歇3 s,180 次,0 ℃)后再次离心(12 000 g,15 min,4 ℃)后收集上清得胞内提取液。将菌体沉淀重悬于PBS 中,并通过100 ℃高温加热处理10 min 致死后可得到细胞壁。分别添加NAs 至上述胞内提取液、胞外代谢物和细胞壁中,使其终质量浓度为1 μg/mL,以终质量浓度为1 μg/mL 亚硝胺的PBS 缓冲液及MRS 培养基作为对照,置于培养箱培养,分别在0,0.5,3,6,12,24 和36 h 取样,经HPLC 测定NAs 含量。
1.3 数据处理
所有数据均平行测定3 次,用SPSS 22.0 软件进行显著性分析,数据结果以表示,利用Orgin2018 软件绘制图表,P<0.05 表示差异显著。
2 结果与分析
2.1 降亚硝胺乳酸菌的筛选
将分离自内蒙古传统发酵制品的16 株乳酸菌于MRS 培养基中与NAs 共培养,利用HPLC 检测亚硝胺的含量。结果如表2 所示,不同菌株的降亚硝胺能力具有特异性,与肖亚庆[13]和Kim 等[11]研究结果一致。由表可知,植物乳杆菌AL6-1 对培养基中NDMA 的去除率为27.95%,显著高于其它菌株(P<0.05),而植物乳杆菌ML2-2、植物乳杆菌37X-6 和戊糖片球菌 37X-8 对NDMA 有不同程度的促进作用,清除率分别为-1.49%,-7.11%和-5.11%,此现象与李木子[15]研究结果一致,原因是亚硝胺具有挥发性,在培养过程中NAs含量发生不同程度变化。16 株乳酸菌对NDEA 的清除率范围为-9.77%~25.23%,其中植物乳杆菌37X-6 对培养基中NDEA 的去除率显著高于其它菌株(P<0.05),为25.23%,而植物乳杆菌AL6-1、CL4-3、X3-2B、37X-11 和瑞士乳杆菌SL-1 与植物乳杆菌37X-6 的降亚硝胺能力无显著差异(P>0.05),分别为20.32%,19.14%,17.17%,19.96%和25.09%。植物乳杆菌 AL6-1 对2 种NAs 的降低率之和为48.27%,因此选取具有较高降亚硝胺能力的植物乳杆菌AL6-1 用于后续研究。
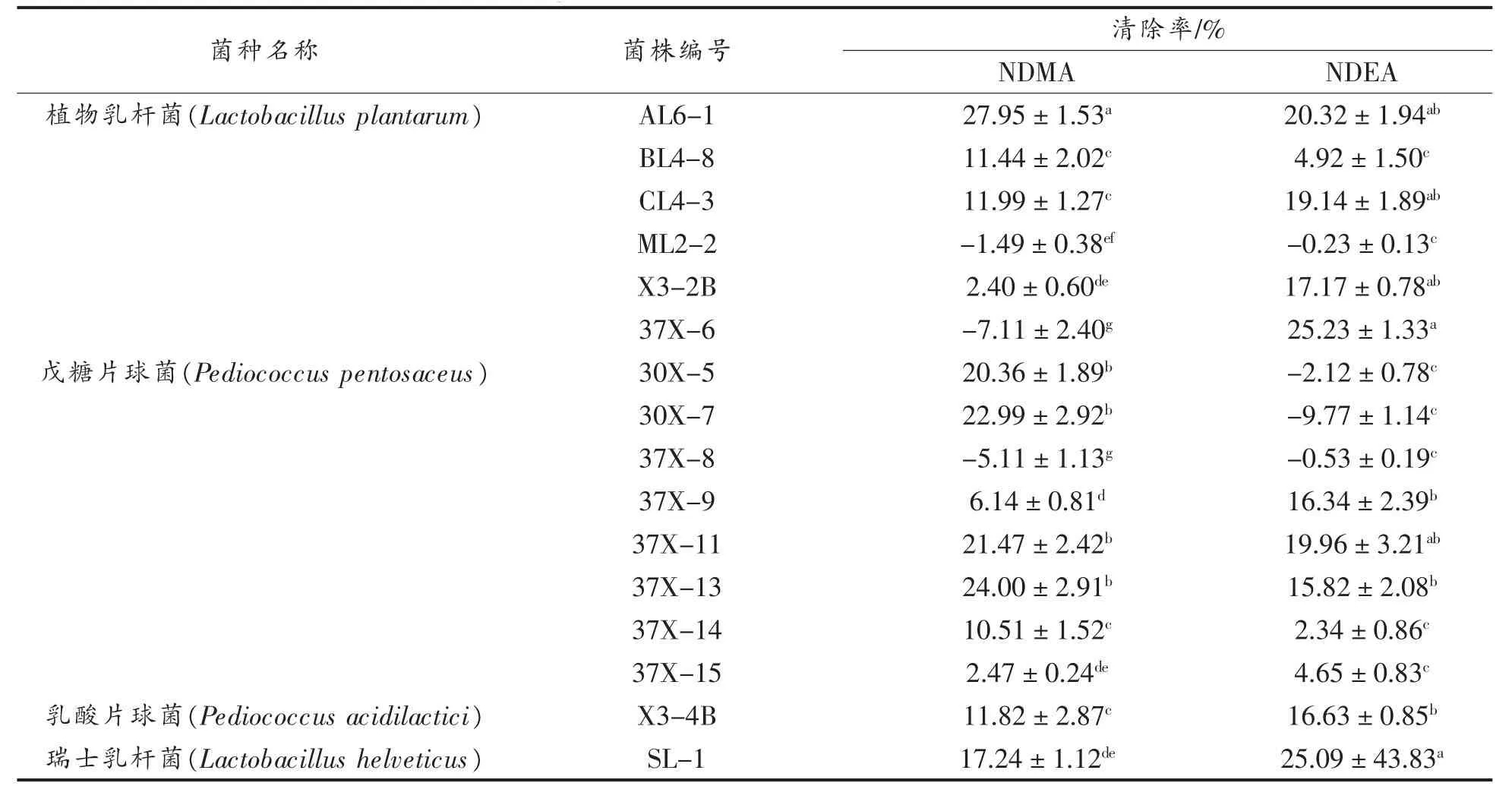
表2 不同菌株的降亚硝胺能力Table 2 Decreasing effect of different strains on concentrations of NAs
2.2 植物乳杆菌AL6-1 在正常培养和NAs 胁迫下的生长曲线
由图1 可知,在MRS 培养基中植物乳杆菌AL6-1 在接种后4 h 后迅速进入对数生长期,20 h 进入稳定期,最大生物量为OD600nm=1.75;在亚硝胺终质量浓度为1 μg/mL 的MRS 培养基中,植物乳杆菌AL6-1 的生物量低于正常条件,且20 h 内未明显进入稳定期,最大生物量为OD600nm=1.72。由此可知,亚硝胺在一定程度上可抑制植物乳杆菌AL6-1 的生长,可能由于亚硝胺具有毒性[13],导致细胞损伤,从而延长乳酸菌的迟滞期并降低对数期的生长速率。

图1 植物乳杆菌AL6-1 在正常条件和亚硝胺胁迫下的生长曲线Fig.1 Growth curves of L.plantarum AL6-1 in normal conditions and under the stress of NAs
2.3 不同环境因素对植物乳杆菌AL6-1 降亚硝胺能力的影响
2.3.1 培养时间对植物乳杆菌AL6-1 降亚硝胺能力的影响 Nowak 等[12]认为乳酸菌降低NDMA能力取决于菌株的生长期。由图2 可知,植物乳杆菌AL6-1 对NDMA 和NDEA 清除率变化趋势相同,在0~36 h,亚硝胺清除率随着时间延长呈现增长趋势,在清除时间为36 h 时,NDMA 和NDEA清除率已经趋于稳定,此时清除率分别为63.90%和61.65%,与48,72,96,120 和144 h 无显著差异(P>0.05)。推测原因可能是乳酸菌在含亚硝胺的培养体系中缓慢进入对数生长期,在36 h 到达稳定期,使其降解率达到最大值且趋于稳定,在此过程中随着乳酸菌数量增多导致亚硝胺含量急剧下降。

图2 培养时间对植物乳杆菌AL6-1 降NAs 能力的影响Fig.2 Effect of incubation time on degradation of NAs by L.plantarum AL6-1
2.3.2 初始pH 值对植物乳杆菌AL6-1 降亚硝胺能力的影响 pH 值对菌株的降解和吸附作用具有重要影响,其可以通过改变微生物的生长繁殖及酶活性影响降解能力,并在吸附过程中可对离子交换过程以及细胞壁上官能团的电离状态产生一定影响[16]。由图3 可知,在pH 3.5~7.5 时,植物乳杆菌AL6-1 对NDMA 和NDEA 均具有降NAs能力且变化趋势相同,呈先上升后下降趋势;当pH 4.5 时,亚硝胺清除率显著高于其它组(P<0.05),为37.63%,;随着pH 值的升高,亚硝胺清除率在pH 6.5 时基本趋于稳定,此时清除率为26.51%,与pH 7.5 时无显著性差异(P>0.05)。因此,可确定pH 4.5 为植物乳杆菌AL6-1 降低NAs含量的最适pH 值。孙学颖等[17]发现产品在发酵阶段pH 值可降到最低,pH 值为4.69,同时亚硝胺含量达到最低值,推测在pH 值较低条件下乳酸菌对亚硝胺起到降解作用,与本试验研究结果一致。
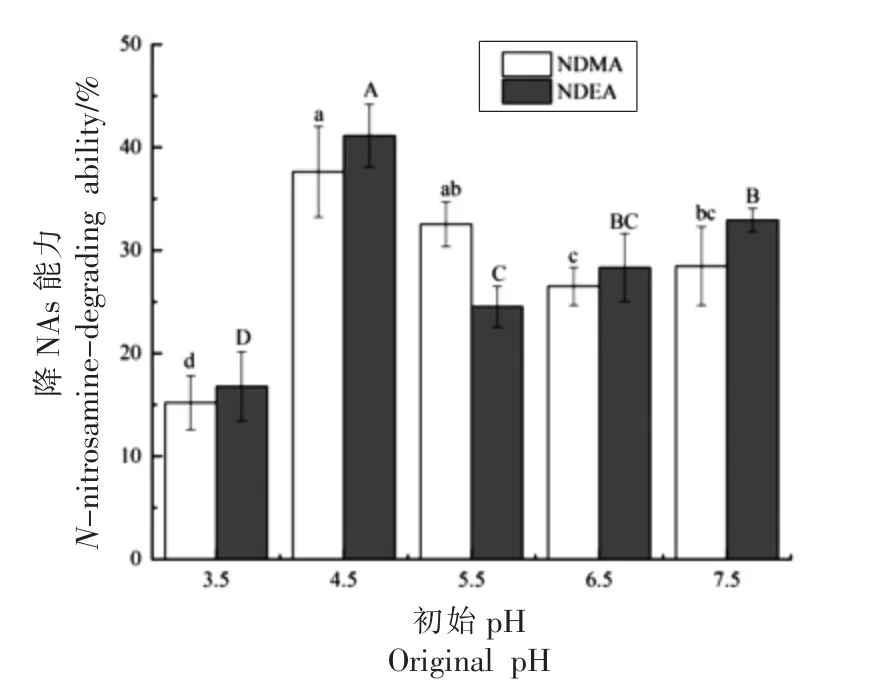
图3 初始pH 值对植物乳杆菌AL6-1 降NAs 能力的影响Fig.3 Effect of pH value on degradation of NAs by L.plantarum AL6-1
2.3.3 培养温度对植物乳杆菌AL6-1 降亚硝胺能力的影响 温度对植物乳杆菌AL6-1 降NAs能力的影响如图4 所示,在培养温度为20~45 ℃时,植物乳杆菌AL6-1 对NDMA 和NDEA 均具有降NAs 能力且变化趋势相同,呈先上升后下降趋势。当温度在20~37 ℃范围内时,NAs 清除率随着温度的升高而增长;当培养温度为37 ℃时,NDMA和NDEA 清除率分别为35.00%和28.81%,显著高于其它温度(P<0.05),可确定37 ℃为植物乳杆菌AL6-1 降低NAs 的最适培养温度;当温度高于37 ℃时,NAs 清除率显著降低(P<0.05)。原因可能是培养温度通过影响细胞膜流动性、细胞结构、细胞膜脂肪酸和蛋白质的组成及含量以及酶活性来影响乳酸菌的生长和代谢,进而影响菌株的降NAs 能力[18]。

图4 培养温度对植物乳杆菌AL6-1 降NAs 能力的影响Fig.4 Effect of incubation temperature on degradation of NAs by L.plantarum AL6-1
2.3.4 接种浓度对植物乳杆菌AL6-1 降亚硝胺能力的影响 接种浓度对植物乳杆菌AL6-1 降NAs 能力的影响如图5 所示。随着接种浓度的增加,植物乳杆菌AL6-1 对NDMA 的清除率逐步增加,当接种浓度为1010CFU/mL 时,NDMA 清除率显著高于其它组(P<0.05),为26.58%。而植物乳杆菌AL6-1 对NDEA 的清除率在接种浓度为106~108CFU/mL 范围内无显著差异(P>0.05);当接种浓度高于108CFU/mL 时,NDEA 的清除率随着接种浓度的增加而增大,当接种达到1010CFU/mL,NDEA 含量显著降低(P<0.05),其清除率为19.67%。结果显示,在一定接种浓度范围内,植物乳杆菌AL-6-1 的降NAs 能力与接种浓度之间呈正相关关系,与肖亚庆[13]的研究结果一致,因此确定接种浓度1010CFU/mL 为植物乳杆菌AL-6-1的最适接种浓度。
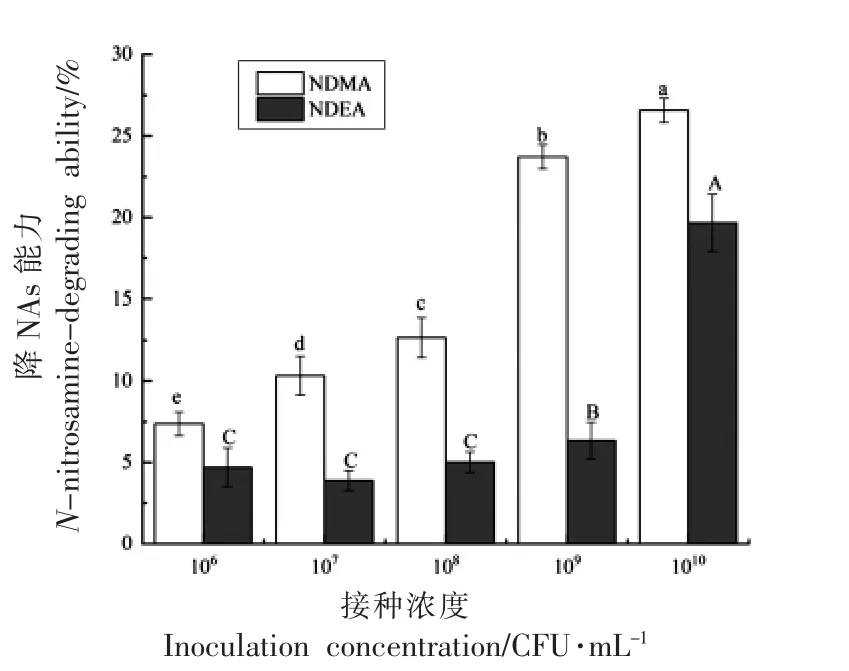
图5 接种浓度对植物乳杆菌AL6-1 降NAs 能力的影响Fig.5 Effect of inoculation concentration on degradation of NAs by L.plantarum AL6-1
2.4 不同细胞组分对植物乳杆菌AL6-1 降亚硝胺能力的影响
植物乳杆菌AL6-1 不同细胞组分对NAs 的降解作用如表3 所示,胞内提取物对NDMA 和NDEA 含量的变化趋势相同,在0~6 h 范围内亚硝胺含量随着时间增加而逐渐降低;在6 h 时,NDMA 和NDEA 含量已经趋于稳定,其含量分别为0.68 μg/mL 和0.71 μg/mL,此时降解率分别为70.28%与71.88%,显著低于0,0.5,3 h 时亚硝胺的含量(P<0.05),而与12,24,36 h 无显著差异(P>0.05),研究结果表明植物乳杆菌AL6-1 胞内酶对亚硝胺具有降解作用。肖亚庆[13]研究发现戊糖乳杆菌R3 胞内提取液对NAs 具有一定降解作用,但降解能力不显著(P>0.05)。Nowak 等[12]发现胞内提取液可降低NAs 含量,并且菌株可以将NDMA作为氮源利用。Grill 等[19]研究发现双歧杆菌BB536 的胞内提取物具有降低亚硝胺含量的能力,且热变性后未观察到亚硝胺含量变化,结果表明胞内提取液中的酶反应参与了亚硝胺的降解过程,与本试验研究结果一致。由以上分析可知植物乳杆菌AL6-1 胞内提取液的降解作用可能是其清除NAs 的主要途径。

表3 胞内提取液对NAs 的降解作用Table 3 Degrading effect of different cell components on concentrations of NAs
植物乳杆菌AL6-1 胞外代谢物对NAs 清除效果在36 h 内无显著差异。NAs 与胞外代谢物共培养36 h 后,NDMA 和NDEA 含量分别为0.97 μg/mL 和0.90 μg/mL,表明植物乳杆菌AL6-1 通过代谢作用所产生的胞外代谢物不能降解亚硝胺。
灭活后的植物乳杆菌AL6-1 细胞壁与NAs共培养36 h,在0 h,培养体系中NDMA 含量显著低于胞内提取物与胞外代谢物(P<0.05),为0.93 μg/mL,对NDEA 含量无显著影响(P>0.05);在0~36 h,培养体系中NDMA 和NDEA 含量范围分别为0.91~0.93 μg/mL 和0.93~0.96 μg/mL,无显著差异(P>0.05),表明植物乳杆菌AL6-1 细胞壁可在短时间内吸附NDMA,吸附率为4.12%。
3 结论
本试验利用HPLC 筛选具有高效降亚硝胺能力的菌株,并揭示其降解特性及机理。研究结果表明植物乳杆菌AL6-1 具有高效降亚硝胺能力,在亚硝胺终质量浓度为1 μg/mL 的共培养体系中NDMA 和NDEA 的降解率分别为27.95%和18.32%;且植物乳杆菌AL6-1 降解能力受不同环境因素的影响,确定其最佳培养时间为36 h,最适pH 值为4.5,最适温度为37 ℃,最佳接种浓度为1010CFU/mL;通过研究植物乳杆菌AL6-1 胞内酶提取液、胞外代谢物及细胞壁对NAs 含量的影响,发现清除NAs 主要是通过胞内提取液的降解作用,在6 h 时,NDMA 和NDEA 降解率分别为70.28%与71.88%,且细胞壁对NAs 有一定的吸附作用。本研究为该菌株能进一步应用于食品中降低亚硝胺含量提供重要参考依据。

