驼乳对小鼠急性酒精性肝损伤的干预作用
其布勒,吉日木图,2,明 亮,2*
(1 内蒙古农业大学乳品生物技术与工程教育部重点实验室 呼和浩特 010018 2 内蒙古骆驼研究院 内蒙古阿拉善 750306)
肝脏是人体最重要的代谢器官,也是酒精代谢的中心,超过80%的摄入酒精在肝脏代谢[1]。随着酒精消费的增加,酒精性肝病(ALD)的发病率越来越高,已成为一个严重的健康问题,引起了全世界的关注[2]。根据肝损伤的严重程度,酒精性肝病包括酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化、酒精性肝硬化和酒精性肝癌[3]。研究ALD 的发病机制对治疗及干预病情的发展具有重大意义[4]。
骆驼是荒漠地带的一种特有畜种,对荒凉、贫瘠、严酷的荒漠环境具有较强的适应能力,也造就了驼乳“沙漠白金”的美称;其营养成分独特,含有丰富的蛋白质、不饱和脂肪酸以及磷、钙、钾等矿物质元素和维生素B、C、E 等营养成分,易于消化吸收,是有较高的营养价值和食疗保健作用的饮品[5-8]。此外,驼乳还含有高水平的生物活性物质,如乳过氧化物酶、免疫球蛋白G(IgG)、分泌性免疫球蛋白A(SIgA)、乳铁蛋白、溶菌酶、胰岛素、类胰岛素生长因子等,使其具有优异的抗氧化和抗菌活性[9-10]。有研究表明,驼乳及其成分还具有其它潜在的功能特性,如抗致癌[11-12]、抗糖尿病[13]、抗高血压[14]和肾保护潜力[15-16]。
目前,驼乳的功用价值已引起世界各地研究人员的极大关注。为进一步探索驼乳对酒精所致肝损伤的改善作用,本研究以ICR 小鼠建立急性酒精肝损伤的动物模型,通过给酒精性肝损伤小鼠灌胃驼乳,研究其对肝损伤的预防作用。采用比较转录组学技术探究驼乳对急性酒精性肝损伤的分子调控机制,旨在为利用驼乳开发保肝功能食品或膳食补充剂提供参考。
1 材料与方法
1.1 材料与试剂
清洁级(SPF)雄性ICR 小鼠,由北京维通利华实验动物中心提供。
谷丙转氨酶(ALT)试剂盒、谷草转氨酶(AST)试剂盒,南京建成生物有限公司;总RNA 提取试剂盒,Life Technologies 公司;反转录试剂盒,Thermo Fisher Scientific 公司;扩增试剂盒,Luna公司;肿瘤坏死因子(TNF-α)、白介素-6(IL-6)、白介素-10(IL-10)、白介素-1β(IL-1β)试剂盒,上海酶联生物有限公司。
1.2 仪器与设备
酶标仪、荧光定量PCR 仪,美国Thermo 公司。
1.3 方法
1.3.1 实验动物分组及处理 实验小鼠经过1 周适应性喂养后,将其随机分为4 组,正常组(NC)、模型组(ET)、驼乳组(CM)、驼乳干预组(ET+CM),每组10 只。CM 和ET+CM 组均按6 g/kg 的剂量灌胃驼乳,NC 组和ET 组给予同体积蒸馏水灌胃,连续14 d。于末次灌胃后禁食不禁水6 h,除NC 组和CM 组灌胃蒸馏水外,其它2 组均给予50%酒精(7.3 g/kg bw)。6 h 后,眼眶取血,3 000 r/min、4℃离心20 min 取上清液,分装贮于-80 ℃保存备用。然后,颈椎脱臼处死小鼠,迅速摘取肝脏组织,置于-80 ℃保存备用。
1.3.2 冻干驼乳粉的制备 新鲜驼乳经3 500 r/min 离心40 min 脱脂,然后进行真空冷冻干燥,密封保存,备用。试验开始后,按6 g/kg 灌胃计量,以CM 组和ET+CM 组小鼠平均体重按照m0计,每次灌胃量0.3 mL,需要配制质量浓度为2m0×10-2g/mL 脱脂驼乳粉溶液,组内个体体质量为m(g)小鼠灌胃驼乳粉体积按照下列公式进行计算:
1.3.3 肝组织中ALT 和AST 指标的测定 将9倍体积的生理盐水加入肝组织中,并将肝组织在冰水浴中匀浆。将制备的匀浆在4 ℃下以3 000×g离心20 min,取上清液进行测定。根据试剂盒方法测定肝组织中ALT 和AST 水平。
1.3.4 血清中TNF-α、IL-10、1L-6 和IL-1β 含量的测定 用离心管收集小鼠血清,静置2 h 后3 000×g 离心20 min,取上清按照试剂盒方法测定TNF-α、IL-10、1L-6 和IL-1β 含量。
1.4 肝脏组织RNA 提取及cDNA 文库构建
根据试剂盒(RNAiso Plus 试剂盒和RNeasy Mini 试剂盒)的操作流程提取小鼠肝组织总RNA,所得总RNA 经Agilent Bioanalyzer 2100 电泳质检合格后,连接有Oligo(dT)的磁珠富集真核生物mRNA。然后将mRNA 随机大段成短片段为模板进行第一链和第二链cDNA 的合成并使用RNAClean XP Kit 和RNase-Free DNase Set 纯化;修复黏性末端为平末端并在3 末端加碱基A并加接头,最后进行PCR 扩增获得最终测序文库。由Agilent 2100 确定文库大小后,使用Illumina HiSeq平台对cDNA 文库进行测序。测序部分由上海美吉生物医药科技有限公司完成。
1.5 转录组数据处理及分析
为了得到高质量数据,首先采用fastx_toolkit_0.0.14 软件对原始数据(Raw Reads)进行质控。将质控后的原始数据(clean data 或Clean reads),与参考基因组(Mus musculus.GRCm38.p,http://www.ensembl.org/Mus_musculus/Info/ Index)比对,然后用FPKM 法将影响计算基因表达的基因长度和测序量差异进行标准化处理,使用RSEM 计算各个样品的基因表达水平,并用edgeR 方法进行组间差异表达分析。根据差异基因检测结果,对候选基因进行GO 和KEGG 富集分析。
1.6 实时荧光定量PCR 验证相关差异基因
采用TRIzol 法提取小鼠肝组织当中总RNA,RNA 样品符合要求(OD260nm/OD280nm=1.8~2.2)。使用Nanodrop 检测RNA 纯度和浓度。采用UEIris ⅡRT-PCR System for Fist-Strand cDNA Synthesis试剂盒进行反转录,产物cDNA 稀释10 倍用于qPCR 模板。根据SYBRPremix Ex TaqTMII(Tli RNaseH Plus)说明书进行定量检测,反应体系20 μL:cDNA 2 μL,TB 溶液10 μL,正/反向引物各0.8 μL,无菌水6.4 μL,将样品混合均匀于96孔板,上机运行。其运行条件为:95 ℃30 s,95 ℃5 s,57 ℃30 s,72 ℃30 s,40 个循环。本研究所用引物基因序列由上海生工生物工程有限公司合成,引物序列如表1 所示。通过2-ΔΔCt法计算mRNA 的表达,以β-actin 为内参,与正常组做比值,根据样本CT 值计算各基因相对表达量,以溶解曲线判断PCR 产物是否具有特异性。

表1 引物序列Table 1 Primer sequence
1.7 数据统计与分析
本研究所有数据均以平均值±标准差表示,并由GraphPad prism 5.03 进行分析并绘图。所有组之间的比较采用单向方差分析(ANOVA)检验。根据Bonferroni 事后检验计算出显著差异。P<0.05被认为具有统计学意义。
2 结果与分析
2.1 驼乳对肝损伤小鼠肝组织AST 和ALT 的影响
ALT 和AST 是临床上常用的肝功能评价指标,其水平反映了肝细胞损伤程度。如图1a、1b 所示,与NC 组相比,ET 组小鼠肝组织中的AST 和ALT 酶活力显著升高(P<0.05),说明ALD 小鼠建模成功。与ET 组相比,ET+CM 组的AST 和ALT酶活力显著降低(P<0.05),表明驼乳不同程度的抑制了肝组织中该两种酶的活性,从而有效缓解酒精引起的肝损伤。此外,NC 与CM 组之间没有显著统计学差异。

图1 驼乳对肝损伤小鼠肝组织AST 和ALT 的影响Fig.1 Effect of camel milk on AST and ALT of liver tissue in mice with liver injury
2.2 驼乳对急性酒精性肝损伤小鼠炎症反应的影响
酒精进入机体后,激活kuffer 细胞释放IL-10、IL-6、IL-1β 和TNF-α 等炎症因子,导致炎症反应,从而加重酒精性肝损伤。为了评估驼乳的抗炎作用,测定了血清中IL-10、IL-6、IL-1β 和TNF-α 水平。结果如图2 所示,与NC 组相比,ET组的TNF-α、1L-6 和IL-1β 水平显著升高(P<0.05),IL-10 含量显著降低(P<0.05),表明酒精暴露可诱导小鼠肝细胞发生炎性损伤。与ET 组相比,ET+CM 组小鼠血清中TNF-α、1L-6 和IL-1β水平显著降低(P<0.05),IL-10 含量显著升高(P<0.05),表明驼乳会产生大量抗炎因子来抑制酒精诱导的炎症反应,从而改善急性酒精性肝损伤。

图2 驼乳对急性酒精性肝损伤小鼠炎症反应的影响Fig.2 Effect of camel milk on inflammatory response in mice with acute alcoholic liver injury
2.3 转录组测序数据及比对分析
本测序的12 个样本的质量和比对统计表如表2 所示,各样本测序共得到5 160 万条raw reads,然后进行过滤后共得到5 124 万clean reads。在获得的clean reads 中,所有样本能定位到基因组上的比率高于93%,然后在参考序列上有唯一比对率达到84%以上。测序结果表明,RNA测序数据的质量控制良好,可进行后续生物信息学分析。
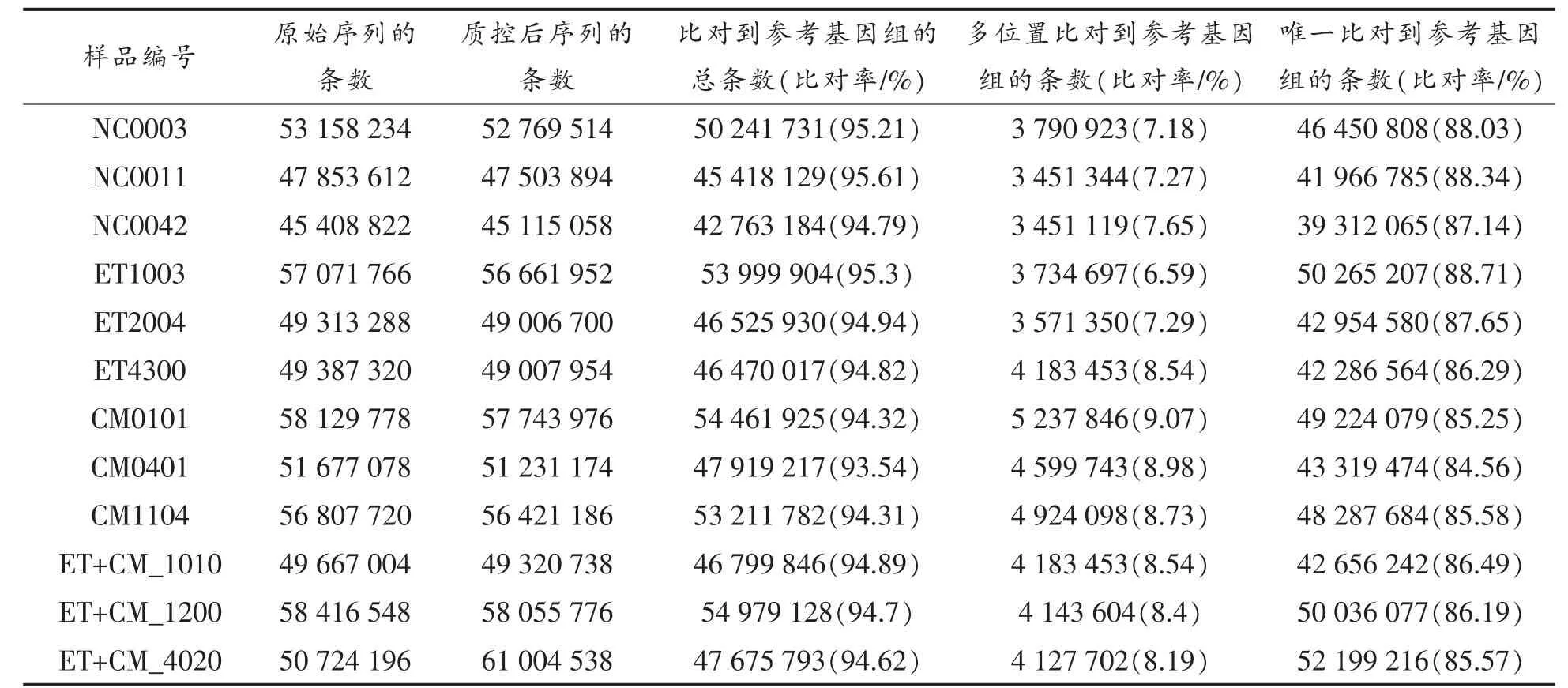
表2 样本质量和比对结果Table 2 Sample quality and comparison results
2.4 驼乳干预下小鼠转录组基因表达的差异性分析
如图3 所示,NC 组共检测出10 929 个基因,ET 组测出11 170 个基因,CM 组11 026 个基因,ET+CM 组10 750 个基因。

图3 基因量化维恩图Fig.3 Gene quantification Venn diagram
采用edgeR 对差异基因进行筛选,筛选条件为差异倍数(log2 fold change)>1,P<0.05。结果如图4 所示,NC 组与ET 组相比,共检测出4 105 个差异基因,其中2 250 个基因上调,1 855 个基因下调。ET 组与ET+CM 组相比,筛选到1 426 个基因,其中673 个基因上调,753 个基因下调。NC 组与ET+CM 组相比,共检测出3 958 个差异基因,其中1 748 个基因上调,2 210 个基因下调。NC 组与CM 组相比较,共检测出2 368 个差异基因,其中891 个基因上调,1 477 个基因下调。

图4 两组间差异基因表达统计图Fig.4 Statistical graph of differential gene expression between the two groups
2.5 驼乳干预下小鼠转录组差异表达基因的功能分析
为了进一步了解差异表达基因的功能,确定其在分子水平上的作用,针对差异表达基因进行功能分析,发现各功能的基因注释数目有明显差异。结果如图5 所示,在生物过程中,NC 与ET 组和ET+CM 与ET 组差异基因注释到细胞过程的最多,分别为2 986、973 条。在细胞组分中,注释到细胞部分的最多,分别为3 435、1 148 条。在分子功能中,注释到结合的基因最多,分别为3 049、1 053 条。进一步进行GO 富集分析,发现NC 组与ET 组的差异基因主要参与炎症反应、脂质代谢、氧化应激、脂多糖反应等生物学过程。ET组和ET+CM 组的差异表达基因主要参与炎症反应、脂多糖反应、含氧化合物的反应、细胞因子的反应、脂质代谢过程、白细胞迁移等生物学过程,结果如表3 所示。

图5 组间GO 注释图Fig.5 GO annotation diagram between groups

表3 ET 组与ET+CM 组差异基因GO 富集分析Tabel 3 Significant terms of GO analysis for ET vs ET+CM differential gene
进一步,将差异表达基因进行了KEGG 功能富集分析。NC 与ET 组的差异基因显著富集在MAPK 信号通路(92 个差异基因)、Insulin resistance(44 个差异基因)、AMPK 信号通路(44 个差异基因)、Pathways in cancer(146 个差异基因)等。ET 与ET+CM 组差异基因显著富集在MAPK信号通路(24 个差异基因)、Oxidative phosphorylation(22 个差异基因)、NF-κB 信号通路(14 个差异基因)、Toll-like(11 个差异基因)等。下面主要对ET 与ET+CM 组富集在MAPK、Toll-like 和NF-κB 通路上的差异基因进行分析,找出驼乳干预急性酒精性肝损伤的关键基因。
在MAPK 信号通路中,低表达的白细胞分化抗原14(CD14)基因表明了驼乳参与了ALD 小鼠的免疫应答,低表达的IL-1R1、TNFR1 基因表明了驼乳调节ALD 小鼠的炎症因子,低表达的ERK1/2、JIP3、TGFβ、TGFβR、ATF-2、PIK3R1 基因表明了驼乳通过抑制细胞分化或凋亡从而调控ALD 小鼠的免疫应答。
在Toll-like 信号通路中,低表达的IL-1R1、IL-6、TNFR1、TLR5 和TLR9 基因表明了驼乳产生大量抗炎因子从而抑制ALD 小鼠的炎症反应,低表达的CD14 基因表明了驼乳参与了ALD 小鼠的免疫调节,ERK1/2 和PIK3R1 基因表明了驼乳通过抑制细胞分化或凋亡从而调控ALD 小鼠的免疫应答。
在NF-κB 信号通路中,低表达的CXCL1、IL-1R1、TNFR1 表明了驼乳调节ALD 小鼠的炎症因子,Bcl2a1d 基因表明了驼乳通过抑制细胞分化或凋亡从而调控ALD 小鼠的免疫应答。
2.6 转录组差异表达基因的验证
为了验证转录组测序的准确性以及确定驼乳对酒精性肝损伤的保护作用是否与MAPK、Tolllike 和NF-κB 炎症通路相关,选取CD14、TLR5、TLR9 等6 个代表性差异基因进行了实时荧光定量PCR 测定。结果如图7 所示,与NC 组相比,ET组的CD14、IL-1β、IL-6、TLR5 和TLR9 表达量显著上升(P<0.05),IL-10 表达量显著降低(P<0.05)。与ET 组相比,ET+CM 组的CD14、IL-1β、IL-6、TLR5 和TLR9 表达量显著降低(P<0.05),IL-10 表达量显著升高(P<0.05)。说明驼乳通过调控MAPK、Toll-like 和NF-κB 通路上的基因,缓解急性酒精性肝损伤。

图7 差异基因表达量Fig.7 Differential gene expression
3 讨论
肝脏是人体最重要的代谢器官,通过吞噬和解毒功能对机体起保护作用。摄入大量酒精会导致肝脏出现一系列损害性病变。如何安全有效的预防和治疗酒精性肝病已成为各国科研人员的研究热点。大量研究表明,ALD 的发病机制与乙醇及其代谢物对肝脏的毒性、脂质代谢紊乱、氧化应激、炎症介质、免疫反应等多种因素有关[17-18]。此外,酒精诱导的肝损伤发生在多个层面,从先天免疫细胞到肝实质细胞、肝细胞,该过程需要多条肝细胞信号通路的相互作用[19]。ALT 和AST 是评估肝细胞损伤的重要指标之一,通过测定肝组织中ALT 和AST 活性可以判断肝损伤程度。炎症反应是导致酒精性肝损伤的典型病理机制。IL-10 是一种抗炎和免疫抑制细胞因子,TNF-α 是一种促炎细胞因子,主要由巨噬细胞和单核细胞产生,参与炎症和免疫反应过程。IL-6 是一种同时促进炎症和肝再生的多效性细胞因子,主要调节抗凋亡基因转录和肝再生。IL-1β 通过诱导中性粒细胞趋化因子,加重炎症反应。因此,通过测定血清IL-10、TNF-α、IL-6 和IL-1β 水平综合分析肝脏因炎症反应发生的损伤程度。结果表明,驼乳不仅可以显著降低肝组织中AST 和ALT 水平、还可以显著降低血清中TNF-α、IL-6 和IL-1β 水平,提高IL-10水平。表明驼乳能够抑制酒精引发的炎症反应,发挥对肝脏的保护作用。
基于生化指标测定结果,进一步研究驼乳改善酒精性肝损伤的作用机制,对各组小鼠肝组织进行转录组测序,NC 与ET 组共获得4 105 个差异基因,ET 与ET+CM 组共获得1 426 个差异基因,挑选6 个差异基因经实时荧光定量PCR 验证,结果与测序结果表达一致,说明了本次测序结果准确可靠。在差异表达基因的GO 富集分析中发现,ET 与ET+CM 组大多数差异基因显著富集到免疫炎症相关的功能上,如基因CXCL1 和CD14 分别富集到GO term 的免疫应答和细胞对脂多糖的反应,且共同富集到炎症反应。
在KEGG 富集分析中,ET 与ET+CM 组差异基因显著富集到MAPK、Toll-like、NF-κB 信号等免疫炎症相关的信号通路。已有的研究表明,Tolllike 信号通路与MAPK 信号通路和NF-κB 信号通路密切相关,通过抑制Toll-like 信号通路,可以进一步抑制MAPK 信号通路和NF-κB 信号通路,从而缓解酒精引发的一系列病理反应,发挥对肝脏的保护作用[20]。丝裂原活化蛋白激酶(MAPK)在细胞凋亡和炎症因子信号传递过程中起着重要的作用。主要包含细胞外信号调节激酶(ERK)、c-Jun 氨基末端激酶(JNK)和p38 MAPK 这3 条途径[22]。本研究结果显示,在ET 组中起到信号传导作用的基因ERK 表达显著上调,效应因子TNFR1、JIP3、ATF-2 和TGF-β 基因表达上调,而经驼乳预处理后均显著下调。MAPK1(ERK2)和MAPK3(ERK1)是与细胞增殖、转化、分化相关的MAPK[22]。MAPK 被酒精刺激后可释放炎性因子TNF-α,进而加剧炎症反应[23]。TNF-R1 作为TNFα 受体,与TNF-α 结合经一系列反应形成多种复合物激活JNK[24-25],被激活的JNK 靶向JIP3(JNK信号通路上的支架蛋白)、ATF-2 参与Toll-like 受体(TLR)的调控,TLR 识别炎性细胞因子,发生炎症反应[26]。本研究中,驼乳降低了酒精引发的TNF-R1、JIP3 和ATF-2 的高表达。研究表明,敲除JIP3 基因可降低氧化应激和炎性反应,从而改善NAFLD 小鼠肝损伤[26]。此外,Stebbins 等[27]发现通过抑制JNK-JIP 位点以剂量依赖性方式抑制JNK 底物的磷酸化,从而阻断肝损伤。Deng 等[28]研究表明,JNK 基因敲除降低了HCC 细胞在体外的侵袭和淋巴黏附能力,同时在基因和蛋白质水平下调了ATF-2 的表达,认为ATF-2 是肝癌预后的潜在标志物。由此可知,驼乳通过调控MAPK 信号通路,改善酒精引发的炎症反应以及肝细胞凋亡和损伤。
近期研究表明,除TLR3 和IL-1 受体外,所有TLR 均以MyD88 作为衔接分子,激活NF-κB 和MAPK 通路[29]。本研究结果显示,摄入酒精使Tolllike(CD14、TLR5、TLR9、ERK1/2、PIK3R1)和NFκB 信号通路(CXCL1、TNFR1、IL-1R1、Bcl2a1)基因的显著上调,而在ET+CM 组中均显著下调。此外,本研究PCR 结果表明驼乳干预显著降低CD14、TLR5、TLR9 的表达。据文献报道,TLR9 信号的激活可诱导肝细胞产生CXC 趋化因子配体1(CXCL1),从而诱导中性粒细胞进入肝脏[30]。CXCL1 是炎性趋化因子,可促进炎症因子释放并加重炎症反应[31]。在免疫相关的差异基因中,我们还关注到重要的促炎因子IL-6,它与可溶性IL-6 受体结合,然后与膜受体b 链gp130 结合,激活PI3K/Akt 通路。而PIK3R1 是PI3K 的调节亚基,所以驼乳通过抑制炎症因子IL-6 的产生间接抑制PIK3R1 的表达。赵宏等[32]发现巴亚格七味散可通过抑制PIK3R1 表达,来减轻酒精性肝病模型小鼠肝组织损伤。还发现肝癌中PIK3R1 表达显著上调,沉默PIK3R1 可抑制HCC 细胞系增殖、迁移并加速凋亡[33]。IL-1 家族是一个重要的促炎因子家族,可导致炎症并与急性和慢性炎症密切相关。IL1R1 作为IL-1 的受体,能够介导IL-1 的级联反应,激活JNK/c-Jun 和NF-κB p65 信号通路并加重炎症反应程度[34]。研究表明,肝细胞中缺失IL-1R1 可保护小鼠免受急性肝衰竭,降低肝脏炎症细胞因子和趋化因子水平,以及减轻中性粒细胞因损伤而渗入肝脏[35]。本研究结果如上所述,驼乳能够调控Toll-like 和NF-κB 信号通路抑制酒精诱导的细胞凋亡和肝脏炎症反应,从而保护肝脏免受酒精的损伤。
4 结论
本研究表明,驼乳能够有效降低肝脏中AST、ALT 的酶活力并可以降低血清中IL-6、IL-1β、TNF-α 水平,提高IL-10 水平。然后通过生物信息学分析,发掘出驼乳干预急性酒精性肝损伤的显著差异表达基因和重要的免疫炎症信号通路以及免疫应答关键基因,为预防酒精性肝损伤研究提供了新的视角,为进一步研发保肝护肝功能性食品奠定了理论基础。

