安罗替尼联合PD-1单抗治疗Lewis肺癌的动物实验研究*
陈 熙,赵晓龙,饶 文,杨宇馨,代晓燕,熊艳丽,戴 楠,王 东△
(1.陆军军医大学陆军特色医学中心/大坪医院肿瘤科,重庆 400042;2.重庆市渝北区人民医院肿瘤血液科 401120;3.解放军第956医院外一科,西藏林芝 860000;4.陆军第75集团军医院感染科,云南大理 671003)
肺癌是癌症死亡的主要原因,占全球癌症死亡总数的18.0%[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌中最主要的类型,约占所有肺癌的85%[2]。大部分的NSCLC患者在确诊时已经属于晚期,失去了手术根治的机会,总体预后较差[3]。2022年中国和美国癌症统计数据估计,肺癌将成为中美两国男性和女性的最大死因[4]。近20年来,靶向治疗与免疫治疗进展迅速,晚期NSCLC的诊疗方案也逐步走向精准化[5]。以表皮生长因子受体(epidermal growth factor receptor,EGFR)-酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)为主的靶向治疗已成为驱动基因突变患者公认的一线治疗方案;而对于驱动基因阴性的患者来说,以免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)为代表的免疫治疗联合化疗则是指南推荐的一线标准治疗模式之一。同时,为了减少化疗的不良反应,临床上也期待部分人群能够使用“Chemo-free”的治疗方案以实现高效低毒的肿瘤治疗目标。基于上述需求,研究者们开展了多项基础和临床研究,以期探索更有效的联合治疗方案,其中,抗血管生成药物联合免疫治疗就是当前研究的热点,也是最具潜力的方案之一。
从机制上来看,新生血管是肿瘤生长和转移的重要过程[6],抗血管生成治疗已被公认为一种有效的肿瘤治疗模式[7]。安罗替尼作为一种新型的抗血管生成药物,是一种口服的小分子TKI,可针对血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)1、VEGFR2/KDR、VEGFR3、c-Kit、血小板源生长因子受体(platelet-derived growth factor receptor,PDGFR)-α和成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)1、FGFR2和FGFR3等多个靶点,具有更广泛、更有效的抗肿瘤效应[8]。2020年我国学者通过对结肠癌、肾癌和肺腺癌患者的组织标本检测和小鼠实验,发现安罗替尼可下调肿瘤组织血管内皮细胞的程序性死亡受体1(PD-1)表达,影响CD8+T细胞浸润从而抑制肿瘤生长[9]。随后,在一项小样本量的回顾性研究中,发现26例晚期肿瘤患者(肺癌、胆囊癌、子宫内膜癌、胃癌、胰腺癌、阴茎癌和黑色素瘤)进行安罗替尼联合ICIs的一线至三线治疗,患者均可获得一定疗效且对药物不良反应耐受性良好[10]。但安罗替尼联合ICIs的机制及对肿瘤组织免疫微环境和全身免疫状态的影响尚未完全清楚。本实验利用安罗替尼联合PD-1单抗处理Lewis肺癌荷瘤小鼠,在证实联合治疗疗效的同时,进一步探索联合治疗对免疫微环境的影响及其相关机制,现报道如下。
1 材料与方法
1.1 材料
C57BL/6雌性小鼠(6~8周龄)购自陆军特色医学中心实验动物中心,小鼠Lewis肺癌细胞(lewis lung cancer,LLC)购自中科院细胞库。胎牛血清、DMEM高糖培养基、胰蛋白酶等细胞培养试剂和基质胶均购自美国Corning公司;免疫组织化学相关抗体购自北京中杉金桥生物技术有限公司;免疫组织化学抗原修复缓冲液乙二胺四乙酸购自福州迈新生物技术开发有限公司;安罗替尼由正大天晴药业集团(中国南京)提供;注射用小鼠PD-1单抗(克隆RMP1-14)购自美国BioXCell公司;CD4(批号ab183685)、CD206(抗甘露糖受体抗体,批号ab64693)、CD68(批号ab283654)、CD31(批号ab-28364)购自美国Abcam公司;CD8(批号98941)购自美国CST公司;辣根过氧化物酶标记的小鼠/兔通用型二抗(批号SAP-9100)购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1细胞培养
将冻存的LLC在37 ℃的水浴锅中快速振荡解冻后在无菌台上进行操作,加入含10%胎牛血清的DMEM高糖培养基后离心,弃上清液,加入适量DMEM培养基,吹打混匀后得到细胞悬液,置于细胞培养箱(37 ℃,5% CO2)。当培养皿中的细胞密度达到80%~90%时,按1∶2的比例进行细胞传代培养。收集细胞并计数,用于构建LLC小鼠移植瘤模型。
1.2.2LLC小鼠移植瘤模型
提前备好基质胶,将收集好的LLC用磷酸盐缓冲液稀释重悬后计数,得到浓度为1×107个/mL细胞悬液,将细胞悬液与基质胶按照1∶1比例充分混匀,取100 μL上述混悬液(含5×105个细胞)用注射器在小鼠左后肢内侧腹股沟处皮下接种。
1.2.3实验分组与处理
小鼠成瘤率超过50%时将其分为对照组、安罗替尼组、PD-1单抗组、联合组,每组5只。给药方式:安罗替尼组每天灌胃安罗替尼(2.25 mg/kg),给药12 d;PD-1单抗组于第1、3、5、7天腹腔注射PD-1单抗(10 mg/kg);对照组灌胃和腹腔注射同等剂量生理盐水。给药期间每天观察小鼠情况,在第13天收集各组荷瘤小鼠眼球血,颈椎脱臼处死,完整切取皮下移植瘤。肿瘤组织用电子天平称取质量,并按以下公式计算抑瘤率:抑瘤率(%)=(对照组平均瘤质量-给药组平均瘤质量)/对照组平均瘤质量×100%。
1.2.4免疫组织化学
小鼠肿瘤组织用4%甲醛固定,石蜡包埋,4 μm切片,置于60 ℃孵箱中3 h,采用二甲苯、无水乙醇、95%乙醇、75%乙醇脱蜡水化。切片于缓冲液乙二胺四乙酸中抗原修复10 min,置入3%过氧化氢-甲醇溶液中浸泡15 min,磷酸盐缓冲液洗3次,每次5 min,晾干后加入山羊血清封闭30 min,之后滴加一抗如下:CD4使用时按照1∶1 000稀释,CD8使用时按照1∶300稀释,CD206使用时按照1∶5 000稀释,CD68使用时按照1∶100稀释,CD31使用时按照1∶50稀释;将滴加抗体的切片放入切片盒,置于4 ℃冰箱过夜。次日取出切片盒,常温下复温1 h,并用磷酸盐缓冲液洗3次,每次3 min。迅速滴加辣根过氧化物酶标记的小鼠/兔通用型二抗,置于37 ℃孵箱,30 min后取出,磷酸盐缓冲液洗2次,每次5 min。滴加DAB显色,冲洗后用苏木素复染,脱水封片、显微镜观察并拍照。
1.2.5免疫细胞和微血管密度(microvessel density,MVD)计数
在显微镜高倍镜(200×)下对每张切片的染色区域采集4个视野图片,计数每张图片阳性细胞数量后取平均值,即为CD4、CD8、CD68、CD206阳性细胞数。CD31阳性染色定位于血管内皮细胞细胞质和/或细胞膜,呈棕黄色颗粒。肿瘤间质区任何黄染的细胞或细胞簇即使未显示管状结构均计为1个微血管,内径>8个红细胞或有较厚肌层的血管不计数为微血管。在低倍镜下选取3个肿瘤微血管最丰富的区域,计算单位面积下微血管的数目,取平均值作为MVD。
1.2.6细胞因子检测
采用Raybiotech细胞因子芯片试剂盒,按照说明书流程检测,简要步骤如下:将血清4 ℃,10 000 r/min,离心10 min,将上清液2倍稀释后取100 μL行芯片检测。取芯片,每孔加入100 μL封闭液,室温下封闭30 min。移除封闭液,加入稀释后的样品,4 ℃过夜。Wash Buffer洗涤后,加入Biotin-Antibody Cocktail,孵育2 h,洗涤。加入Cy3-Streptavidin,避光混匀,室温孵育1 h,洗涤后采用Agilent SureScan Dx Microarray Scanner芯片扫描仪,532 nm扫描芯片。
1.3 统计学处理
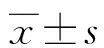
2 结 果
2.1 安罗替尼联合PD-1单抗明显抑制LLC的生长
与对照组比较,安罗替尼组和联合组移植瘤质量明显减少,安罗替尼组低于PD-1单抗组(P<0.05),见图1。PD-1单抗组、安罗替尼组和联合组抑瘤率分别为-15.35%、73.91%和86.96%。

A:LLC小鼠移植瘤大体;B:肿瘤质量;a:P<0.05;ns:P>0.05。图1 各组小鼠移植瘤生长情况
2.2 安罗替尼联合PD-1单抗对LLC移植瘤组织免疫细胞浸润的影响
与对照组比较,CD4、CD8水平在安罗替尼组、PD-1单抗组和联合组有不同程度升高,且联合组CD4水平较PD-1单抗组升高,CD8水平较安罗替尼组升高(P<0.05)。与对照组比较,CD68水平在安罗替尼组和联合组有不同程度升高(P<0.05)。与对照组比较,CD206水平在PD-1单抗组和联合组有不同程度降低,且PD-1单抗组低于联合组(P<0.05),见图2、3。
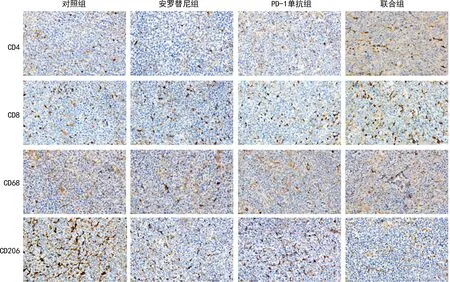
图2 各组LLC小鼠移植瘤组织CD4、CD8、CD68、CD206染色浸润代表图(免疫组织化学染色,200×)

A:CD4+T细胞计数;B:CD8+T细胞计数;C:CD68+巨噬细胞计数;D:CD206+巨噬细胞计数;1:对照组;2:安罗替尼组;3:PD-1单抗组;4:联合组;a:P<0.05。图3 各组LLC小鼠移植瘤组织CD4、CD8、CD68、CD206免疫组织化学染色阳性细胞数
2.3 安罗替尼联合PD-1单抗对血管生成的影响
与对照组比较,安罗替尼组和联合组新生血管、MVD减少(P<0.05),见图4。

A:CD31(免疫组织化学染色,200×);B:各组MVD比较;a:P<0.05。图4 各组CD31免疫组织化学染色情况及MVD比较
2.4 安罗替尼联合PD-1单抗影响血清中细胞因子的水平
与对照组比较,联合组CCL5水平升高,CXCL1水平降低(P<0.05),见表1。
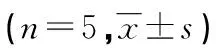
表1 各组细胞因子免疫荧光信号强度表达情况
3 讨 论
在晚期恶性肿瘤的治疗中,抗血管生成治疗和以ICIs为代表的免疫治疗都具有举足轻重的地位,而二者的联合也在晚期NSCLC、肝癌、结直肠癌、宫颈癌等临床治疗中取得了明显疗效,对不能耐受化疗、拒绝化疗或多线治疗后进展的患者提供了一种无化疗的可选方案。目前,二者联合治疗已经应用于晚期NSCLC 二线后乃至初治患者中。在一项阿帕替尼联合SHR-1210的Ⅱ期临床研究中,晚期经治非鳞NSCLC患者联合治疗的客观缓解率(objective response rate,ORR)和疾病控制率(disease control rate,DCR)分别为30.80%和82.44%,中位无进展生存期可达到5.9个月[11]。2019年韩宝惠教授在世界肺癌大会上报道了安罗替尼联合信迪利单抗的多队列Ⅰ期临床试验,该联合方案在初治晚期NSCLC患者中总生存期达到26.2个月,ORR与DCR分别为30%和77%,显示出较好的抗肿瘤协同作用[12]。此外,2020年在美国临床肿瘤学会大会上也报道了一项安罗替尼的真实世界研究,安罗替尼联合包括纳武利尤单抗、派姆单抗在内的PD-1单抗治疗晚期NSCLC的无进展生存期可达到8个月[13]。一项Ⅲ期临床试验IMpower150研究(NCT02366143)数据显示,免疫治疗联合抗血管生成治疗可带来更长的无进展生存期和总生存期,其中亚组分析提示转移性患者、EGFR阳性患者、ALK阳性患者、KRAS突变患者可能更受益[14-18]。正是由于上述一系列的临床结果,2020年我国《晚期非小细胞肺癌抗血管生成药物治疗中国专家共识(2020版)》正式发布[19],该共识结合荟萃分析、真实世界数据和临床实践,指出对于二线后、特殊人群、伴脑转移的非鳞NSCLC及老年NSCLC患者,抗血管生成药物联合免疫方案将成为晚期NSCLC的一线治疗的新方向。
除了临床上的明显疗效,抗血管生成治疗联合ICIs的相关作用机制也受到研究者的广泛关注。研究表明,缺氧条件下VEGFR2表达的增加可以促进肿瘤血管生成[6]。由于代偿机制,抗血管生成单药无法根除肿瘤[20];恶性肿瘤引发组织缺氧伴随血管内皮生长因子表达增高,会加剧肿瘤局部微环境的免疫抑制,使得调节性T细胞、骨髓来源的抑制性细胞、肿瘤相关巨噬细胞等免疫抑制细胞水平升高,CD8+T细胞和肿瘤浸润淋巴细胞等水平下降[21]。因此,将抗血管生成药物与ICIs联合可形成正反馈效应:一方面能够使肿瘤血管正常化及重塑,逆转免疫抑制状态;另一方面,ICIs可促进激活的T细胞浸润及杀伤肿瘤,上调γ-干扰素(interferon-γ,IFN-γ)促进肿瘤血管正常化,使得互相增效获得更好的临床疗效。众所周知,抗血管生成治疗药物根据作用机制可分为以贝伐珠单抗为代表的单抗类、以恩度为代表的血管内皮抑制素及众多VEGFR小分子抑制剂;同时,ICIs的治疗药物也有作用于PD-1和PD-L1不同位点的抗体,那么这些药物的不同组合是否会产生不同的机制效应,目前尚没有研究报道。
为进一步明确安罗替尼与PD-1单抗联合治疗的效果及其机制,本研究对LLC小鼠进行了联合治疗,结果显示,联合组肿瘤质量较对照组和PD-1单抗组明显缩小(P<0.05),较安罗替尼组也有缩小但差异无统计学意义(P>0.05),表明安罗替尼可明显增强PD-1单抗的治疗效果。由于免疫相关淋巴细胞在抗肿瘤免疫中发挥关键作用,本研究进一步对各组的主要免疫相关淋巴细胞进行了检测,结果发现CD4+T细胞的变化尤为明显,联合组CD4+T细胞的数量明显高于其他各组。CD4+T细胞是重要的抗肿瘤免疫细胞,既往研究显示,CD4+T细胞不仅具有辅助性T细胞的功能,还有延迟性的细胞毒活性[22]。同样,CD8+T细胞在各治疗组均有升高,而且联合治疗组的CD8+T细胞的数量明显高于其他各组。此外,巨噬细胞在各治疗组均有不同程度增多,而M2型巨噬细胞明显减少。由此可见,安罗替尼和PD-1单抗影响了肿瘤免疫微环境,联合治疗后CD4+T细胞和CD8+T细胞数量的增多,以及巨噬细胞M1型转化M2型的抑制可能是联合治疗抗肿瘤疗效的关键所在。本研究还对联合治疗抗血管生成作用进行了验证,结果发现联合组与安罗替尼组治疗的抗血管生成作用基本一致,并未因为ICIs的加入而减弱其抗血管生成的作用,而抗血管生成药物能够协同并加强免疫治疗的疗效已早有证实[23]。因此,从总体来看,联合治疗明显改善了微环境。
细胞因子在调节细胞生长、损伤修复等过程中发挥多种生物学功能。在肿瘤发展过程中,细胞因子不仅可以是免疫细胞的产物,也可作为肿瘤与免疫细胞之间的信息载体影响肿瘤免疫细胞。对细胞因子分析可从另一方面评价免疫治疗的效果。本研究发现,安罗替尼联合PD-1单抗治疗可改变机体的免疫状态,表现为联合治疗后CCL5有明显升高,而CXCL1明显下降。CCL5升高在免疫细胞的趋化和活化中发挥作用,可增强抗肿瘤免疫反应[24]。MOWAT等[25]在DNA错配修复基因表达缺失的肠癌研究中也发现CCL5作为干扰素依赖性趋化因子,以及CXCL10的过度表达可导致系统性而非局部性CD8+T细胞优先募集和保留到肿瘤上皮中。而CXCL1的降低可以抑制髓样细胞的迁移[26],同时促进CD8+T细胞在肿瘤部位积聚。CCL5和CXCL1的变化,可能是肿瘤组织中CD8+T细胞浸润增多、安罗替尼增强PD-1单抗免疫治疗作用的重要机制。
综上所述,安罗替尼联合ICIs可能通过调节细胞因子CCL5和CXCL1及增加肿瘤浸润CD4+T细胞、CD8+T细胞来有效地抑制小鼠移植瘤的生长,该结果可为进一步制订有效的临床治疗策略提供依据。本研究仍有一定的局限性,由于是小鼠肺癌的动物实验,样本量也偏少,对人体的联合治疗作用机制仅供参考,今后还需进行人类肿瘤细胞实验和肺癌临床试验来验证联合治疗的作用机制。

