外源信号分子影响下好氧颗粒污泥微生物群落演替规律
宋志伟, 谷新宇, 王云卓, 郑 欢
(1.黑龙江科技大学 教务处, 哈尔滨 150022; 2.黑龙江科技大学 环境与化工学院, 哈尔滨 150022)
0 引 言
好氧颗粒污泥(AGS)是在适宜的水环境和营养条件下形成的一种自聚集的微生物聚合体[1]。它具有结构致密、沉降性能好、能同时脱氮除磷等诸多优点[2-3]。好氧颗粒污泥的培养条件较为苛刻,限制其实际应用[4]。好氧颗粒污泥的形成条件及机理、功能特性等是近年来该领域的研究热点[5-7]。好氧颗粒污泥由大部分细菌及小部分真菌组成,复杂的群落结构是AGS对废水中有机物降解及吸附杂质的基础,也是颗粒保持稳定的重要因素[8]。群体感应信号分子能在生物膜形成过程中影响生物膜的结构,信号分子使灵杆菌聚集生长加快生物膜成膜[9]。雍阳春[10]研究发现在群体感应作用下代谢产生的信号分子影响污泥的颗粒化,在污泥不同的运行阶段,群体感应信号分子浓度有很大差别。Jiang等[11]首次指出,在好氧颗粒污泥的形成过程中有酰基高丝氨酸内酯类(AHLs)信号分子的参与,并发现在好氧颗粒污泥的颗粒化过程中,AHLs与EPS的产生具有相关性。由此可知,已有研究表明,信号分子介导的群体感应在微生物废水处理技术中的积极影响。但主要偏向生物膜及厌氧颗粒污泥形成过程中群体感应规律的作用,对好氧颗粒污泥中的群体感应规律研究较少,还停留在对好氧颗粒污泥粒化过程及维持其稳定性的过程中分泌的信号分子种类及分布情况的研究,而种群结构和群体感应之间存在何种联系仍需进一步探究明确。
笔者基于群体感应规律,采用高通量测序技术和超高效液相色谱-串联质谱(UPLC-MS/MS)技术检测方法,检测好氧颗粒污泥群落结构,以AHLs信号分子为外源信号分子进行投加,通过分析外源信号分子对好氧颗粒污泥生长周期中微生物种群结构的影响,探究好氧颗粒污泥微生物种群与群体感应的规律,为促进好氧颗粒污泥微生物驯化的工程应用提供参考。
1 材料与方法
1.1 实验装置
SBAR实验装置如图1所示。本研究采用自制气升式内循环序批式反应器(Sequencing batch airlift reactor,SBAR),反应器分为内管和外管,内径分别为8和24 cm,高120 cm。内管空间为反应区,有效容积为5 L,外管空间为恒温层,进行水浴恒温。反应器在PLC集成控制装置下实现进水、曝气、沉降、排水等状态,以序批式运行的方式连续运行。
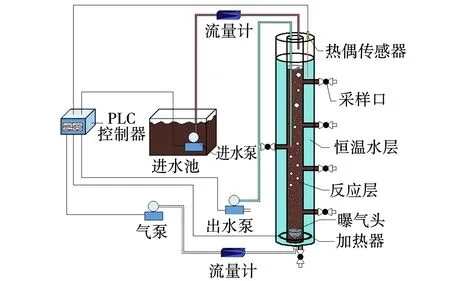
图1 SBAR实验装置Fig.1 SBAR experimental setup
1.2 实验材料
1.2.1 信号分子试剂
实验中所使用的三种AHLs信号分子分别为N-decanoyl-L-Homoserine lactone (C10-HSL,C14H25NO3)、N-dodecanoyl-L-Homoserine lactone (C12-HSL,C16H29NO3)、N-tetradecanoyl-L-Homoserine lactone (C14-HSL,C18H33NO3),均购自Cayman Chemical公司,保存在-20 ℃环境中。
1.2.2 接种污泥
接种污泥是絮状污泥,其采集于哈尔滨市某啤酒厂中污水处理厂二沉池回流污泥。污泥呈褐色絮状,优势菌门为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)。
1.2.3 实验用污水

表1 模拟污水成分配方

表2 微量元素组成
1.3 实验样品采集
根据各反应器中污泥的生长状态,分别在反应第0 d、第34 d、第114 d进行取样,样品编号设置,见表3。

表3 测试样品的选取及选取时间
1.4 分析方法
信号分子采用液相色谱质谱联用技术进行浓度检测,采用高通量测序技术进行微生物群落检测,并利用美吉云平台进行种群结构和多样性分析。
1.5 信号分子投加方式及反应器运行条件
通过PLC同时自动控制4组SBAR反应器,分别编号为R1、R2、R3和R4。信号分子投加方式: R1反应器在AGS培养的生长期(第1~25 d) 和成熟期(第25~37 d) 投加C14-HSL,在稳定期(第37~120 d) 投加C12-HSL; R2反应器不投加任何AHLs,作为空白对照组;R3反应器在生长期和成熟期投加 C14-HSL,稳定期不投加任何AHLs; R4反应器在生长期和成熟期不投加任何AHLs,只在稳定期投加 C12-HSL。 实验 AHLs 均随进水进入反应器,其在进水终浓度为 50 nmol/L。反应器运行条件设置:6 h的运行周期,5 min进水时间,5 min排水时间,排水量率为50%,曝气时间为310~345 min,曝气量控制在0.24 m3/h,温度为30±1 ℃。为避免污泥在接种后短期内被大量排出反应器而降低生物量的情况,实验初始沉降时间为40 min,随后各组统一以每天1~2 min的梯度逐渐减少至5 min(25 d内完成缩减),因此,沉淀时间为40~5 min。4组反应器均运行120 d。
2 结果与讨论
2.1 样品测序有效性分析
为确定实验采集样品在进行高通量测序时的有效合理性,对所有样品进行统计分析,构建了稀释性曲线,当曲线越趋于平坦时,说明数据越合理。所有样品的稀释性曲线,如图2所示。由图2可见,每个样品曲线都趋于平缓,证明本次测样数据合理有效,可以进一步实验分析。

图2 样品稀释性曲线Fig.2 Sample dilutability curve
2.2 信号分子在好氧颗粒污泥中的分布
为探究AHLs信号分子调节AGS稳定性的机制,明确外源AHLs信号分子是否作用到微生物,以及参与了微生物活动,同时研究外源AHLs信号分子对内源AHLs信号分子的影响。因此,在第0 d(接种污泥)、34 d(成熟期)、116 d(稳定期)对各反应器进行采样检测AHLs信号分子分布。文中将C10-HSL作为内源AHLs信号分子作为指示,而投加的C12-HSL、C14-HSL作为外源AHLs信号分子,在未投加C12-HSL、C14-HSL的反应器中检测到的这两种AHLs也能作为内源信号分子进行分析。
信号分子的分布情况,见图3。实验开始时在接种污泥中均检测到微量的C10-HSL、C12-HSL、C14-HSL,分别为353.2、104.3、1 687.2 pg/L。而投加的C12-HSL、C14-HSL的浓度为12.8、14.2 μg/L(均为50 nmol/L)。

图3 信号分子的分布情况Fig.3 Distribution of signaling molecules
随着实验的进行到第34 d,各反应器中的AHLs含量出现不同变化,在R1、R3反应器中检测到大量的C14-HSL分别为42 605、40 546 pg/L,同时内源的C10-HSL和C12-HSL含量也得到了提升,分别升高至2 943.3、260.8 pg/L和2 359、259.2 pg/L;而R2、R4中的C12-HSL含量分别降低至49.9、20.1 pg/L,并低于絮状污泥中的含量。R1、R3反应器中内源C10-HSL含量比R2、R4反应器高,也说明C14-HSL的投加可能会促进内源AHLs的合成、分泌。在第116 d时R1、R4反应器中检测到C10-HSL、C12-HSL的含量都比R2、R3反应器中高,而C14-HSL含量相差不大。因此,可以推断C12-HSL能维持微生物低水平合成、分泌内源C10-HSL、C14-HSL。
AHLs的受体位于细胞内,因此对AHLs在反应器中分布规律进行分析,可以推断AHLs是否参与了微生物活动。由图3a可知,内源C10-HSL主要位于水相中,如在第34 d时R1反应器的水相中C10-HSL含量比絮状污泥高919.8%,在稳定期仍比接种污泥高154.1%。相比水相中的含量,C10-HSL在泥相中的含量变化幅度小且分布少。再结合图3b能发现C12-HSL也主要分布于水相中,但在第116 d时C12-HSL能较均匀的分布于水相和泥相。这说明C12-HSL进入AGS内部,富集到微生物的细胞里。而对比图3c可知,在35 d时有高含量C14-HSL且均匀的分布于水相和泥相,这说明C14-HSL是AGS生长和成熟期内源合成较多的AHLs信号分子种类。
分析认为,C12-HSL会在低C14-HSL浓度时被微生物吸收至细胞内,发挥与C14-HSL类似的作用,促进内源C10-HSL的分泌,但微生物会较先利用C14-HSL。故推断两种AHLs信号分子参与了微生物活动。
2.3 微生物种群多样性变化
利用软件平台Uparse对样本中16S rRNA碱基序列进行抽平、聚类分析,结果检测到1个域、1个界、26个门、65个纲、136个目、220个科、356个属、490个种、636个OTU (Operational taxonomic units)。在OTU分类水平上分析样品中的Alpha多样性,可得到相关Alpha多样性指数,如图4所示。样品S00的各样品中的物种数量比其他样品都多,说明随着AGS的逐渐形成,反应器中的物种多样性在逐渐降低。

图4 样品中物种数量Fig.4 Number of species in these samples
Alpha多样性指数,如表4所示。其中,α1是群落丰富度指数,α2是群落多样性指数,α3是群落均匀度指数。

表4 Alpha多样性指数
α1指数表明,AGS的丰富度低于絮状污泥。R1、R2反应器在运行过程中物种丰富度变化较小,在第114 d时R3反应器物种丰富度明显增加而R4反应器出现降低,这说明AHLs信号分子投加方式会引起反应器中物种丰富度的显著变化。由α2指数可知,第114 d时R1、R4反应器出现群落多样性相对于第34 d时进一步降低的现象,而R2、R3反应器的多样性有所回升。这说明C12-HSL的投加会降低物种的多样性,C14-HSL则无明显的作用;但R1反应器的降低程度小于R4反应器,这可能是与R1反应器在投加C14-HSL后形成的种群结构有关。由α3指数可知,AGS在逐渐形成过程中系统的不同时期的群落分布发生了变化,絮状污泥中微生物的空间分布均匀度明显高于AGS。反应器R2、R3中,第114 d的物种均匀度比第34 d的物种均匀度有所升高,而在反应器R1、R4中,第114 d的物种均匀度比第34 d的物种均匀度却有一定程度的下降,根据各反应器中信号分子的投加方式可知,C12-HSL可能抑制了某些微生物的生长。
综合分析可知,AGS在形成后其微生物多样性相比絮状污泥会大幅度降低,C12-HSL会加剧这种变化,但是在投加C12-HSL之前先投加C14-HSL进行调节,物生物多样性下降的程度会有所缓解。
2.4 微生物物种组成
根据Alpha多样性指数分析可知,投加外源信号分子会影响AGS的物种多样性,这可能是其影响了AGS的群落结构引起的,需进一步分析AGS的物种组成。AGS不同时期样品的主成分分析,如图5所示。其中,主成分PC1和PC2对样本组成差异的解释度值分别为74.15%和17.26%。样品距离越近,说明样品之间的物种组成越相似。

图5 样品主成分分析Fig.5 Principal component analysis of samples
由图5可知,絮状污泥样品S00与其他时期的样品之间距离较远,说明AGS在形成后,微生物的种群结构发生了较大变化。而第34 d即成熟期样品所在的蓝色区域与第114 d即稳定期样品所在的绿色区域也有较远距离,说明在AGS运行的不同阶段,微生物群落结构会发生改变。在蓝色区域中,S31距离S11、S21、S41最远,而S11与S21、S41距离较近,这说明C14-HSL的投加对物种组成影响较小。在绿色区域中S12、S42距离最近,S32、S22依次远离S12、S42,这说明C12-HSL可以定向调控AGS种群结构变化;而S32相对于S22远离程度小,这说明在实验前期投加的C14-HSL会使AGS形成较稳定的种群结构,并在后期与R2反应器形成较大的物种差异。为进一步分析在外源信号分子影响下AGS微生物物种组成,绘制了所有样品在属水平的物种可视化圈,如图6所示。

图6 物种可视化圈图Fig.6 Species visualization circle map
由图6可知,在絮状污泥(S00)中无明显的优势菌属,丰度前4的菌属分别为norank_f_NS9_marine_group(硝化菌,9.4%)、norank_f_Saprospiraceae(腐螺旋菌,8.7%)、Hyphomicrobium(生丝微菌,8.2%)、norank_f_Caldilineaceae(嗜热木质纤维素溶解菌,6.9%)。在前35 d投加C14-HSL后,R1反应器(S11)中的主要菌属变为kineosphaera(动球形菌32%)、TM7a(17%)、nakamurella(中村氏菌,14%)、unclassified_f_Saccharimonadaceae(10%);R3反应器(S31)中的主要菌属变为kineosphaera(43%)、TM7a (26%)、Deinococcus(异常球菌8.9%)。未投加C14-HSL的R2 (S21)、R4 (S41)反应器中主要菌属分别为kineosphaera(37%)、TM7a (17%)、Deinococcus(14%)、unclassified_f_Saccharimonadaceae(7.0%)和kineosphaera(26%)、TM7a(24%)、nakamurella(10%)、Deinococcus(9.0%)。对比絮状污泥发现丰度前四的菌属占比均已低于1.0%,且在各反应器运行至34 d时主要菌属为kineosphaera、TM7a。结合C14-HSL的分布,发现各反应器中C14-HSL浓度与nakamurella菌属占比呈现正相关,而与kineosphaera、TM7a菌属占比呈现负相关,这说明C14-HSL的作用并不能使AGS中优势菌属的优势进一步扩大,而可能是提高一部分低丰度菌属的占比。
在第114 d时,R1、R4反应器中nakamurella菌属占比分别增加至55%、62%,而R2、R3反应器中分别增加至24%、40%,这可能是投加C12-HSL后引起的该菌属在R1、R4反应器中大量增殖。在R2、R3反应器中除nakamurella菌属成为优势菌外,Ottowia菌属占比也分别增至22%、17%,而在R1、R4反应器中处于较低水平,分别为8.8%、2.7%。因此,C12-HSL能显著促进nakamurella菌属而抑制Ottowia菌属增殖,但在R1反应器的抑制现象相对于R4反应器较弱,另外丰度较低的Deinococcus菌属受AHLs抑制现象与Ottowia菌属一致。在生长期、成熟期投加C14-HSL对AGS中种群结构变化影响较小,但会促进丰度较低的菌属生长;而在稳定期投加C12-HSL会显著促进AGS中优势菌属的增殖,也会抑制一部分菌属的生长。因此,在C14-HSL、C12-HSL的调控下,反应器内优势菌属中村氏菌(nakamurella)、动球形菌(kineosphaera)丰度明显提高,而C12-HSL和C14-HSL两种AHLs的投加方式可促进物种多样性的快速降低。
2.5 微生物表型
AHLs信号分子介导的是革兰氏阴性菌群体感应,因此对测序结果进行功能预测(BugBase表型预测),可以分析外源信号分子影响下功能微生物的变化。革兰氏阴性菌种分布,如图7所示。
由图7可以发现,絮状污泥中G-菌属占比达到79.5%,而随着实验的进行各反应器中革兰氏阴性(G-)菌属占比明显减少,均减少40%左右,这说明在AGS中G-菌属并不占据明显丰度优势。对比S00和S11、S21、S31、S41发现,絮状污泥中优势G-菌属norank_f_JG30-KF-CM45骤减,而TM7a、unclassified_f_Saccharimonadaceae在各反应器中有不同程度的增长。结合2.2的结果发现,絮状污泥中三种AHLs的含量均处于低水平,而在第34 d时各AHLs含量均匀明显的增加,这说明在形成颗粒的过程中AHLs会抑制一部分优势G-菌属,如norank_f_JG30-KF-CM45、unclassified_f_Rhizobiaceae、Terrimonas等,由TM7a、unclassified_f_Saccharimonadaceae取代这些菌属,进而完成种群结构的改变。在第114 d时,各组反应器中G-菌属占比进一步降低,其中S12、S42下降最为显著达到27%,S22下降幅度最小2.3%,TM7a、unclassified_f_Saccharimonadaceae两种优势菌属占比骤降。再结合此时4组反应器中AHLs含量相比第34 d有所降低,而R1、R4反应器投加有外源C12-HSL的结果,可以推断C12-HSL会进一步抑制G-菌属生长。未投加C12-HSL的R2、R3反应器在第114 d时反应器内G-菌属的多样性显著增加,R2、R3反应器中低丰度的G-菌属总计占比分别由6.0%、6.1%达到26.8%、18.3%。这说明当AHLs含量降低时AGS中G-菌属受到的抑制作用减弱,而R3反应器在生长期、稳定期投加有C14-HSL使G-菌属多样性恢复能力比R2反应器弱。C12-HSL和C14-HSL对G-菌属的抑制可能是为促进革兰氏阳性(G+)菌属的增殖,以实现种群结构的改变。G-菌属占比降低对应的是 G+菌属的增殖,部分G+菌属与生物膜的形成相关,如图8所示。

图8 微生物对生物膜形成的贡献分布Fig.8 Distribution of microbial contribution to biofilm formation
对生物膜形成贡献大小的微生物占比图。由图中S00可以发现,在絮状污泥中的对生物膜形成贡献最大的菌属是G-菌属norank_f_JG30-KF-CM45,而在反应器运行至第34 d时,被Nakamurella、Kineosphaera两种G+菌属取代,并且全部对生物膜形成有贡献的菌属总占比出现降低,这可能是G-菌属减少所导致。结合好氧颗粒污泥生长状态发现,G+菌属对形成颗粒更有利,而AHLs的作用则是通过抑制G-菌属的生长给G+菌属提供更多的增殖条件。这也在第114 d的S12、S42得到验证,C12-HSL再进一步抑制G-菌属生长后,R1、R4反应器中对生物膜形成有贡献的全部菌属总占比增加量比R2、R3反应器高,而R2、R3反应器中对生物膜形成有贡献的菌属,其增长的原因则是对生物膜形成有贡献的G-菌属增殖,如Bosea、norank_f_AKYG1722。由于Nakamurella、Kineosphaera两种菌属是G+菌属,因此两者在第34 d和第114 d的更替与AHLs含量变化不相关;但这两种菌属的增殖与EPS的相对含量呈现正相关。分析可知,AHLs的作用是抑制一部分G-菌属的生长,让具有分泌EPS功能的G+菌属成为优势菌属,这与前述实验结果相符,即AGS中的EPS相对含量比絮状污泥含量高,说明G+菌属的EPS分泌能力比G-菌属强,而更高相对含量的EPS会使颗粒污泥更稳定。
分析认为,在生长期、成熟期投加C14-HSL不会增强对G-菌属的抑制,但由图3c可知,在停止投加C14-HSL后稳定期的R3反应器中,仍能检测到比R2反应器中更高含量的C14-HSL,这说明在实验前期投加C14-HSL可以使能分泌C14-HSL的菌属增殖,同样能在R1反应器的稳定期检测到C14-HSL。而R4反应器中检测到较高含量C14-HSL则可能是与C12-HSL的投加有关。因此C14-HSL作用的G-菌属丰度低,并不能引起显著的种群变化。根据C14-HSL在第116 d各反应器中分布发现,C14-HSL分别主分布在R1、R2反应器内的泥相、水相中,这说明R1反应器中C14-HSL正处于大量合成,而R3、R4反应器中合成速率较慢。因此投加C12-HSL可以促进微生物分泌C14-HSL,经过在生长期、成熟期投加C14-HSL调控的AGS对C12-HSL的响应更快速。当反应器中存在多种AHLs时,会导致部分G-菌属的生长受到抑制,进而表现出的图6结果。当C12-HSL投加一段时间后,G-菌属丰度变化趋于稳定,从而表现出图7中S12、S42相似的分布。综上所述,采用C12-HSL和C14-HSL两种AHLs的投加方式可以使AGS中微生物更快响应AHLs的调控。
3 结 论
(1)C12-HSL、C14-HSL两种AHLs信号分子参与了AGS中微生物生命活动,并会促进微生物对内源AHLs的合成、分泌。在第34 d时投加有C14-HSL的R1和R3反应器中检测到较高含量的内源C10-HSL、C12-HSL,质量浓度分别为2 943.3、260.8 pg/L和2359、259.2 pg/L;第116 d时仅在投加有C12-HSL的R1、R4反应器中检测到内源C10-HSL,含量分别为779.6 pg/L、234.1 pg/L。同时在C14-HSL投加时,R1、R3反应器中的内源C12-HSL主要分布于水相中,而到停止投加C14-HSL后,在R1、R4反应器的泥相中检测到大量C12-HSL,这说明微生物对C12-HSL和C14-HSL的结合有顺序。
(2)采用高通量测序技术进行物种多样性分析,结果表明,C12-HSL、C14-HSL两种AHLs中C12-HSL会显著降低AGS的Alpha物种多样性,而R1反应器采用投加C12-HSL和C14-HSL两种AHLs方式形成的好氧颗粒污泥Alpha多样性并不能达到最低,其原因可能是稳定期的R1反应器内存在经外源C14-HSL调控过的菌属。
(3)采用高通量测序技术进行物种组成分析,结果表明,絮状污泥接种后在AGS中会出现优势菌属,其中成熟期为动球形菌(kineosphaera)、TM7a菌属,稳定期为中村氏菌(nakamurella),这些优势菌属受C12-HSL的影响程度比C14-HSL更显著。除了C12-HSL能促进优势菌属的生长,同时也能抑制如异常球菌(Deinococcus)、Ottowia等菌属,而这种抑制现象在R4中最显著,因此R4的Alpha多样性低于R1。
(4)采用高通量测序技术进行微生物表型分析,结果表明,G+菌属中中村氏菌(nakamurella)、动球形菌(kineosphaera)对生物膜形成的贡献程度比G-菌属更大,因此在AHLs的抑制作用下G-菌属会出现生长繁殖速率下降。其中,C12-HSL比C14-HSL更能抑制G-菌属的增殖,但经外源C14-HSL在生长期、稳定期调控后形成的AGS中会保留一部分低丰度菌属,这些与C14-HSL调控相关的菌属能减轻只在稳定期投加C12-HSL引起的Alpha多样性降低的程度。

