氯化钴模拟法构建绒毛外滋养细胞缺氧模型*
尹春月,龙 禹
(广西医科大学第一附属医院妇产科,南宁 530021)
整个妊娠期胎盘微环境中的氧气水平不是恒定的,妊娠早期生理性氧张力为2%~3%,妊娠中期和晚期为6%~8%[1]。这个缺氧阶段与胎盘发育的最关键阶段重叠,即胚泡植入、绒毛外滋养细胞(extravillous trophoblast,EVT)侵袭和螺旋动脉重塑。在胎盘早期发育过程中,细胞滋养层细胞(cytotrophoblast,CTB)增殖并形成细胞柱,该细胞柱远端的CTB在孕早期开始分化为两种唯一与母体接触且具有迁移和侵袭能力的EVT,包括血管内绒毛外滋养细胞(endovascular extravillous trophoblast,eEVT)和间质绒毛外滋养细胞(interstitial extravillous trophoblast,iEVT),eEVT侵入螺旋动脉形成EVT栓,阻止母体血液流入绒毛空间,从而创造持续10周的低氧妊娠环境[2]。在妊娠头3个月末,这些栓子逐渐消散,eEVT开始沿着血管向近端迁移,将螺旋动脉重塑成低阻力高流速的血管,逐渐将局部子宫氧张力水平升高并恢复到其“正常”生理水平;iEVT则侵袭至子宫肌层的上1/3处。这种缺氧缺血/再氧合过程是正常的、生理的,并且对于正常的胎儿和胎盘发育至关重要[3]。氧张力水平的变化与胚胎发育结局密切联系。先兆子痫、早产、复发性流产等妊娠相关疾病的发生发展与氧合异常有关[4]。
氯化钴(cobalt chloride,CoCl2)已被广泛应用于模拟缺氧环境的化学试剂,能产生与缺氧缺血相似的反应[5],其诱导的化学性缺氧模型具有稳健性好、可重复性高的优点。本研究拟分离和培养原代人早孕EVT,探讨其在CoCl2不同浓度和处理时间条件下的增殖、活力及缺氧相关反应基因的变化,以建立一个可靠、检测方便的EVT细胞缺氧模型,为探索及防治EVT侵袭缺陷与缺氧的疾病奠定体外实验的细胞学基础。
1 资料与方法
1.1 材料
1.1.1 研究对象 选取2022年4月至2023年1月在广西医科大学第一附属医院行人工流产的正常孕妇。纳入标准:年龄18~45岁;妊娠前无心血管系统、泌尿系统及糖尿病等病史;B超证实为宫内妊娠,宫腔内见孕囊、胚芽,并有原始心管搏动,孕周6~9周;术前3个月内未服用过甾体类激素及抗早孕药物。本实验已获得患者知情同意及伦理审查。
1.1.2 主要试剂与仪器 DMEM/F12培养液购自美国Gibco公司;DNase I酶、氯化钴购自美国Sigma-Aldrich公司;优级胎牛血清、胰酶购自大连美仑公司;兔抗人细胞角蛋白7抗体(cytokeratin 7,CK7)、兔抗人波形蛋白抗体(vimentin,VIM)、兔抗人人白细胞抗原-G蛋白抗体(human leucocyte antigen-G,HLA-G)、小鼠抗兔HRP多克隆二抗购自Bioss公司;Trizol试剂购自invitrogen公司;荧光定量PCR试剂盒购自Novoprotein公司;倒置荧光显微镜(日本Olympus公司)。
1.2 实验方法
1.2.1 原代EVT细胞分离培养和鉴定 参考Handschuh等[6]方法,取正常6~9孕周人工流产的绒毛组织,用含高浓度双抗的PBS冲洗,剪除蜕膜、胎膜及血管,给予10mL/g组织复合酶(含0.02% EDTA的0.125%胰酶、DNase I酶、4.2mmol/L MgSO4、25mmol/L HEPES)静置消化35~40min,依次经200目和400目筛网过滤,300×g离心10min。将细胞沉淀重悬于2mL红细胞裂解液,裂解10min,500×g离心5min,去上清,加5倍体积PBS清洗细胞,500×g离心3min。将细胞重悬于含20%血清的完全培养基,细胞计数,接种于预先用鼠尾胶原蛋白I包被的培养板或培养皿,置5% CO2、37℃培养箱培养32~48h,更换新的培养基或干预。用HLA-G、CK7和VIM抗体鉴定EVT。
1.2.2 免疫细胞化学 制作EVT细胞爬片,培养32~48h,4%多聚甲醛室温固定细胞30min,PBS洗涤3~5次。室温封闭30min,加CK7、HLA-G和VIM一抗(稀释比均为1∶100),4℃过夜。PBS清洗3次,每次5min,加HRP标记的二抗(稀释比为1∶100)室温孵育1h,PBS清洗,DAB显色10~20min。显微镜观察和拍照。
1.2.3 实时荧光定量聚合酶链反应实验(reverse transcription quantitative polymerase chain reaction,RT-qPCR) 按说明书使用TRIzol法提取RNA,将RNA逆转录成cDNA。管家基因β-肌动蛋白(β-actin)为内参。引物序列:β-actin:F:CATTAAGGAGAAGCTGTGCT,R:GTTGAAGGTAGTTTCGTGGA。HIF-1α:F:GGCAGCAACGACACAGAAAC,R:TGCAGGGTCAGCACTACTTC。扩增条件:预变性95℃,1min;95℃,20s,60℃,1min,40个循环。实验重复3次,取平均值来确定该基因mRNA水平表达。缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)mRNA相对表达量由β-actin矫正后以2-ΔΔCt计算。
1.2.4 CCK-8检测 将EVT细胞按5×103/孔接种于96孔板,培养36~48h,给予不同浓度(0、50、100、150、300、600μmol/L)CoCl2和不同缺氧时间(6、12、24、48h)干预细胞,干预结束后加10μL CCK-8于37℃培养箱继续培养2h。酶标仪检测各孔OD值(检测波长为450nm)。
2 结 果
2.1 原代EVT的体外培养及鉴定 原代分离的EVT细胞体外培养2h后开始贴壁,24h后基本贴壁和铺展,贴壁细胞形态多样,多呈上皮细胞样生长,个别细胞呈纤维细胞样。高密度种植时,EVT细胞间触角相互连接紧密,多数培养3~4d逐渐积聚成团,频繁操作易造成细胞片状脱壁。相对绒毛滋养细胞(villous trophoblast,vCTB),EVT显著特点是细胞发生迁移聚集现象(图1A),但不会相互融合为多核的合体滋养层细胞(syncytio trophoblasts,STB)。相差显微镜下,细胞呈不规则的多角形,细胞核大居中,胞浆丰富透明。体外培养的EVT细胞CK7(图1B)、HLA-G染色呈棕黄色(图1C)、VIM浅棕色(图1D)。随机5个视野下,染色阳性率高,表明体外培养的细胞为人EVT且纯度高,可满足后续试验需要。

图1 早孕人EVT的细胞形态与免疫细胞化学鉴定
2.2 CoCl2对原代EVT细胞存活率的影响 CCK-8法检测结果显示,EVT的细胞存活率呈时间和浓度依赖性。相对于对照组(0μmol/L CoCl2),600μmol/L CoCl2组较早出现细胞毒性作用(P<0.05),余浓度组的细胞存活率变化不明显。随着时间增加,各浓度组的细胞存活率呈浓度依赖性降低:0~150μmol/L浓度组有下降趋势,差异均无统计学意义(P>0.05),300μmol/L浓度组在24h对细胞抑制作用明显,相对对照组,其细胞形态发生明显改变,表现为细胞触角大部分消失,空泡形成增多(图2),但差异无统计学意义(P>0.05),48h后细胞存活率小于50%(P<0.05)。600μmol/L浓度组在缺氧24h后细胞基本全部死亡,细胞存活率均小于50%(P<0.05)。见表1。
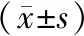
表1 CoCl2对EVT细胞存活率的影响

图2 0μmol/L CoCl2和300μmol/L CoCl2对原代EVT细胞形态的影响(×100)
2.3 CoCl2对原代EVT HIF-1α mRNA表达的影响 取150μmol/L设时-效关系组,相对于对照组0h,缺氧6、12、24、48h组HIF-1α mRNA相对表达量分别是其0.50倍、0.64倍、1.45倍和3.00倍(图3A)。缺氧24h,CoCl2对EVT细胞存活率影响尚可(表1、图4)且HIF-1α mRNA表达量显著增加,因此,取24h设量-效关系组,相对于对照组,50、100、150μmol/L CoCl2组HIF-1α mRNA相对表达量分别是其1.23倍、1.28倍、1.58倍(P<0.05)(图3B)。

图3 CoCl2对原代EVT HIF-1αmRNA表达的影响
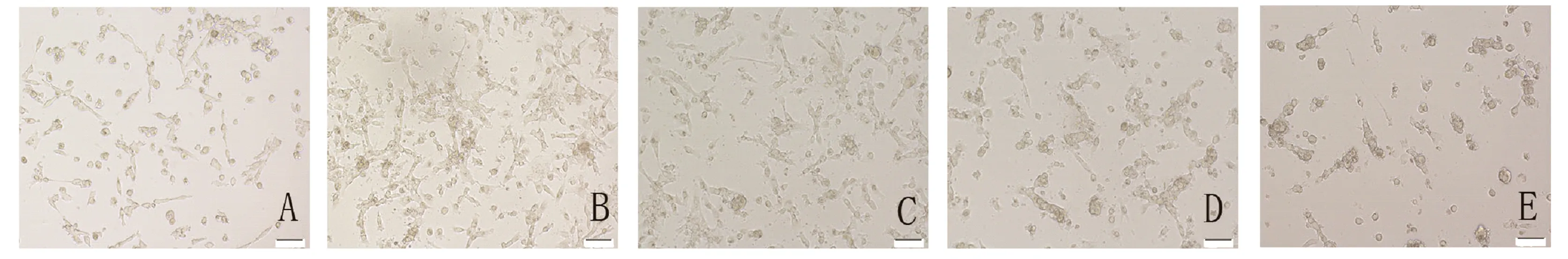
图4 150μmol/L CoCl2对原代EVT细胞形态的影响(×100)
3 讨 论
由于不同物种间胎盘结构、功能及发育过程存在高度异质性[7-8],目前尚缺乏可靠的动物模型,体外模型仍是当前滋养细胞相关疾病的主要研究模型,且多以绒毛膜癌细胞系(如BeWo、JAR和JEG3)或滋养层永生化细胞系(HTR8/SVneo和SW71)为主,然而这些细胞系在来源及功能上异于真正滋养层细胞,体外实验数据的代表性和说服力有限[9]。本研究成功分离和培养原代EVT,并利用CoCl2构建了化学性缺氧细胞模型,结果提示适宜的缺氧浓度和时间为150μmol/L和24h,这为后续研究奠定了体外实验的细胞学基础。
氧在整个妊娠期胎盘发育中发挥着重要作用,缺氧环境影响滋养细胞增殖、分化、迁移和侵袭能力,氧调节异常引起胎盘发育不全可导致多种妊娠相关疾病的发生发展[2]。因此,构建缺氧细胞模型显得尤为重要。细胞缺氧有物理性缺氧法和化学性缺氧法。目前物理性缺氧主要有2种方式:(1)培养室构建,通过调节室中气体成分来维持氧气浓度。每次将细胞移出进行操作时,会迅速建立常氧环境,且平衡至所需的低氧气浓度(需较长时间)。而且传感器监测的是培养箱内部气体环境的氧气浓度,非培养液的溶解氧浓度[10]。(2)液态石蜡隔绝空气法,但是石蜡对培养基液面不完全密封,隔绝氧气的效果不佳,这些最终将影响实验结果的稳定性和准确性[10]。化学性缺氧法通过在细胞培养液中添加化学试剂实现,如CoCl2、去铁氧胺和连二亚硫酸钠等[10]。
CoCl2是一种广泛应用诱导体外缺氧的化学试剂。通过异二聚体缺氧诱导因子1(hypoxia-inducible factor-1,HIF-1)蛋白的表达来评估缺氧与否,该蛋白由两个亚基组成:HIF-1α和HIF-1β。HIF-1β在细胞核中组成型表达,HIF-1α受氧张力调节。促进HIF-1α降解HIF特异性脯氨酰羟化酶具有铁结合核心,该核心处的铁被认为对其酶活性至关重要[5]。这种铁可被钴取代,从而抑制HIF-1α降解[5]。此外,钴抑制HIF-1α和von Hippel Lindau(VHL)蛋白(另一种参与HIF-1α降解的蛋白质)之间的相互作用,从而阻止HIF-1α的降解[11]。总而言之,CoCl2主要通过稳定HIF-1α表达来模拟缺氧。研究证明,CoCl2诱导的化学性缺氧和真正物理性缺氧相关的下游靶标,如血管内皮生成因子(vascular endothelial growth factor,VEGF)和葡萄糖转运蛋白1(glucose transporter-1,GLUT1)的调节是相似的[12-13]。
CoCl2可用于模拟多种癌细胞系的缺氧,包括乳腺癌和卵巢癌细胞[14,15]。CoCl2可诱导HIF-1α表达,但Co2+为重金属离子,对细胞本身具有毒性作用,毒性作用大小也因细胞种类不同而有所差异。因此,CoCl2的作用浓度和时间的条件需摸索,以保证细胞在没有受到明显抑制作用状态下成功模拟缺氧。本研究结果显示,随着细胞培养液中CoCl2浓度和时间的增加,细胞的存活率呈依赖性下降趋势。以300μmol/L,24h为分界点,CoCl2对原代EVT细胞的毒性作用趋于明显:0~150μmol/L低浓度组随着时间的增加,细胞存活率略有下降,300μmol/L浓度组在24h后对细胞抑制作用明显,细胞形态发生显著改变,48h后细胞存活率小于50%,600μmol/L浓度组在24h后表现为细胞存活率均小于50%。然而,由于原代EVT获取及实验检测技术应用的局限性,目前利用CoCl2构建原代EVT细胞缺氧模型的文献有限,主要模型仍为绒毛膜癌细胞系和永生化滋养细胞系。Wang等[16]报道,HTR-8/SVneo细胞在200μmol/L CoCl2浓度下培养24h细胞活力明显下降,同样时间下,400μmol/L浓度组的细胞存活率小于50%。Chen等[17]统计发现其半数抑制浓度为300μmol/L,本研究数据与这些结果相近。也有研究[18]表明,该细胞系的半数抑制浓度高达500μmol/L,值得注意的是肿瘤来源滋养细胞系JEG-3表现为600μmol/L的高半数抑制浓度[19]。以上表明不同来源的同类型细胞,氯化钴对其存活率的影响有较明显的差异。
本研究在CoCl2对原代EVT的细胞存活率和细胞状态影响的基础上,选择150μmol/L及以下浓度组进行后续缺氧细胞模型的探索。以HIF-1α表达水平确认是否成功构建缺氧细胞模型。对于类型不同的细胞[5],CoCl2诱导缺氧的标志HIF-1α稳定表达可最早在2h内观察到,最大表达峰值出现在100~300μmol/L和12~48h的浓度和时间范围。本研究结果发现,150μmol/L浓度组的HIF-1α mRNA表达在12h内是降低的,24h后其呈时间依赖性增加,缺氧24h的HIF-1α mRNA表达增加且显著(P<0.05)。本结果显示,不同浓度组(0、50、100μmol/L和150μmol/L)作用24h,HIF-1α mRNA表达具有浓度依赖性,在一定作用时间内其表达不断增加,但其仅在150μmol/L 浓度组表达具有统计学意义(P<0.05)。HIF-1α mRNA表达幅度增加均不明显,可能原因:CoCl2诱导缺氧在转录和翻译上的差异,这有待后续在蛋白质水平的验证;与细胞自身的自我保护机制有关,由于选取人早孕(6~9周)原代EVT,在体内正值生理性“缺氧”阶段[1],此时EVT可能处于缺氧保护状态。
综上所述,CoCl2可用于原代人EVT细胞的缺氧诱导,成功构建化学性缺氧细胞模型,综合CoCl2的细胞毒性作用与HIF-1α mRNA的表达,原代EVT适宜的作用浓度和时间是150μmol/L和24h,这初步为EVT侵袭缺陷等疾病的氧调节研究奠定了可靠的细胞基础。

