肝癌标志物受体酪氨酸激酶AXL、软骨寡聚基质蛋白和骨桥蛋白多重检测试剂开发与验证
李思萍,韩金育,胡迪,王雅杰,于晓波
1.温州医科大学 第一临床医学院(信息与工程学院),浙江 温州 325035;2.国家蛋白质科学中心-北京(凤凰中心)北京蛋白质组研究中心,北京 102206;3.首都医科大学附属北京地坛医院 检验科,北京 100015;4.旦生(北京)医学科技有限责任公司,北京 102206
肝癌是高度致命的恶性肿瘤之一[1],肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌。当前,常用于肝癌诊断的血清学标志物甲胎蛋白(alpha-fetoprotein,AFP)虽被广泛应用,但应用存在局限性[2-3]。肝癌相关指南建议对AFP阴性人群可以增加检测异常凝血酶原(desγ-carboxy-prothrombin,DCP)、甲胎蛋白异质体3(alpha-fetoprotein lens culinaris agglutinin 3,AFP-L3)、miRNA(microRNA)检测试剂盒和GALAD模型等,从而提高肝癌检出率,但可能由于灵敏度或特异度有限、检测成本高等原因,仍未广泛应用于临床,迫切需要探索新型有效标志物来提供肝癌相关肿瘤信息。受体酪氨酸激酶AXL、软骨寡聚基质蛋白(cartilage oligomeric matrix protein,COMP)、骨桥蛋白(osteopontin,OPN)是近年来分别被发现,并经临床样本验证的新型肝癌标志物,联合AFP检测可以提高肝癌诊断性能[4-6]。但多数研究只是针对其中一种标志物与AFP联合检测,以上三项标志物与AFP结合对肝癌的诊断价值鲜见报道。以往这几种标志物的检测多采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)[7-9],但ELISA样本用量大、操作繁琐且不能实现多重检测。流式荧光技术利用不同荧光编码微球实现单次实验多项标志物同时检测,其检测灵敏度高、特异性强、分析速度快、标志物组合灵活等优势[10-11],可以节约试剂用量和人力成本。本研究基于流式荧光技术建立多重肝癌标志物检测方法,并进行检测性能分析,筛选肝癌血清样本进行临床验证并初步探讨四项标志物对肝癌的诊断价值。
1 材料和方法
1.1 材料
1.1.1 标本:标本取自2019年6月至2022年1月在首都医科大学附属北京地坛医院被诊断为HCC的患者及同期体检的健康对照者。训练队列有30例健康对照者(男/女:21/9,年龄21~83岁)和30例HCC患者(男/女:23/7,年龄35~75岁)。验证队列有20例健康对照者(男/女:13/7,年龄25~84岁)和20例HCC患者(男/女:15/5,年龄32~66岁)。
HCC组纳入标准:患者均为新诊断且未接受过治疗。HCC组排除标准:血清采集前接受过抗癌治疗的患者和有其他肿瘤病史的患者。健康对照组纳入标准:①肝脏生化指标正常且肝炎病毒血清学阴性;②无肝脏和胃肠道疾病及恶性肿瘤病史。所有血清样品在冰上解冻,涡旋5~10 s,在4 ℃条件下1 500×g离心10 min,将上清液分装后用于检测,剩余样本-80 ℃保存。本研究经首都医科大学附属北京地坛医院伦理委员会审核批准(编号:DTECKT2022-006-01),同时签署了免知情同意书。
1.1.2 主要试剂及仪器:人AXL、COMP、OPN标准品及抗体对购自美国R&D systems公司,人AFP标准品及抗体对购自杭州博岳生物技术有限公司,2-(N-吗啉)乙磺酸(MES)水合物购自美国Sigma-Aldrich公司,1-乙基-3(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)购自北京索莱宝科技有限公司,N-羟基硫代琥珀酰亚胺(Sulfo-NHS)、链霉亲和素-藻红蛋白(SA-PE)购自美国Thermo Scientific公司,EasyMagPlex磁性荧光编码微球、流式细胞仪、磁力板均购自深圳唯公科技有限公司。
1.2 方法
1.2.1 血清样本检测:磁性荧光微球成功连接捕获抗体后,向反应板每孔内分别加入50 μL微球悬液和50 μL血清稀释液(AFP以1:20稀释,AXL、COMP、OPN以1:30稀释)或标准品或空白对照,室温振荡孵育2 h,洗涤液清洗2次;每孔加入50 μL生物素标记的检测抗体而形成双抗体夹心形式,室温振荡孵育1 h,洗涤液清洗2次;每孔加入50 μL稀释后的SA-PE,室温振荡孵育0.5 h,洗涤液清洗2次;200 μL检测缓冲液重悬微球,用EasyCell流式细胞仪的不同激光同时对羧基微球上的分类荧光和检测抗体上的标记荧光进行检测,对待测靶标分子进行分类和定量,实现多项肝癌标志物同时检测[12]。
1.2.2 方法学建立:根据唯公羧基编码微球使用说明书,取四种不同荧光比例的微球各100 μL(8×106beads/mL),洗涤后加入Sulfo-NHS、EDC活化30 min;以MES为反应缓冲液,分别向每种微球悬液中加入5.6 μg对应的捕获抗体孵育2 h;用Tris缓冲液反应10 min,直接加入封闭缓冲液摇床混匀封闭14 h;于次日用种属与微球结合的捕获抗体种属来源匹配的生物素化抗鼠IgG以及SA-PE来验证微球偶联效率;利用四项标志物进行预实验,根据中值荧光强度(median fluorescence intensity,MFI)优化检测抗体和SA-PE的工作浓度以及依次加入蛋白、检测抗体和SA-PE的孵育时间等实验条件,建立定量检测肝癌血清标志物的流式荧光免疫法。
1.2.3 方法学性能分析:①交叉反应:使用3 个测试评估交叉反应性[13],多重偶联微球、单个抗原和单个检测抗体,用于确定蛋白是否与非靶标偶联微球结合;多重偶联微球、单个抗原和多重检测抗体,用于确定检测抗体是否与非靶标蛋白发生交叉反应;多重偶联微球、多重抗原和多重检测抗体,用于确认多重测定中不存在交叉反应。②检测范围:结合灵敏度和最高检测限得到检测范围。③灵敏度:以样本稀释液为空白对照,测定3个空白对照的MFI值,计算其均值()和标准偏差(s),以空白检测限(limit of blank,LoB)=+2s[13]和最低检测限(limit of detection,LoD)=+2s[14]分别代入标准曲线中计算对应浓度值。④精密度:检测高、低两个浓度的样本,每个浓度11个重复,进行3 次独立实验。根据变异系数(coefficient of variation,CV)公式:CV(%)=s/×100%,计算精密度。⑤回收率与线性度:以人混合血清样本为未掺入组,向人混合血清样本加入已知浓度的标准品作为掺入组,向稀释液中加入已知浓度的标准品作为对照组。根据样本测定浓度值计算相应的回收率和线性度,回收率(%)=(掺入组-未掺入组)/对照组×100%,以掺入组的样本计算线性度,线性度(%)=稀释样本×稀释倍数/未稀释样本×100%。
1.2.4 方法学初步应用:本研究以训练队列和验证队列作为研究对象,流式荧光免疫法测定同一批血清样本中四项蛋白浓度,比较HCC组与健康对照组的组间差异,分析流式荧光免疫法与化学发光免疫法检测AFP水平的一致性,受试者工作特征(receiver operating characteristic,ROC)曲线用于评估标志物在HCC中的诊断性能,二元Logistic回归分析用于构建标志物联合检测模型,以探讨流式免疫荧光法检测四项肝癌标志物在诊断中的初步应用。
1.3 统计学处理方法 使用SPSS25.0、GraphPad Prism8.0 软件进行统计分析。两种方法的一致性分析采用Pearson相关;标志物检测结果以M(P25,P75)表示,两组间比较采用Mann-WhitneyU检验;标志物诊断性能评估采用ROC曲线分析;标志物联合检测模型构建采用二元Logistic回归分析;标志物间的交叉反应图采用Excel绘制。P<0.05为差异有统计学意义。
2 结果
2.1 微球偶联验证 在分析开发之前进行微球偶联效率评估,以MFI为纵坐标,抗鼠IgG浓度值为横坐标,采用四参数Logistic回归模型分别绘制AFP、AXL、COMP和OPN的曲线。随着生物素标记的抗鼠IgG浓度不断增加,相应的MFI信号值也会增加(见图1)。四项标志物的最高MFI信号均在170 000以上[在设置的光电倍增管(photomultiplier tube,PMT)下,饱和状态最高MFI信号值在200 000左右],说明四项标志物的捕获抗体已经成功连接在微球上。

图1 微球偶联验证结果
2.2 检测性能
2.2.1 交叉反应:分析肝癌标志物AXL、COMP和OPN之间的交叉反应性,显示三个靶标蛋白之间不存在交叉反应(见图2),可以实现三项标志物同时检测。
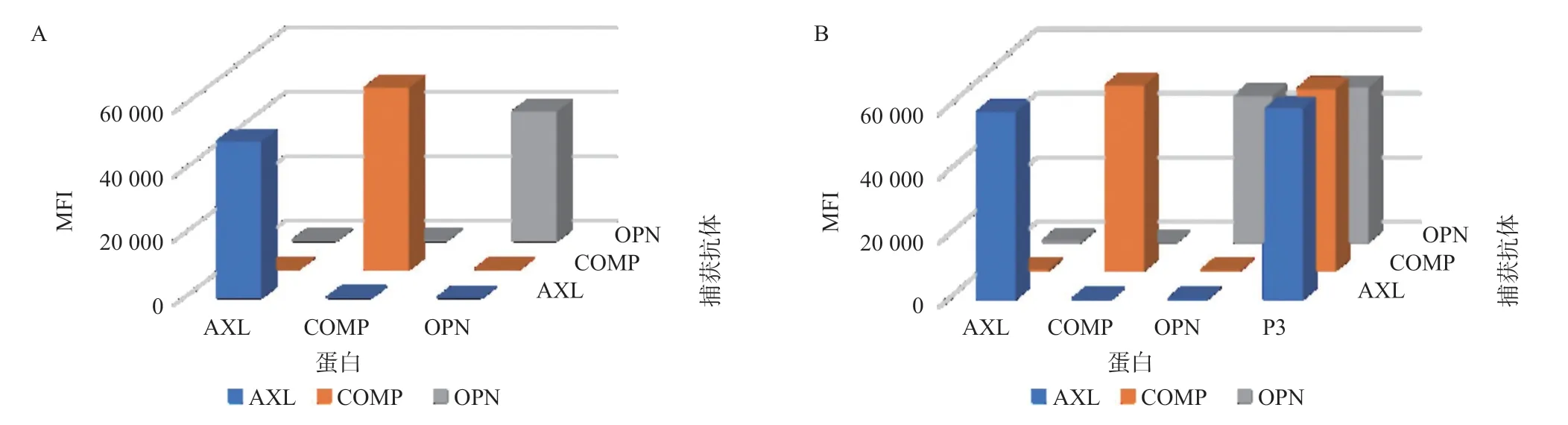
图2 交叉反应结果图
2.2.2 标准曲线:标准曲线对定量测量至关重要,以MFI为纵坐标,标准品浓度值为横坐标,采用四参数Logistic回归模型绘制AFP、AXL、COMP和OPN的标准曲线(见图3)。四项标志物标准曲线相关的检测范围、LoB和LoD分析结果见表1。结果表明四项标志物的标准曲线可以准确定量检测人血清中AFP、AXL、COMP和OPN的蛋白浓度(R2=0.999)。
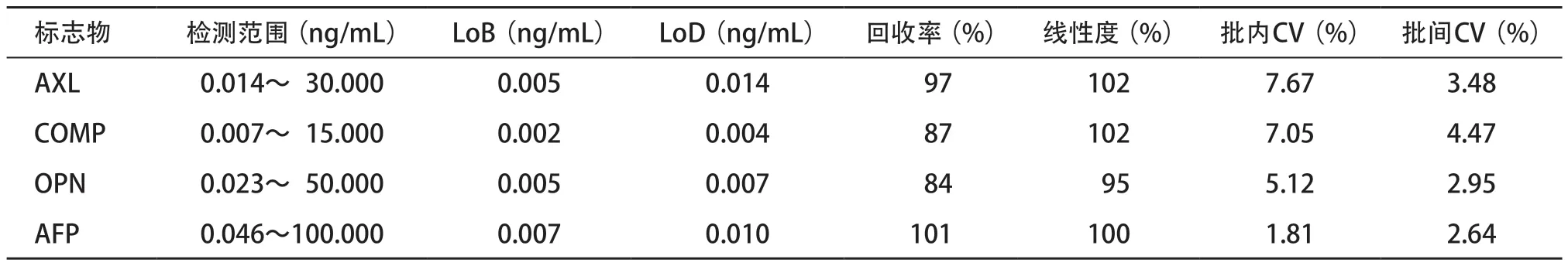
表1 四项标志物性能分析结果
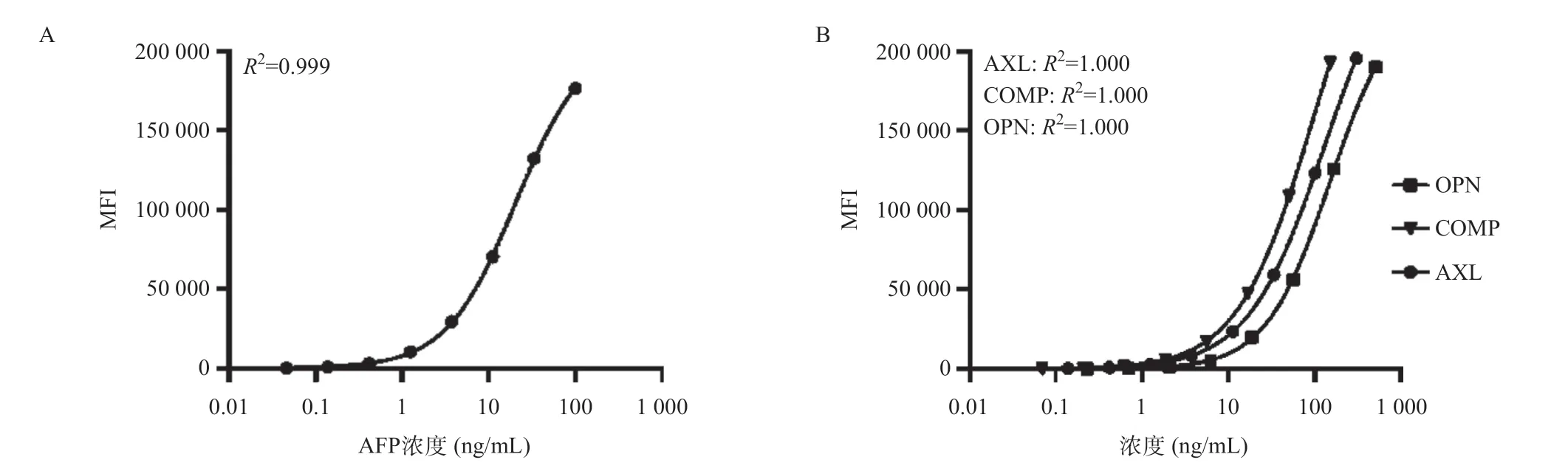
图3 标准曲线图
2.2.3 性能分析:四项标志物对应精密度和准确度结果见表1,检测高、低两个浓度的样本,每个浓度11个重复,得到四项标志物的批内CV均<8%;3次独立检测得到四项标志物的批间CV均<5%;测定每个蛋白梯度稀释的四个浓度,计算四项标志物的平均回收率在84%~101%范围内,平均线性度在95%~102%之间。
2.3 肝癌标志物临床应用评价
2.3.1 方法学比对:为了验证流式荧光免疫法检测结果的准确性,将其与临床化学发光免疫法检测HCC患者的AFP结果进行相关性分析,训练队列(n=30)和验证队列(n=20)的结果均显示两种方法具有很高的相关性(r=0.994,P<0.001),见图4。
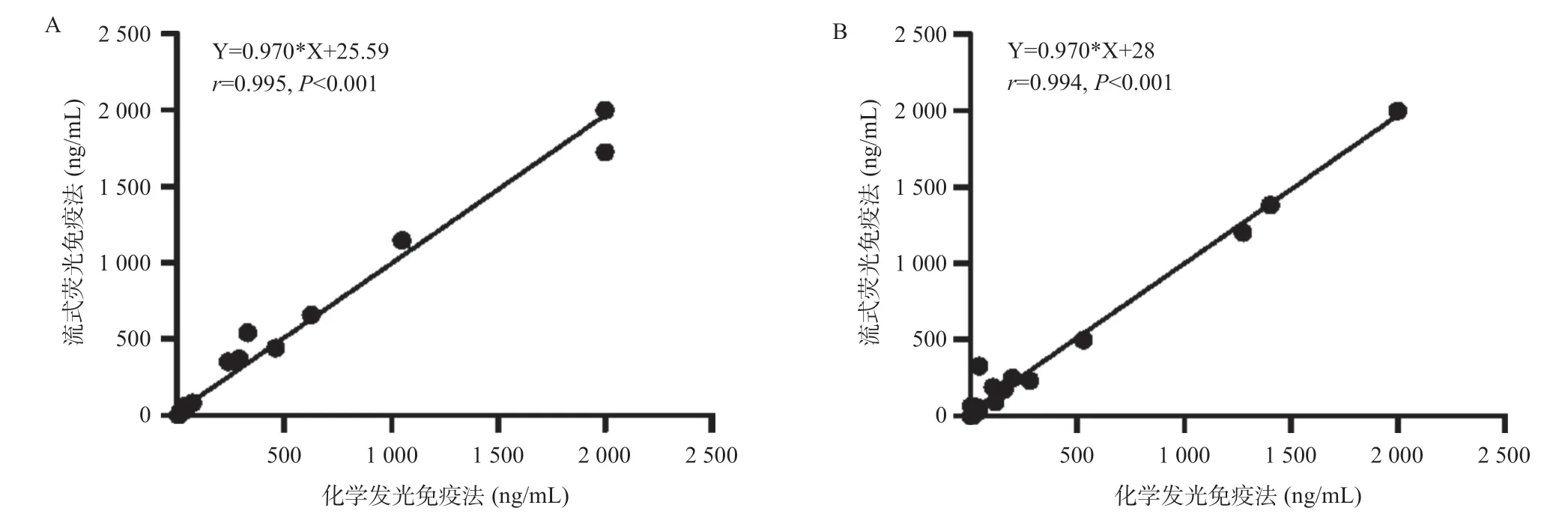
图4 AFP结果的相关性分析
2.3.2 差异表达分析:血清样本中AFP、AXL、COMP及OPN在HCC组与健康对照组存在显著差异(见图5),在训练队列(n=60)中,HCC组四项标志物表达水平均高于健康对照组,差异均有统计学意义(均P<0.01);独立验证队列(n=40)证实了训练队列的发现,相比于健康对照,四项标志物在HCC中均过度分泌(均P<0.01)。在训练队列和验证队列中,血清四项蛋白水平表现出相似的分布(见图5和表2)。

表2 各项标志物检测结果[ M(P25,P75),ng/mL]

图5 四项标志物在健康对照组与HCC组的差异表达
2.3.3 临床应用价值探讨:绘制HCC与健康对照的ROC曲线,以约登指数确定最佳临界值,在最佳临界值条件下对比各项标志物的诊断性能。在训练队列中,单项标志物中,OPN对HCC的诊断性能最佳,AUC达到0.891,表现出比AFP(AUC为0.859)更好的诊断价值;AXL、OPN和AFP组合的AUC为0.953,P4的AUC为0.951,二者具有相似的诊断性能;评估各项标志物对HCC的识别能力,在30例HCC中,21例(70.0%)为AXL阳性,15例(50%)为COMP阳性,24例(80.0%)为OPN阳性,23例(76.7%)为AFP阳性,共有30例(100%)为AXL、COMP、OPN、AFP或四者阳性。为了进一步挖掘AXL、COMP、OPN对AFP阴性HCC患者的识别能力,训练队列中,有9例AFP阴性HCC患者,其中6例(66.7%)为AXL阳性,5例(55.6%)为COMP阳性,7例(77.8%)为OPN阳性,共有9例(100%)为AXL、COMP、OPN或三者阳性。见图6A。
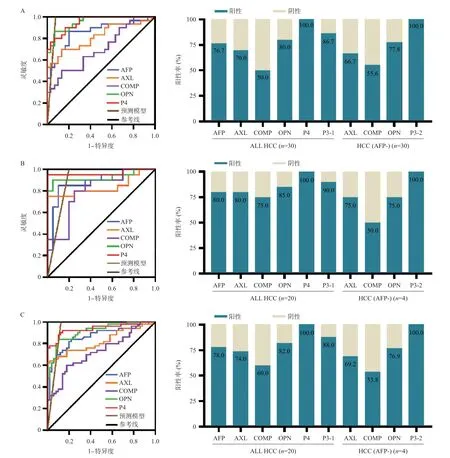
图6 血清四项标志物诊断性能的评估
使用训练队列中相同的临界值,分析了验证队列中的40 例参与者,得到与训练队列相似的诊断性能(见图6B和表3),AXL、OPN和AFP组合的AUC为0.955,P4的AUC为0.965。在两个队列的所有参与者(n=100)中,ROC曲线分析产生了与训练队列相似的诊断性能(见图6C)。
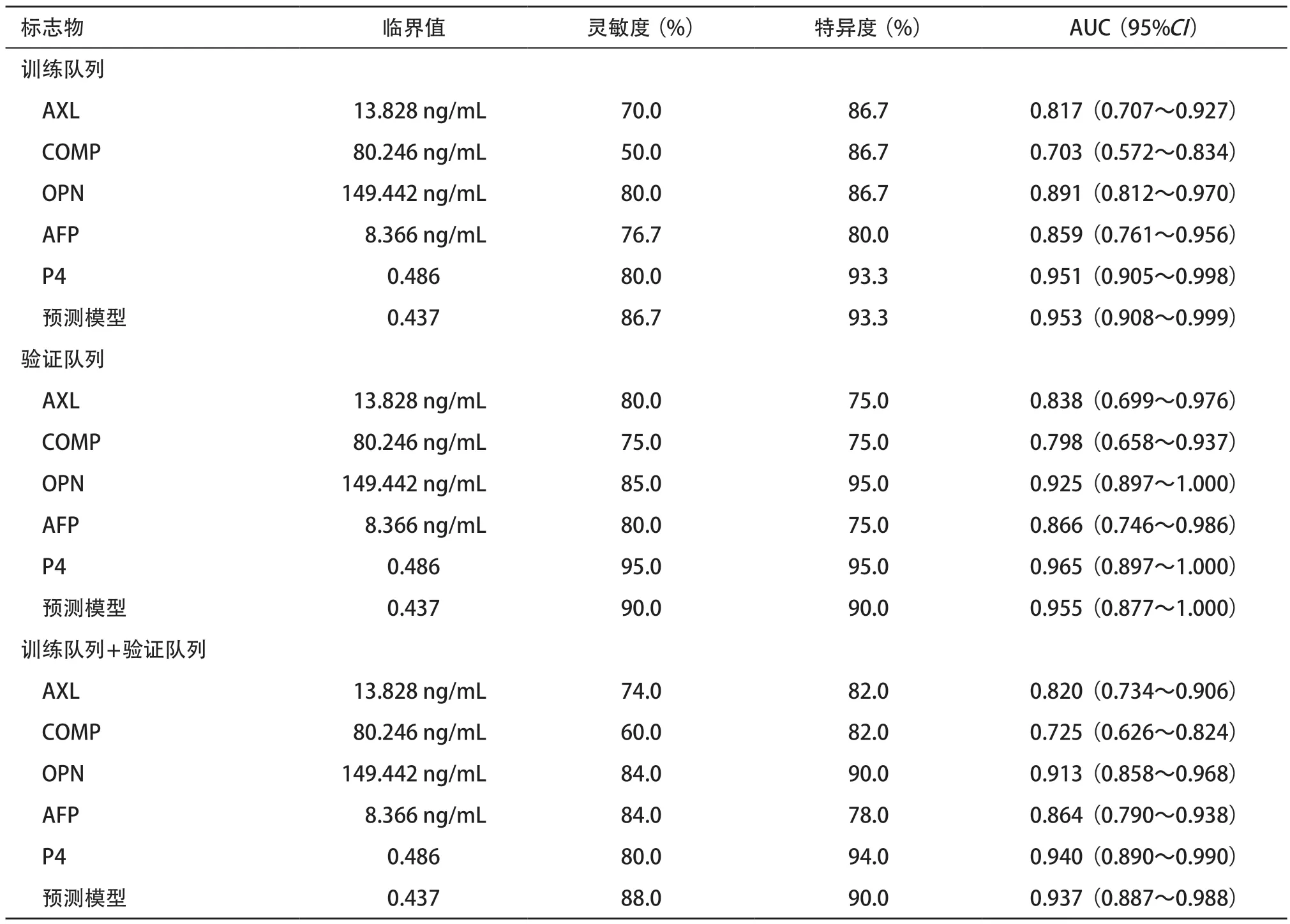
表3 四项标志物的诊断性能
用Logistic回归模型评估两个队列中四项标志物联合检测HCC的性能,发现回归模型中COMP与AXL自变量之间存在中度共线性,方差膨胀因子(variance inflation factor,VIF):COMP=3.986,AXL=4.688(VIF为3~10时被认为有中等程度的共线性),可能会影响回归方程的预测结果,最终将AXL、OPN和AFP纳入预测模型中,通过二元Logistic回归获得的方程创建了HCC的新变量预测概率(p):Log(p/(1-p))=-4.563+0.009×AFP+0.017×OPN+0.09×AXL,(AFP,P=0.023;OPN,P=0.004;AXL,P=0.108)。
3 讨论
随着新型标志物和新技术的不断更新,检测肝癌相关标志物的新方法不断涌现,它们的创新之处可能在于分析方法,充分地将成熟标志物AFP与新型标志物应用于各种创新型统计模型中[15-16]。尽管临床血清学标志物AFP仍然饱受争议,但所有新方法一经提出都得与AFP进行比较[6,15,17]。
本研究对流式荧光技术检测四项标志物的方法进行性能分析,四项标志物表现出较好的检测范围、灵敏度、重复性和准确度,揭示本项目开发的检测方法可以准确定量血清中AFP、AXL、COMP和OPN水平。AXL、COMP和OPN之间没有观察到交叉反应,基于流式荧光技术可以实现三项标志物同步检测,可显著节省样本用量和检测时间,进而降低标志物检测成本。因AFP与这个组合的AXL检测抗体存在交叉反应且AFP与这个组合的样本稀释倍数相差悬殊而进行单项检测。
本研究筛选两个队列的血清样本进行临床验证并探讨新型肝癌标志物的初步应用价值,发现HCC组的血清AXL、COMP、OPN和AFP均显著高表达,证实这四项标志物在HCC患者中具有较高的表达水平,与以往研究[4-6]报道结果一致。ROC曲线分析显示,单项标志物中,OPN对肝癌的诊断效果最佳,表现出比AFP更优的诊断性能[6]。利用四项标志物构建HCC预测模型时,发现Logistic回归模型中COMP与AXL自变量之间存在中度共线性,可能会影响Logistic回归方程的预测结果,最后仅用AXL、OPN和AFP构建HCC预测模型。与以往报道的AFP、AFP-L3、DCP组合[18](AUC为0.910),GALAD模型[15](AUC为0.930),7个miRNAs组合[17](AUC为0.888)等对HCC的诊断性能相比,AXL、OPN和AFP组合能达到相当的检测性能,且AXL、COMP、OPN对AFP阴性HCC患者具有一定的识别能力,表明AXL、COMP、OPN是诊断HCC的潜在血清学标志物,需要在更大临床队列中进行验证。
流式荧光技术具有通量高、速度快、易自动化、按需组合等优势受到临床广泛关注和积极推动[11]。本研究的流式荧光免疫法与临床化学发光免疫法检测AFP结果具有显著相关性(r=0.995,P<0.001),这说明此方法可以满足临床检测性能。AXL、COMP、OPN还没应用于临床,因此没有临床相关的检测数据可以进行比对,在我们未来的研究计划中,利用ELISA检测AXL、COMP、OPN与流式免疫法检测结果进行比对,进一步证实流式荧光技术检测三项标志物的可靠性。
最后,本研究不足在于样本量较小,研究结果需要在更大临床队列中得到验证;同时考虑到肝脏相关疾病对于检测结果的影响,例如肝炎、肝硬化等,我们还需要加入相关疾病队列以得到对肝癌更加特异的标志物。总之,我们建立了一种同时检测血清AXL、COMP和OPN的多重检测方法,在两个临床队列中平行验证了以上标志物在肝癌中的检测能力。

