基于双能量CT参数和临床病理特征列线图预测喉鳞状细胞癌的Ki-67表达水平
郑彭玮,林桂涵,陈炜越,陈春妙,应海峰,纪建松
温州医科大学附属第五医院 放射科 浙江省影像诊断与介入微创研究重点实验室,浙江 丽水 323000
喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)是头颈部最常见的恶性肿瘤之一,其发病率和病死率正逐年增加[1]。据统计,2020年全球新发LSCC病例约有18万例,死亡近10万例[2]。尽管近年来以手术为主的多模式治疗策略在喉癌领域中取得了一定的进展,但仍有相当数量的患者生存时间短、预后差[3-4]。Ki-67 是细胞增殖阶段的核抗原,可准确反映肿瘤的增殖活性[5]。研究[6-7]证实,较高的Ki-67表达水平与LSCC的侵袭性行为及不良预后密切相关。在临床上,Ki-67 的表达主要是基于活检或手术组织的免疫组化(immunohistochemistry,IHC)分析来确定,存在有创、耗时等不足。此外,由于肿瘤内部的异质性和相对较小的活检样本,最终获得的Ki-67结果可能无法代表整个肿瘤。因此,寻找一种无创、全面且准确的检查手段来评估LSCC患者的Ki-67表达水平具有重要意义。双能量CT是一种新兴的功能学成像技术,其不仅可以获得常规的形态学信息,还能够提供诸多与肿瘤生物学特性相关的定量参数[8]。近年来,双能量CT已广泛用于术前预测肺癌[9]、胃癌[10]和直肠癌[11]等疾病的Ki-67表达水平。然而,其在评估LSCC Ki-67表达水平方面的报道国内外仍罕见。本研究旨在探讨基于双能量CT参数联合临床病理特征构建的列线图在术前预测LSCC患者Ki-67表达水平的价值。
1 资料和方法
1.1 一般资料 选取2019年1月至2021年12月于温州医科大学附属第五医院经手术病理证实为LSCC并接受双能量CT检查的患者96例。纳入标准:①通过IHC检测Ki-67表达水平,且结果明确;②双能量CT检查于术前2周内完成;③肿瘤最大径>1.0 cm。排除标准:①无完整临床病理资料;②术前接受化疗或放疗的患者;③CT图像质量较差,如有明显运动或金属伪影。最初收集了174例LSCC患者,根据上述标准排除了78例患者(包括18例Ki-67结果不明确、13例术前2周内无双能量CT影像资料、15例肿瘤直径≤1 cm、9例临床病理资料不完整、17例术前接受化疗或放疗、6例CT图像质量较差),最终纳入了96例患者进行分析。按照7:3比例随机分为训练集(n=67)和验证集(n=29)。收集所有患者的临床病理特征,包括年龄、性别、吸烟史、肿瘤位置、临床T分期、CT报告淋巴结状态和分化程度。本研究通过温州医科大学附属第五医院伦理委员会批准(伦理审批号:2023-96)。
1.2 检查方法 所有检查均在第三代双源CT扫描仪(德国西门子公司)上进行,扫描范围从颅底到胸廓入口。先行常规平扫,扫描参数:管电压120 kV,管电流180 mAs。采用高压注射器(德国欧利奇公司)注射碘对比剂(江苏恒瑞医药股份有限公司),浓度320 mgI/mL,注射速率为2.5~3.0 mL/s,总量按1.5 mL/kg计算。在注射对比剂后25 s和60 s分别采集动脉期和静脉期图像[12]。增强开启双能量模式,扫描参数:A、B球管管电压分别为80 kVp、Sn 150 kVp,管电流分别为118 mAs、69 mAs,准直器128×0.6 mm,螺距为0.6,转速0.5 s/r,重建层厚和间距均为1.5 mm。
1.3 图像分析与处理 将所有重建的图像传送至PACS系统和Syngo via后处理工作站,由两名分别具有7年和13年头颈部影像诊断经验的医师采用盲法进行评估和测量。在PACS系统中,对肿瘤位置(声门上区、声门区或声门下区)、临床T分期(T1-T2或T3-T4)和CT报告淋巴结状态(阴性或阳性)进行评估。临床T分期参考2017年美国癌症联合委员会(American Joint Committee on Cancer)第8版肿瘤分期系统。根据此前研究[13-14],CT报告淋巴结阳性应至少满足以下标准之一:①淋巴结短径>10 mm;②强化不均匀,且有内部坏死;③多个淋巴结聚集、融合;④边界不清,周围器官或血管受累。当两人意见存在分歧时,通过协商达成一致。在Syngo via后处理工作站中,获取碘浓度(iodine concentration,IC)图、有效原子序数(effective atomic number,Zeff)图和能谱曲线。选择在肿瘤显示的最大层面上勾画感兴趣区(region of interest,ROI),且ROI范围应至少包含肿瘤最大面积的2/3。勾画时应避开囊变、坏死、血管和钙化等。每个肿瘤测量3次取平均值,并尽量保持不同期相ROI的位置和大小一致。测量的双能量CT参数包括:①标准化碘浓度(normalized iodine concentration,NIC),计算公式:NIC=IC肿瘤/IC颈动脉;②标准化有效原子序数(normalized effective atomic number,nZeff),计算公式:nZeff=Zeff肿瘤/Zeff颈动脉;③能谱曲线斜率(the slope of the spectral hounsfield unit curve,λHU),计算公式:λHU=(CT40keV-CT100keV)/60。取两名医师测量的平均值作为最终结果。
1.4 病理学分析 所有组织标本均经3.7%中性甲醛溶液固定,进行常规脱水和石蜡包埋处理,制备成4 mm厚的切片。采用Ventana Benchmark Ultra自动IHC平台评估LSCC组织中Ki-67的表达水平。由两名具有5 年以上病理诊断经验的医师进行阅片,当观察到肿瘤内细胞核呈棕色时则视其为阳性。随机选择10个典型的高倍视野(×200),计算其中Ki-67 阳性细胞所占的百分比。参考此前研究[7,15],以45%作为界定标准,将患者分为Ki-67低表达组(≤45%)和Ki-67高表达组(>45%)。
1.5 统计学处理方法 采用SPSS26.0和R软件(版本4.1.2,https://www.r-project.org/)进行分析。符合正态分布的计量资料采用±s表示,两组间比较采用独立样本t检验。非正态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-WhitneyU检验。计数资料以频数表示,两组间比较采用χ2检验或Fisher确切概率法。采用单因素和多因素Logistic回归分析确定影响LSCC患者Ki-67高表达的独立危险因素,并建立列线图模型。使用受试者工作特征(receiver operator characteristic,ROC)曲线下面积(area under the curve,AUC)、灵敏度、特异度和准确度评价模型的预测效能。采用Delong检验比较不同模型之间AUC的差异。使用“rms”包进行1 000次重复抽样绘制校准曲线,以Hosmer-Lemeshow检验评价列线图的稳健性。使用“rmda”包进行决策曲线分析(decision curve analysis,DCA),以评价列线图的临床实用性,并计算其在不同阈值概率下的净效益。P<0.05为差异有统计学意义。
2 结果
2.1 临床及病理特征比较 训练集和验证集中,LSCC患者Ki-67高表达的概率分别为55.22%(37/67)和55.17%(16/29)。在训练集中,Ki-67高表达组和Ki-67低表达组间CT报告淋巴结状态和分化程度差异有统计学意义(均P<0.05),其余特征差异均无统计学意义(均P>0.05),见表1。在验证集中,CT报告淋巴结状态和分化程度在两组间差异有统计学意义(均P<0.05),其余特征差异均无统计学意义(均P>0.05),见表2。
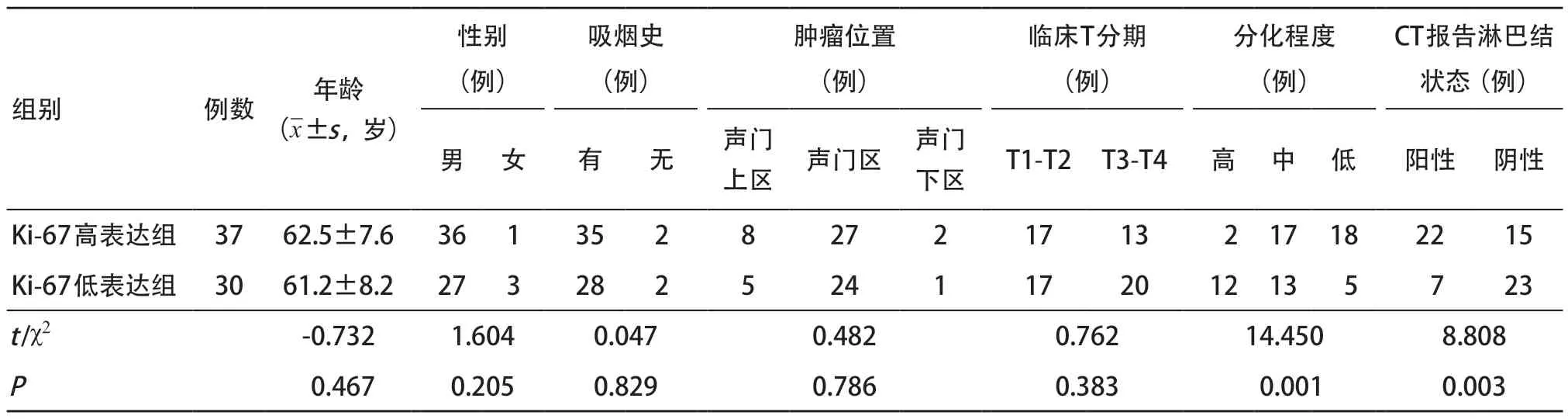
表1 训练集中临床及病理特征比较
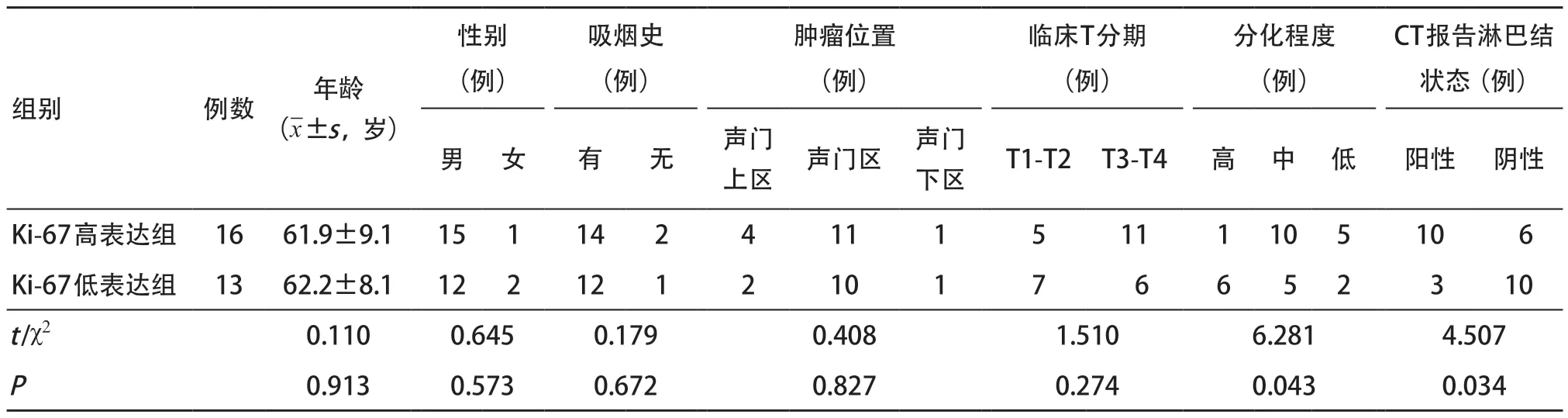
表2 验证集中临床及病理特征比较
2.2 双能量CT参数比较 两名医师对双能量CT参数测量的一致性均良好(组内相关系数:0.821~0.914)。在训练集中,Ki-67高表达组的动脉期NIC、λHU、nZeff及静脉期NIC均高于Ki-67 低表达组(均P<0.05),而静脉期λHU和nZeff在两组间差异均无统计学意义(均P>0.05),见表3和图1。
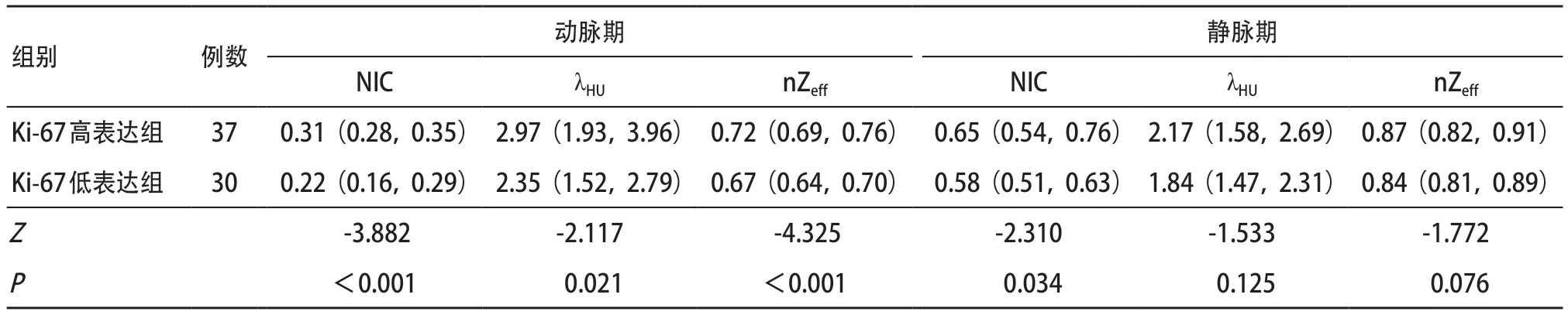
表3 训练集中LSCC患者Ki-67高表达组和Ki-67低表达组双能量CT参数比较[ M(P25,P75)]
2.3 危险因素筛选及模型构建 将两组间P<0.05 的临床病理特征和双能量CT参数纳入多因素Logistic回归分析中,分别建立临床模型、双能量CT模型以及二者联合模型。临床模型纳入CT报告淋巴结状态和分化程度两个特征;双能量CT模型纳入动脉期NIC和动脉期nZeff两个参数;联合模型纳入上述四个指标(见表4),并生成列线图(见图2)。通过各项指标对应得分相加计算出总分,总分所对应的预测风险值即为LSCC患者Ki-67高表达概率。
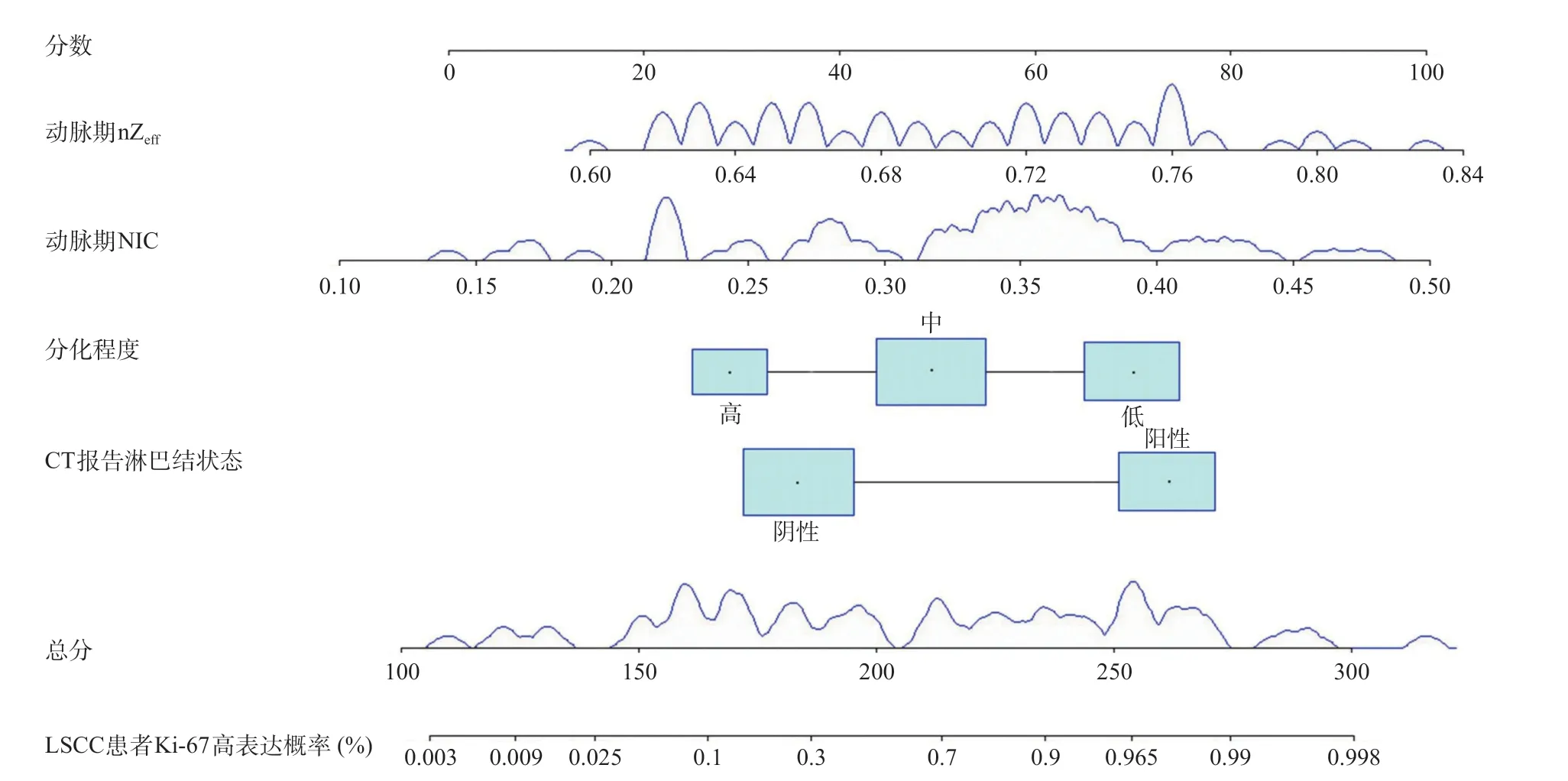
图2 预测LSCC患者Ki-67高表达概率的列线图
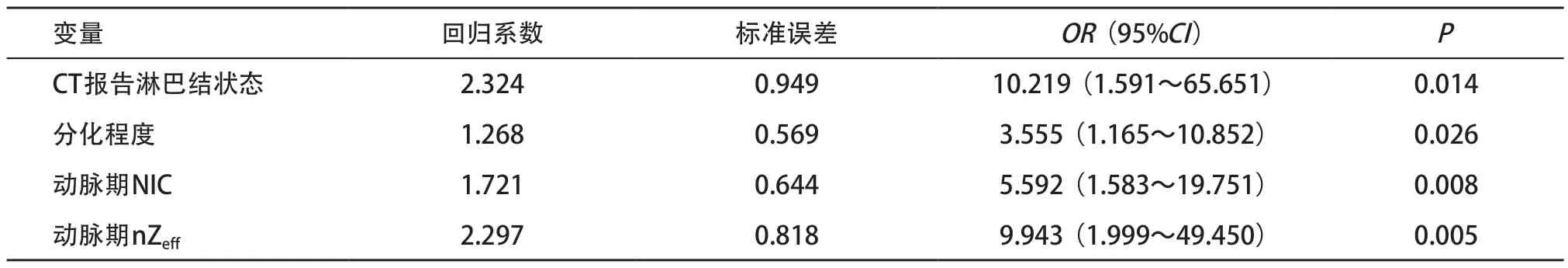
表4 临床病理特征和双能量CT参数的多因素Logistic回归分析结果
2.4 列线图的评估及临床价值 不同模型的灵敏度、特异度和准确度见表5。在训练集中,临床模型、双能量CT模型和列线图的AUC分别为0.809、0.882和0.939;在验证集中,临床模型、双能量CT模型和列线图的AUC分别为0.752、0.834和0.875(见图3A、图3B)。DeLong检验结果显示,在训练集中,列线图的AUC明显高于临床模型(Z=2.758,P=0.006),而与双能量CT模型之间比较无明显差异(Z=1.823,P=0.068)。在验证集中,列线图的AUC与临床模型、双能量CT模型之间比较均无明显差异(Z=1.573、0.767,均P>0.05)。训练集和验证集的校正曲线均接近理想线,表明列线图对Ki-67 表达水平的预测与实际结果拟合度较高(见图3C、图3D)。DCA显示,当训练集中阈值概率为0.03~1.0 和0.52~0.83、验证集中阈值概率为0.33~1.0 和0.34~0.76 时,列线图模型的净获益优于临床模型和双能量CT模型。提示该列线图在预测LSCC患者Ki-67表达水平方面具有更高的临床应用价值(见图3E、图3F)。

图3 训练集和验证集中列线图的ROC曲线、校准曲线、DCA
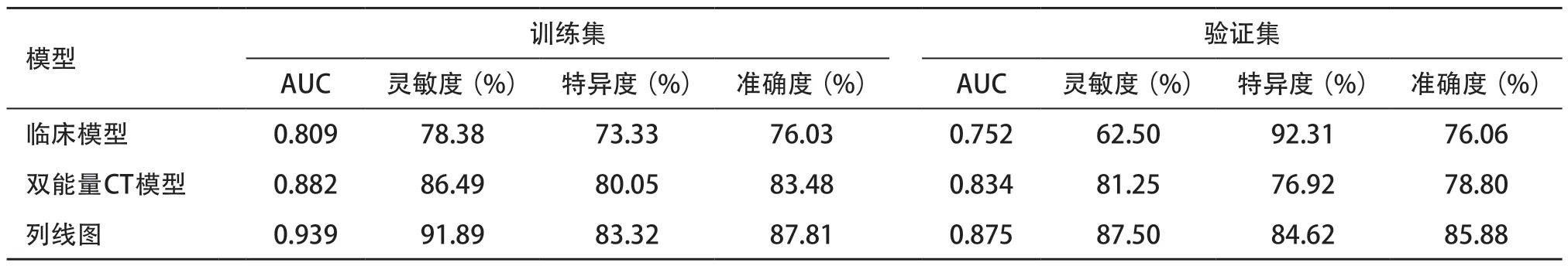
表5 训练集和验证集中不同模型预测效能的比较
3 讨论
术前无创识别LSCC患者的Ki-67表达水平对于其最佳治疗方案选择和预后评估具有重要的临床意义。在本研究中,笔者基于双能量CT参数(动脉期NIC和动脉期nZeff)和临床病理特征(CT报告淋巴结状态和分化程度)构建了一种可视化的列线图模型,用于预测LSCC患者的Ki-67表达水平。ROC曲线分析显示,该列线图在训练集和验证集中均表现出较高的预测性能,AUC分别为0.939和0.875,优于单一的临床模型或双能量CT模型。此外,校准曲线和DCA表明,列线图具有良好的稳健性和临床实用性。
Ki-67 是反映细胞增殖的特异性指标,与恶性肿瘤的发生、发展和转移密切相关[5]。此前已有研究探讨了临床病理特征与LSCC患者Ki-67表达水平之间的相关性。于学文等[16]发现随着Ki-67增殖指数的增加,LSCC患者颈部淋巴结的转移风险将显著升高。另一项关于头颈部鳞状细胞癌的研究[17]指出,Ki-67 表达水平的高低与肿瘤分化程度密切相关。与上述研究相似,在本研究中,Ki-67 高表达组LSCC患者同样更容易观察到CT报告的淋巴结阳性(OR=3.555)和更低的分化程度(OR=10.219)。然而,临床T分期与Ki-67表达水平之间的关系仍存在争议。张晓静等[18]证实T1-T2期LSCC的Ki-67增殖指数明显低于T3-T4期LSCC。然而,在本研究中不同Ki-67表达组间LSCC的临床T分期并无显著差异,这与RODRIGUES等[19]的结果一致。推测可能是肿瘤分期系统主要依赖于解剖学信息,忽略了肿瘤在生物学和病理生理学方面的异质性。进一步将上述特征纳入多因素Logistic回归分析中,建立临床模型。结果显示,该模型对LSCC患者Ki-67表达水平的预测效能一般,在训练集和验证集中的AUC分别为0.809、0.752。这表明仅依赖常规特征可能难以有效鉴别Ki-67 表达水平,有必要寻找另一种更加准确的方式来弥补上述不足。
细胞增殖是肿瘤内部微血管生成和血流供应驱动的发展过程。此前MARCON等[20]证实双能量CT参数中的IC与微血管密度呈正相关,表明IC可作为一种间接反映肿瘤血流灌注的量化指标。然而,在临床实践中,IC的测量可能受到多种因素的影响,如心输出量、对比剂浓度等。因此,本研究引入了NIC,作为IC的校正结果,它可更加准确地反映肿瘤对碘的摄取能力。研究结果显示,Ki-67 高表达组LSCC的动脉期和静脉期NIC均高于Ki-67低表达组,这与既往研究结果[8-11]一致。分析可能是恶性肿瘤具有相似的生物学和病理生理学特征,即持续的细胞高增殖水平促进了更多的新生血管生成。而在不同期相NIC的比较中,笔者发现动脉期NIC在预测Ki-67表达水平方面具有更高的价值。这可能因为头颈部肿瘤通常呈现出速升平台型的强化特点[21],即在注射对比剂后的20~30 s,肿瘤内部血流灌注的差异最为显著。此外,动脉期nZeff是预测Ki-67表达水平的另一个重要指标。既往研究[22]指出,肿瘤内部细胞密度越高,nZeff将越高。在本研究中,与Ki-67低表达组LSCC相比,Ki-67高表达组具有更高的nZeff。推测原因可能是随着Ki-67增殖指数的增加,肿瘤组织中细胞核和细胞质的比例以及大分子蛋白质的含量也随之提高,从而导致细胞密度增加[9]。最近一项研究[23]显示,Ki-67 高表达组头颈部鳞状细胞癌的ADC值低于Ki-67低表达组(P=0.036)。而ADC值通常用于量化水分子在组织中的扩散能力,与组织中的细胞密度呈负相关。因此,这一观点也间接验证了本研究的结论。
本研究存在一些局限性:首先,这是一项单中心、小样本的回顾性研究,未来需要通过来自多个中心的更大队列以及前瞻性研究来验证;其次,为了降低测量误差,笔者排除了小于1 cm的LSCC;第三,尽管已在肿瘤最大层面勾画ROI,但仍可能无法与病理切片选择的组织匹配。
综上所述,本研究发现基于双能量CT参数和临床病理特征构建的列线图能够准确区分LSCC患者的Ki-67表达水平,可为术前实现个体化、精准化医疗决策提供重要的参考依据。

