血管紧张素II通过下调血管内皮钙粘连蛋白抑制血管内皮细胞中紧密连接蛋白1的表达
沈红枫,查渭,金志江,夏海江,刘龙斌
绍兴文理学院附属医院 绍兴市立医院 心血管内科,浙江 绍兴 312000
血管紧张素II(angiotensin II,Ang II)是肾素-血管紧张素-醛固酮系统(renin-angiotensinaldosterone system,RAAS)重要的效应分子之一,可调节多种细胞因子的表达,在生理条件下维持心血管系统的内稳态,在调控血管内皮细胞功能状态中具有重要的作用[1]。在病理条件下,Ang II通过激活多条信号通路来参与血管内膜增生、心肌肥大、心脏重塑等心血管疾病的发生与发展,而使用血管紧张素受体抑制剂(如缬沙坦)能显著延缓上述病理过程[2]。研究[3]显示Ang II可以通过引发微血管通透性增加,从而参与多种心血管疾病的进展,但是其破环微血管的具体机制目前尚未阐明。
血管内皮细胞屏障的完整性是维持正常血管通透性的基础。血管内皮细胞之间存在着许多紧密连接。这些紧密连接常围绕细胞的顶端并呈连续带状,使相邻的内皮细胞紧密连接在一起,填充细胞间隙,形成一道天然的物理屏障,起着维持细胞内环境稳态、选择性通透等细胞基本功能的作用[4]。紧密连接相关跨膜蛋白(zonula occludens-1,ZO-1)是细胞间紧密连接的主要成分,其在内皮细胞中的表达和分布对内皮细胞紧密连接的功能具有决定性的作用[5]。孙瑞等[6]发现通过微小RNA干预内皮细胞进而调控其ZO-1蛋白的表达升高,能有效抑制缺氧导致的血管通透性增高。同时,有研究[7]表明雷公藤内酯干预在增加ZO-1蛋白表达的同时可以提高结肠内膜的紧密连接数量。本研究拟通过细胞实验检测Ang II对内皮细胞中ZO-1表达及分布的影响,以及血管内皮钙粘连蛋白(vascular endothelialcadherin,VE-cadherin)在其中的作用,以期探究Ang II破环微血管内皮细胞屏障的可能机制。
1 材料和方法
1.1 材料 M199培养液、胰蛋白酶购自美国Sigma公司;胎牛血清购自美国GIBCO公司;RNA提取试剂购自美国Invitrogen公司;Takara反转录试剂盒购自大连宝生物公司;SYBR Green荧光染料试剂盒购自美国Roche公司;兔或鼠抗人ZO-1、VE-cadherin、β-actin多克隆抗体和辣根过氧化酶标记的二抗购自美国ABCAM公司;脂质体2000购自美国Invitrogen公司;蛋白质印迹(Western blot)相关试剂购自上海碧云天生物技术有限公司;VE-cadherin过表达质粒由上海吉玛制药技术有限公司设计合成。
1.2 方法
1.2.1 细胞培养和分组:大鼠主动脉内皮细胞通过I型胶原酶酶消化法分离获得,并在含20%胎牛血清的内皮细胞培养基中继续培养[8]。细胞分为对照组、Ang II组、Ang II+缬沙坦组以验证Ang II对细胞通透性的影响。根据是否使用Ang II和VEcardherin过表达干预内皮细胞,分别设置对照组、Ang II组和Ang II+VE-cadherin过表达组,并予以对应干预。
1.2.2 细胞转染:将内皮细胞系接种至6孔板,生长至50%~70%密度时,以脂质体2000分别转染VEcadherin过表达质粒或空质粒各100 pmol,24 h后提取总RNA/蛋白后,实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)鉴定转染效率,进行后续实验。
1.2.3 RT-qPCR检测基因表达:提取内皮细胞中总RNA,将提取的RNA反转录成cDNA,反应体系为20 μL,反应条件为:37 ℃、15 min反转录,85 ℃、5 s反转录酶失活,4 ℃保存。运用SYBR Green法检测ZO-1 mRNA、VE-cadherin mRNA的表达情况,反应条件为:94 ℃、15 min预变性,94 ℃、30 s变性,60 ℃、30 s退火,72 ℃、30 s延伸,共循环40次。每组样品重复3次,实验重复3次。
1.2.4 Western blot法检测蛋白表达量:提取各组细胞中的总蛋白,用BCA法定量蛋白,SDS-PAGE胶每孔加入20 μL的样品,75 V、30 min进行蛋白浓缩,110 V、2 h进行蛋白电泳,并用孔径0.45 μm的PVDF膜240 mA、90 min进行转膜。转膜后常温下TBST洗膜3次、封闭1 h后,以1:1 000浓度加入兔(鼠)抗人ZO-1一抗(或抗VE-cadherin、β-actin一抗),4 ℃孵育过夜,常温下TBST洗膜3次,辣根过氧化物酶标记羊抗兔(鼠)二抗孵育后ECL化学发光法检测。柯达胶片暗室显影,Quantity One软件分析。
1.2.5 细胞免疫荧光法检测ZO-1在细胞中的分布及表达:各组细胞干预结束后,PBS洗3遍,用4%多聚甲醛固定,0.25% Triton X 100穿破细胞膜,山羊血清室温封闭1 h,加入稀释了250倍的ZO-1抗体,4 ℃过夜,PBST清洗3遍,加入结合有FICT的山羊抗兔二抗,室温孵育1 h,PBST清洗3遍,荧光显微镜拍照后图片用Image pro plus 6.0分析。
1.3 统计学处理方法 采用SPSS20.0软件进行统计学分析。计量资料用±s表示,多组间均数比较用单因素方差分析,组间两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Ang II抑制内皮细胞中ZO-1表达水平和细胞膜分布 相比于对照组,Ang II组ZO-1的mRNA和蛋白表达量均显著降低(P<0.01),且ZO-1蛋白在细胞膜上表达趋势减弱;与Ang II组比,Ang II+缬沙坦组内皮细胞ZO-1 mRNA和蛋白表达量显著增加(P<0.01),且ZO-1蛋白在细胞膜上的表达恢复,见图1。
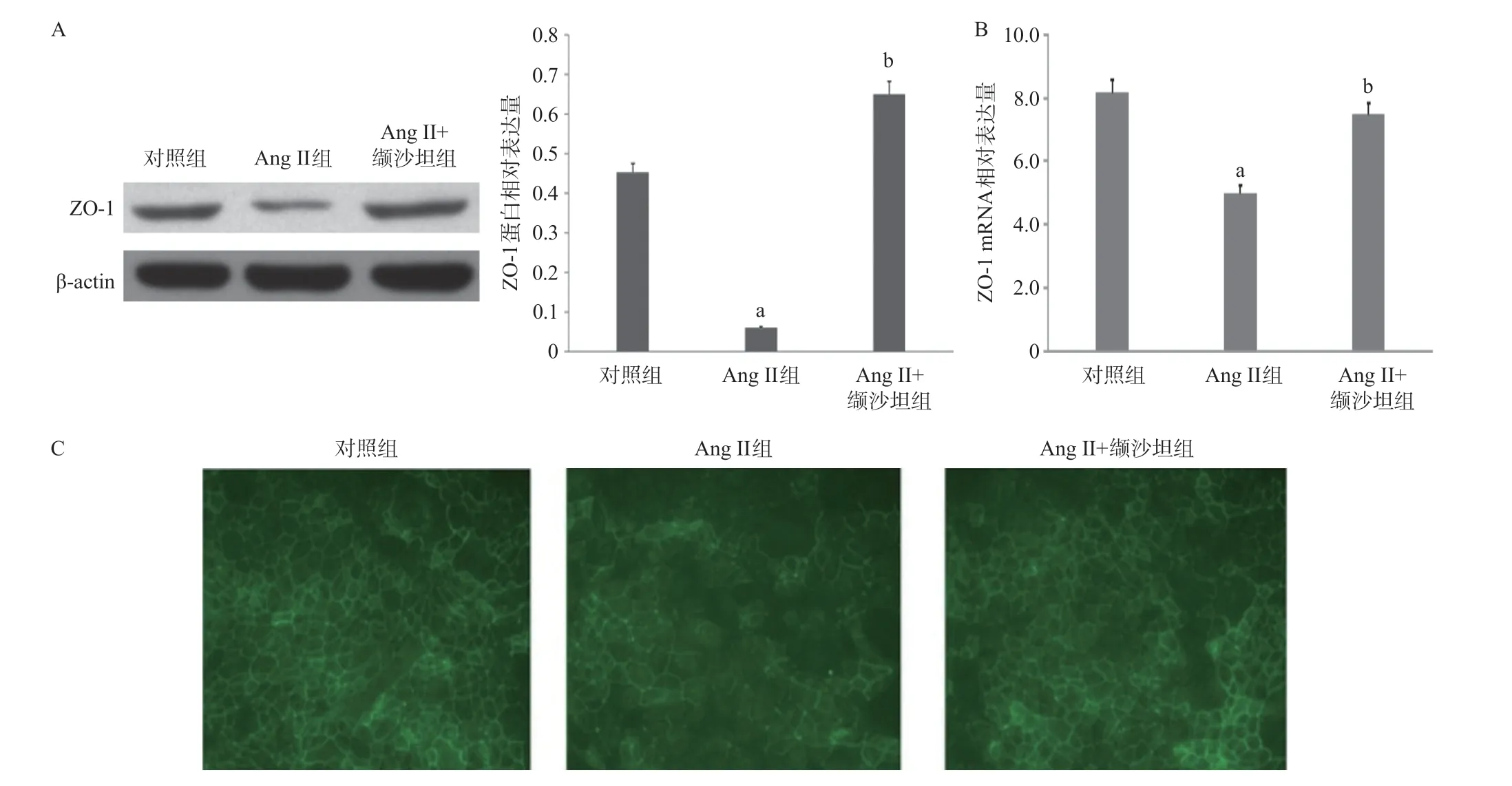
图1 Ang II对内皮细胞中ZO-1表达及分布的影响
2.2 Ang II对内皮细胞中VE-cadherin表达的影响 与对照组比较,Ang II组中VE-cadherin蛋白的表达减少(P<0.01),VE-cadherin mRNA的表达也减少(P<0.01);相比于Ang II组,Ang II+缬沙坦组内皮细胞中VE-cadherin表达增加(P<0.01),见图2。
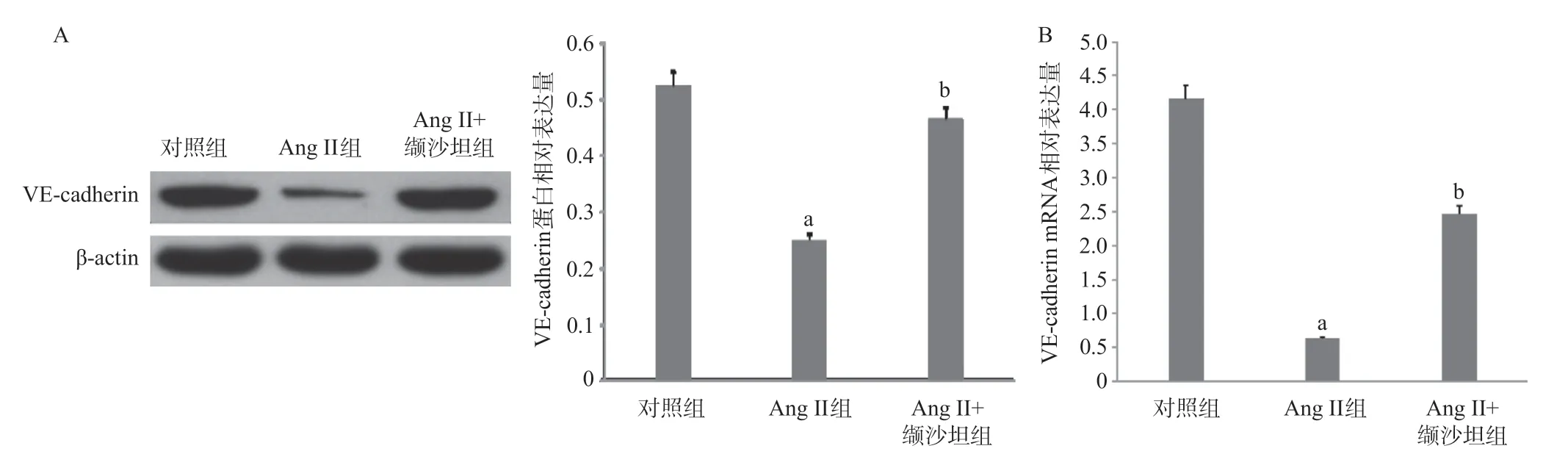
图2 Ang II抑制内皮细胞中VE-cadherin的表达
2.3 VE-cadherin过表达质粒逆转成功 脂质体2000分别转染VE-cadherin过表达质粒或者空质粒后,相比于空白对照组,空质粒组和VE-cadherin过表达质粒组中都可以观察到绿色荧光的质粒,见图3A。RT-qPCR检测结果显示,相比于空白对照组和空质粒组,VE-cadherin过表达组内皮细胞中VEcadherin mRNA表达升高(P<0.01),见图3B。

图3 VE-cadherin过表达质粒转染成功
2.4 VE-cadherin过表达质粒逆转Ang II的作用与对照组比,Ang II组内皮细胞中ZO-1表达降低(P<0.01);相比于Ang II组,Ang II+VE-cadherin过表达组内皮细胞中ZO-1表达增加(P<0.01),见图4A;Ang II+VE-cadherin过表达组相较于Ang II组,细胞膜上ZO-1表达显著增强,见图4B。
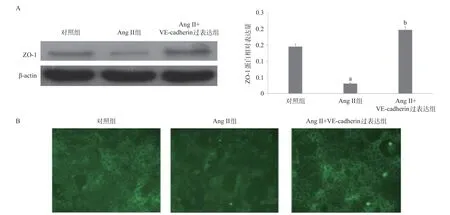
图4 VE-cadherin过表达质粒逆转Ang II的作用
3 讨论
血管内皮细胞对维持正常血管通透性具有关键性作用,内皮功能损伤是多种心血管疾病的关键环节。近年来,Ang II对血管内皮细胞功能的影响越来越受到国内外心血管系统研究者的关注。Ang II可通过刺激产生活性氧、促进血栓形成、抑制一氧化氮产生以及促进血管内皮细胞凋亡等多种途径促使细胞功能受损。研究[9-10]表明,Ang II可通过抑制血管内皮细胞中一氧化氮合酶,诱导细胞中炎症反应等作用损伤内皮细胞。最近又有研究[11-12]表明Ang II可以通过破环微血管通透性从而参与多种心血管疾病的进展。
ZO蛋白包括3个异构体ZO-1、ZO-2和ZO-3,三者以异聚体形式组成复合体,并通过与occludin、claudin和肌动蛋白相连接,对维持紧密连接复合体(tight junction complex,TJC)完整性和功能发挥有着重要的作用。有研究[13]表明,不管是抑制ZO-1蛋白的表达还是干预ZO-1蛋白的关键氨基酸序列,都会增加上皮细胞通透性,提高药物呈递效率[13-14]。张冰等[15]发现溃疡性结肠炎小鼠结肠组织ZO-1蛋白表达水平下降,而中药复方制剂能逆转ZO-1蛋白的表达下调,进而起到保护肠道屏障的作用。在本研究中,Ang II不仅可以减少内皮细胞中ZO-1蛋白的表达,还可以使原先规则分布在细胞膜周围的ZO-1分布变得紊乱,提示Ang II可破坏内皮细胞间的紧密连接,这可能是其引发微血管通透性增加的机制。
钙粘连蛋白(cadherin)家族是一组介导同型细胞黏附的钙依赖性I型跨膜糖蛋白,参与形成和维护正常细胞间的连接和极性,对干细胞分化、肿瘤细胞侵袭转移、细胞增殖也具有一定的调控作用[16]。VE-cadherin属于经典cadherin家族,主要分布于内皮细胞,是内皮细胞所特有的cadherin,介导内皮细胞细胞间的连接[17]。研究[18]发现,VEcadherin除了介导细胞间连接之外,同时也具有传导细胞间信号的作用。MAHALANOBISH等[19]研究发现,VE-cadherin参与了Ang II诱导肺微血管内皮细胞屏障损伤,而通过褪黑素上调VE-cadherin水平能有效拮抗Ang II以前的肺部水肿,减轻肺部毛细血管的细胞凋亡水平。此外,MÜLLER等[20]研究发现,VEcadherin和claudin-5还能同时被miR-125a靶向抑制,从而引起巨噬细胞浸润和局部血管炎症水平增加。本研究发现,Ang II在抑制ZO-1表达的同时,也可以抑制细胞中VE-cadherin的表达,所以我们推测Ang II可能是通过下调VE-cadherin的表达从而发挥抑制血管内皮细胞中ZO-1蛋白的表达的作用。为了进一步验证这一推测,我们构建了VE-cadherin过表达质粒,发现事先用VE-cadherin过表达质粒转染内皮细胞后,Ang II不能再抑制细胞中ZO-1蛋白的表达。综上所述,Ang II可通过下调VE-cadherin的表达从而抑制血管内皮细胞中ZO-1蛋白的表达,这可能是Ang II引发微血管通透性增加的分子机制。

