槲皮素可改善大鼠肺动脉高压:基于调控HMGB1/RAGE/NF-κB通路
张宁宁,邱 奇,陈永锋,孙正宇,卢国庆,王 磊,康品方,王洪巨
蚌埠医学院1第一附属医院心血管内科,2心脑血管病研究中心,生理学教研室,安徽 蚌埠233000
肺动脉高压(PAH)是由多种病因引起的肺血管阻力和肺动脉压力进行性增高的肺血管疾病,其病理改变包括内皮功能障碍、血栓形成、慢性炎症、肺小动脉闭塞、肺血管收缩及肺动脉平滑肌细胞(PASMCs)过度增殖所致肺血管重塑[1]。PAH早期缺乏典型临床表现,每年全球患病人数为15~50万,由诊断到死亡的中位生存期为2.8年[2,3],一旦诊断出PAH,其预后往往较差。因此,早期诊断和治疗是有效预防疾病进展及改善预后的关键。
目前PAH的发病机制尚不明确,有研究发现炎症与PAH发病密切相关[4,5]。高迁移率族蛋白B1(HMGB1)可结合晚期糖基化终产物受体(RAGE),二者结合后激活核因子κB(NF-κB)[6],调控炎症和免疫反应[7]。关于HMGB1/RAGE/NF-κB炎症通路,已被证实参与到多种肺部疾病,包括急性肺损伤、肺癌、肺纤维化[8-10]。然而,HMGB1/RAGE/NF-κB是否介导炎症促进PAH疾病进展尚不清楚。
槲皮素是一种膳食生物类黄酮,具有显著的抗氧化、抗癌、抗炎和抗病毒等药理学作用[11,12]。相关报道表明槲皮素可缓解脓毒症所致肺损伤、减轻肺纤维化、抑制肺癌细胞增殖[13-15],提示槲皮素在防治肺部疾病方面发挥巨大潜力。有研究表明,槲皮素可治疗肺动脉高压[16],但槲皮素治疗缺氧性肺动脉高压的机制尚不明确,槲皮素的抗炎作用是否通过HMGB1/RAGE/NF-κB炎症机制治疗PAH尚未见相关文献报道。因此,有必要进一步探讨槲皮素对缺氧性肺动脉高压的具体作用,并阐明潜在的分子机制和关键信号通路。
1 材料和方法
1.1 仪器与试剂
异氟烷(瑞沃德生命科技有限公司);戊巴比妥钠(北京普博斯生物有限公司);槲皮素(Sigma);BCA试剂盒(碧云天);兔抗大鼠HMGB1抗体(Abclonal);兔抗大鼠RAGE 抗体(Bioss);兔抗大鼠NF-κB 抗体(Cell Signaling Technology);小鼠抗大鼠β-actin 抗体(Affinity),兔抗大鼠Bax抗体(abclonal);兔抗大鼠Bcl-2抗体(abclonal),cleved Caspase-3抗体(Cell Signaling Technology),山羊抗小鼠二抗(Biosharp)和山羊抗兔二抗(Biosharp);小动物超声机(Visual Sonics);生物信号采集系统(南京美易有限公司);化学发光成像系统(FluorChem M)。
1.2 实验动物
6~8 周龄SPF 级SD 雄性大鼠24 只(体质量180~220 g 济南郎悦实验动物繁育有限公司,SCXK20190003)。本研究经蚌埠医学院伦理委员会审核批准(伦理编号:2019-074号),动物的养护及处理严格遵守《实验动物管理条例》进行。
1.3 大鼠缺氧性肺动脉高压模型建立及实验动物分组
根据参考文献及前期预实验结果,选择槲皮素(100 mg/kg)作为给药剂量[17],将24只雄性SD大鼠随机分为常氧组对照组(CON组,n=8)、缺氧组(Hypoxia组,n=8)、缺氧槲皮素灌胃组(Hypoxia+Que组,n=8),适应性喂养1周后进行建模。CON组大鼠置于正常环境中,Hypoxia 组和Hypoxia+Que 组置于常压低氧舱内,大气压101.325 kPa,氧浓度(10±0.5)%;每天缺氧前Hypoxia+Que组给予既定槲皮素灌胃,正常组和缺氧组给予等量生理盐水。根据前期预实验,每日对大鼠进行8~10 h缺氧,每周缺氧6 d,休息1 d,持续4周,舱内放置钠石灰和无水氯化钙,分别吸收CO2和水蒸气,本研究动物实验遵循国际通用实验动物福利和伦理原则。
1.4 超声心动图检测大鼠右心室及肺动脉超声相关指标
各组大鼠缺氧4周后备皮行B超检查,将各组大鼠依次放入小动物麻醉箱中。使用异氟烷作为麻醉诱导剂,调整流速为3 L/min,待大鼠疲软、无翻正反射后,将大鼠固定于载鼠板。以口鼻吸入异氟烷并调整流速1.5 L/min维持麻醉,四肢涂抹导电胶,胸前涂抹导超声耦合剂,使用MS-250超声探头进行超声检查。选择M模式在右心室长轴切面测量右心室游离壁厚度(RVFW);选择Color模式在左心室短轴切面调整探头,寻找肺动脉血流后选择PW模式,检测肺动脉加速时间(PAT)和肺动脉射血时间(PET)。
1.5 肺动脉压力测定
所有测压大鼠均已脱离超声心动检查时间,确保超声操作无影响后,继续进行后续测压工作。予各组大鼠腹腔注射戊巴比妥钠(浓度为2%,剂量2 mL/kg)麻醉,仰卧固定于动物操作台,碘伏消毒大鼠右侧颈外部位。以眼科手术剪在大鼠右颈外做一斜形切口,逐层分离右颈外静脉,自右颈外静脉插入导管,经上腔静脉、右心房、右心室,另一端连接生物信号采集系统监测并记录数据,测定右心室压力(RVSP)作为肺动脉收缩压。
1.6 右心室肥厚指数(RVHI)的测定
对大鼠进行右心室压力测定后,迅速开胸,头皮针立即穿刺大鼠心尖,连接注射器,抽取适量生理盐水缓慢推注冲洗肺直至双肺变白。游离心脏与肺,置于预冷过的4℃K-H液中漂洗,去除心脏周围血管及脂肪组织,滤纸吸净心脏周围水分。沿右心室缘小心剪去右心室(RV)并称重,余组织为左心室加室间隔(LV+S),称重并计算RVHI,公式为RV/LV+S。
1.7 HE染色观察肺小动脉
收集冲洗干净的肺组织,游离左下肺,用4%多聚甲醛固定24 h,乙醇梯度醇洗及脱水,石蜡包埋。使用二甲苯将固定的肺组织切片,进行HE染色;使用显微镜观察和记录,拍照观察肺血管形态。选取肺小动脉(直径为150 μm 以下),测量外部直径(ED)、内侧壁厚度(MT)、管腔横截面积(VA)和血管总截面积(TVA),计算VA%=VA/TVA×100%,MT%=MT/ED×100%作为肺小血管重构的标准。
1.8 Western blot检测各组大鼠肺组织相关蛋白
取每只大鼠肺组织30 mg,放入对应的研磨管中,各管加入10 μL/mg 的RIPA 裂解液和0.1 μL/mg 的PMSF蛋白酶抑制剂提取组织总蛋白。BCA法蛋白定量,加入蛋白上样缓冲液后定量30 μg上样电泳,后将蛋白转至PVDF膜,5%脱脂牛奶封闭室温封闭2 h。兔抗大鼠HMGB1 抗体、兔抗大鼠RAGE 抗体、兔抗大鼠NF-κB抗体、兔抗大鼠Bax抗体、兔抗大鼠Bcl-2抗体、兔抗大鼠cleved Caspase-3抗体(1∶1000)和小鼠抗大鼠β-actin抗体(1∶5000)孵育过夜。山羊抗小鼠二抗、山羊抗兔二抗(1∶4000)孵育2 h,TBST洗膜3次后曝光、显影。Image J软件分析蛋白表达水平。
1.9 统计学处理
采用GraphPad Prism 9进行统计处理,定量数据采用均数±标准差表示,多组间比较采用单因素方差分析,组间比较使用Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠一般情况及体质量增长评估
一般情况评估:CON组体质量增速较快;缺氧4周后,Hypoxia组大鼠体质量增速明显减慢;Hypoxia+Que组体质量增速较CON组减慢,而较Hypoxia组增快,差异无统计学意义(P>0.05,图1)。
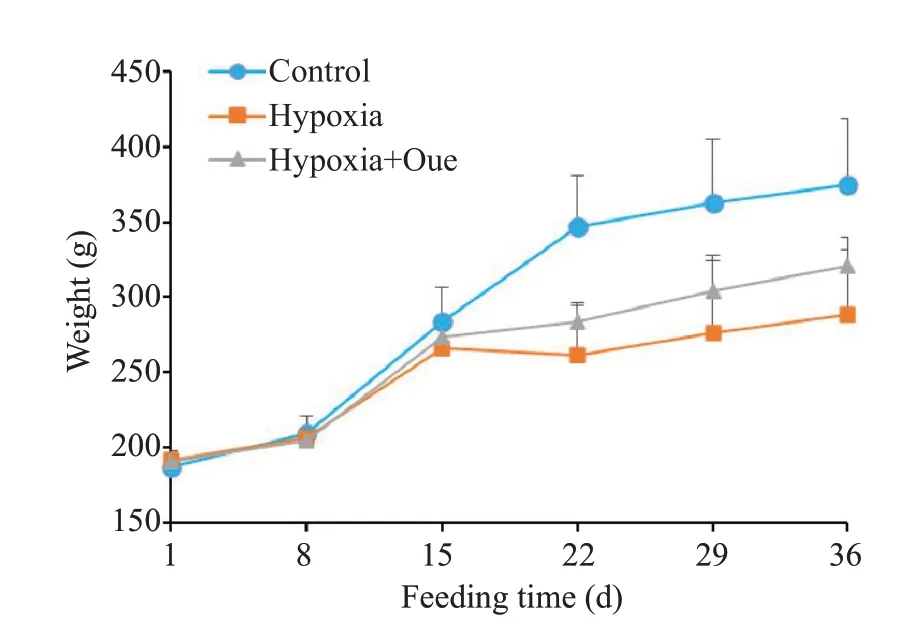
图1 各组大鼠体质量增长情况Fig.1 Weight gain of the rats in each group(Mean±SD,n=6).
2.2 各组右心室压力与右心室肥厚指数对比
与CON组比较,Hypoxia组RVSP和RVHI明显升高(P<0.01);与Hypoxia组相比,Hypoxia+Que组RVSP和RVHI明显减低(P<0.01,表1,图2)。

表1 右心室压力及右心室肥厚指数Tab.1 Right ventricular systolic pressure(RVSP)and hypertrophy index(RVHI)in each group(Mean±SD,n=6)

图2 各组大鼠右心室压力对比Fig.2 Changes in right ventricular systolic pressure in each group(Mean±SD,n=6).
2.3 缺氧性肺动脉高压大鼠模型心脏超声的变化
与CON组相比,Hypoxia组PAT/PET明显减小,而RVFW 明显增加(P<0.01);而与Hypoxia 组相比,Hypoxia+Que组PAT/PET明显增加,RVFW明显减少(P<0.01,表2,图3A、B)。
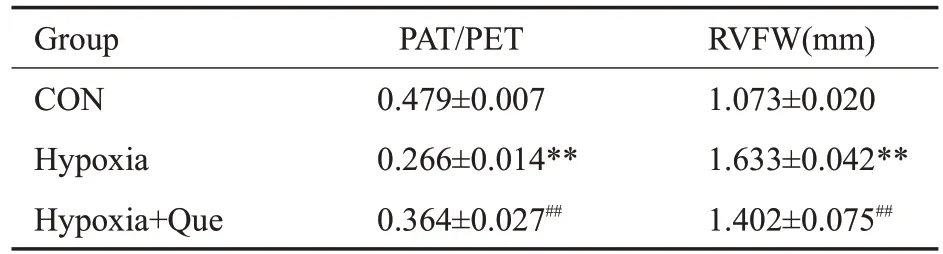
表2 肺动脉加速时间/肺动脉射血时间和右心室游离壁厚度Tab.2 Pulmonary artery acceleration time/pulmonary artery ejection time and right ventricular thickness in each group(Mean±SD,n=3)
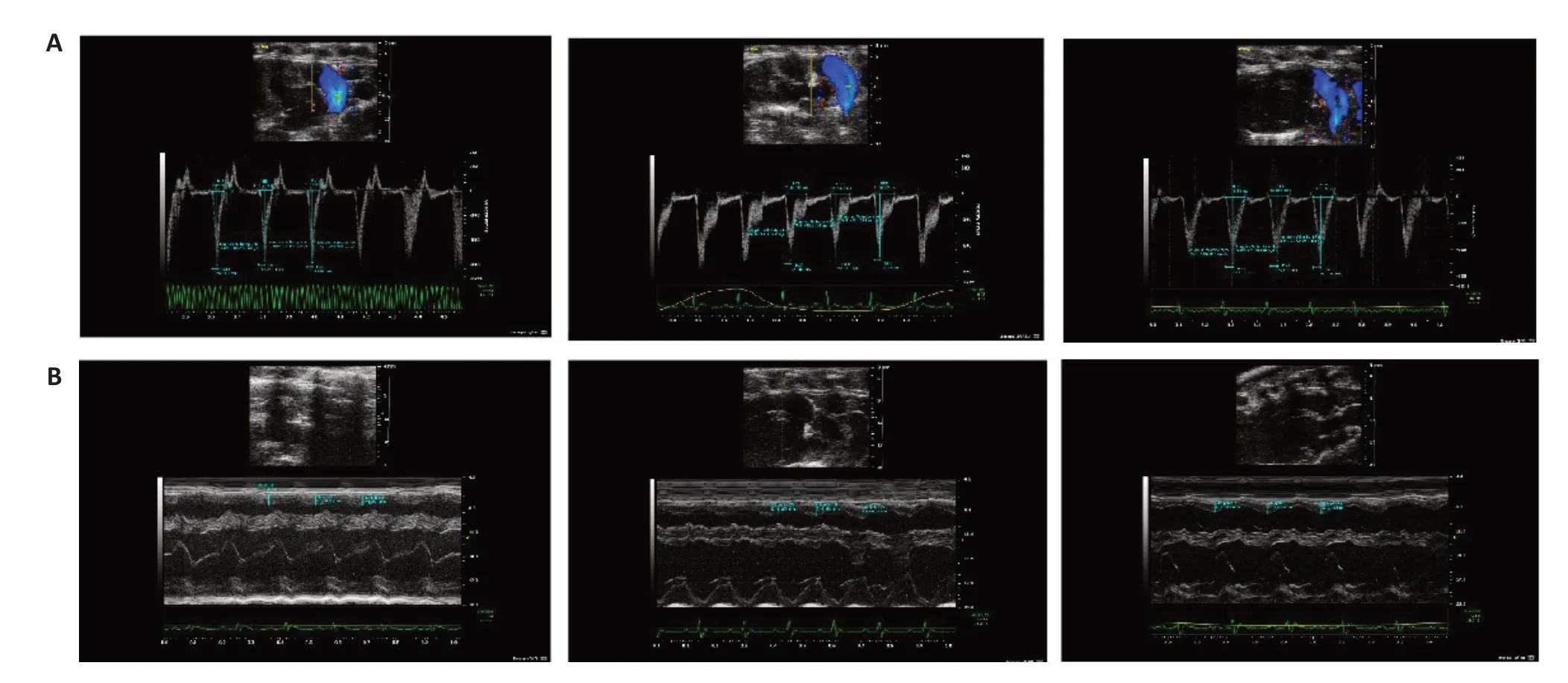
图3 各组大鼠心功能各指标变化Fig.3 Representative M-Mode images showing changes in cardiac function indexes in each group(Mean±SD,n=3).A:Comparison of pulmonary artery acceleration time/pulmonary artery ejection time.B:Comparison of right ventricular free wall thickness.
2.4 HE染色观察各组大鼠肺小动脉重构
与CON组比较,Hypoxia组肺动脉血管壁明显增殖增厚、MT/ED比值增加(P<0.01),管腔狭窄、VA/TVA比值增加(P<0.01);而与Hypoxia 组相比,Hypoxia+Que组血管壁变薄MT/ED比值降低(P<0.05),管腔狭窄程度减轻,VA/TVA比值降低(P<0.05,图4)。
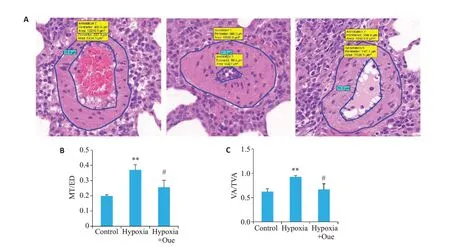
图4 各组大鼠肺小动脉重构变化Fig.4 Observation of pulmonary arteriole remodeling in each group.A:HE staining of the pulmonary arterioles in each group(HE staining,original magnification:×30).B,C:Pulmonary arteriole remodeling parameters.**P<0.01 vs CON group,#P<0.05 vs Hypoxia group.MT/ED:Medial wall thickness of pulmonary arterioles/external diameter of pulmonary arterioles;VA/TVA:Middle wall cross-sectional area/and total vessel cross-sectional area.
2.5 Western blot 检测各组各组大鼠肺组织HMGB1、RAGE、NF-κB、Bax、cleved-caspase3、Bcl-2的表达
与CON组相比,Hypoxia组HMGB1蛋白表达升高(P<0.01)、RAGE蛋白和NF-κB蛋白表达升高(P<0.01),Hypoxia+Que 组HMGB1 蛋白和NF-κB 表达降低(P<0.05)、RAGE 蛋白表达降低(P<0.01,图5A);与CON组相比,Hypoxia组Bcl-2蛋白表达升高(P<0.01)、Bax 蛋白和Cleved-caspase3 蛋白表达减少(P<0.01),Hypoxia+Que组Bcl-2蛋白表达降低(P<0.05)、Bax蛋白和Cleved-caspase3蛋白表达升高(P<0.01,图5B)。
3 讨论
关于PAH 的发病机制尚不明确,但缺氧是触发PAH的确切因素[18],缺氧时PASMCs膜外向钾流受抑制,使细胞膜去极化,钙离子通道开放频率增加,钙离子内流增多导致肺血管收缩,刺激平滑肌细胞增殖[19,20]。此外,缺氧促进肺组织及周围血管形成血栓、发生炎症反应,炎症与血栓相互作用加速肺血管重塑[21]。PAH的关键病理学变化是肺血管重塑,PASMCs的异常增殖与凋亡失衡在肺血管重构中起重要作用[22]。因此,我们利用缺氧构建肺动脉高压动物模型,研究肺动脉高压疾病进展中的炎症和凋亡作用。本研究结果显示,缺氧组肺动脉压力明显升高,右心室肥厚指数增加;心脏超声显示右心功能恶化,右心室游离壁厚度增加、肺动脉血流加速时间与肺动脉射血时间比值减小;同时,肺小动脉明显重构,包括肺动脉管腔堵塞面积百分比增大、肺动脉血管壁明显增殖增厚。此外,炎症标志物HMGB1、RAGE 和NF-κB 蛋白表达增加,促凋亡蛋白Bax、Cleved-caspase3 表达降低、抗凋亡蛋白Bcl-2 水平增加,以上结果提示:缺氧伴随炎症发生和凋亡减少,促进PAH疾病进展。
HMGB1位于细胞核内,在细胞坏死或细胞受损时释放至细胞外,并作为损伤相关分子模式分子,通过结合不同受体来调节炎症和免疫反应[23]。RAGE在缺氧和血管损伤时释放与HMGB1结合[24],二者结合时启动细胞内信号刺激,引起炎症转录因子(NF-κB)的激活[6],调节多种促炎细胞因子和趋化因子的产生和分泌,调控炎症和免疫反应[7]。作为重要的炎症因子,HMGB1/RAGE/NF-κB已被证实参与多种疾病包括炎症性肠病、海马神经炎、糖尿病肝损伤等[25-27],而本研究关注HMGB1/RAGE/NF-κB在PAH中的作用。临床研究证实,持续性新生儿肺动脉高压患儿血清HMGB1水平显著升高,HMGB1水平在PPHN缓解后显著下降,并且HMGB1改变与血清肿瘤坏死因子-α和白细胞介素-6水平成正相关[28],而RAGE也被证实参与PAH血管重塑中的细胞关键事件,包括细胞增殖和迁移[29],RAGE浓度升高反映炎症持续和血管损伤的程度[30]。因此,我们推测HMGB1/RAGE/NF-κB可能在PAH发病机制中起关键作用。为明确HMGB1/RAGE/NF-κB炎症通路和凋亡标志物Bax、Cleved-caspase3、Bcl-2是否参与PAH,我们观察以上蛋白表达情况,结果显示缺氧后肺组织HMGB1、RAGE、NF-κB 蛋白表达上调,促凋亡蛋白Bax、Cleved-caspase3表达降低、抗凋亡蛋白Bcl-2水平增加,提示炎症发生和凋亡减少可能与PAH发病机制密切相关,抑制炎症和促进凋亡可能是改善PAH的重要治疗策略。
细胞凋亡是一种可调节性细胞死亡,PASMC中的细胞凋亡机制十分复杂,有研究认为缺氧条件下可减弱PASMC电压门控钾通道,其功能丧失和表达下调抑制了凋亡介质半胱天冬酶活性,破坏PASMC增殖和凋亡平衡,促进肺血管内侧肥厚[31]。本研究证实缺氧促进PAH过程中发生凋亡减少,与文献报道一致,然而钾通道种类众多,对细胞也可能表现出不同的增殖或凋亡作用。目前关于缺氧作用于钾通道促进PASMC凋亡的机制仍不明确,还需进一步研究。
已知槲皮素具有显著的抗氧化、抗癌、抗炎和抗病毒等药理学作用[11,12],在肺部疾病中其通过抑制细胞异常增殖、诱导细胞凋亡、缓解肺部炎症发挥治疗作用,包括抑制活性氧和降低HMGB1表达缓解脓毒症所致肺损伤[13]、促进凋亡标志物Bax表达和降低Bcl-2的表达治疗肺癌[14]、促进衰老成纤维细胞凋亡和减少成纤维细胞增殖改善肺纤维化[15]。为进一步分析炎症在PAH中的作用,本研究使用槲皮素进行干预,结果显示,与Hypoxia组相比,Hypoxia+Que组肺动脉压力降低,右心室肥厚指数减小,心脏超声显示右心室游离壁厚度减小、肺动脉血流加速时间与肺动脉射血时间比值增加,同时,肺小动脉重构减轻,炎症损伤减轻和凋亡增加,表现为HMGB1、RAGE和NF-κB水平降低,Bax、Clevedcaspase3蛋白表达增加和Bcl-2蛋白表达降低,证实槲皮素通过抑制HMGB1/RAGE/NF-κB通路和促进凋亡改善PAH。
综上所述,本研究发现HMGB1/RAGE/NF-κB炎症通路在肺动脉高压大鼠中表达增加,伴随凋亡减少,槲皮素可能通过抑制炎症和促进凋亡对PAH起治疗作用。抑制HMGB1/RAGE/NF-κB可能成为治疗PAH的关键信号通路,未来其是否能作为PAH的治疗策略有待进一步探讨,以期为PAH的临床治疗提供更多可能。