正方形力学约束对微组织非均一性的影响*
窦婷, 邓林红△, 王翔△
(1.常州大学 生物医学工程与健康科学研究院,常州 213164;2.常州大学 药学院,常州 213164;3.常州大学 生物与食品工程学院,常州 213164)
0 引言
生物组织是一种复杂、非均一的结构[1-2]。因胶原纤维排列不同而显示出不同的致密化水平和硬度[3]。由高度排列的I型胶原组成的肌腱组织硬度高[4-5],而由各向同性的胶原纤维组成的组织,如肝[6]、肾[7]或动脉壁[8]等,相对更柔软。组织硬度是调节细胞功能(如干细胞分化[9],癌症侵袭[10]和纤维化进展[11])的重要生物力学因素之一。较软基质[12]有利于间充质干细胞分化为神经元细胞;中等硬度促进肌源性分化;硬质基质促进成骨分化[13];血管的生成受基底硬度调节[4];肿瘤细胞簇[14]通常包裹于致密而坚硬的细胞外基质中,并以此充当屏障,免受化疗药物的影响[15]。故此,对组织内部结构致密化水平的研究具有重要的生物学和医学意义。
力学微环境是组织非均一性结构形成的重要调节因素[16-17]。在无外界力学约束的情况下,微组织自由收缩。其中,细胞和胶原蛋白呈随机分布。在由四个微柱构成的垂直双轴约束条件下[18],微组织缺乏单向的细胞和基质纤维排列,因此,保持机械各向同性[19]。而双微柱装置[20]产生的单轴力学约束,可诱导微组织在约束方向上形成与各向异性相关的细胞和纤维排列[4,21]。因此,可通过改变培养过程中的力学边界条件来控制微组织致密化[22]过程中基质的各向异性。但是,闭合二维边界条件如何影响微组织的非均一性结构形成,尚不清楚。本研究设计并制备了一种正方形聚二甲基硅氧烷(polydimethylsiloxane,PDMS)微弦装置。该闭合边界条件可产生非均一的力学约束。实验结果表明,PDMS微结构上的3T3和胶原混合物在48 h后,自发收缩形成稳定的微组织。在不同约束区域中,细胞排列及细胞外基质均具有明显差异,且导致不同的大分子通透性。
1 材料与方法
1.1 材料、试剂与仪器
Sylgard 184(Dow Corning公司);三氯(1H,1H,2H,2H-全氟辛基)硅烷、鬼笔环肽(Af647-Phalloidin)、4 kDa、40 kDa (FITC-dextran)葡聚糖(Sigma公司);聚乙烯醇(polyvinyl alcohol,PVA),单分散荧光微球(阿拉丁生化科技股份有限公司);鼠尾I型胶原 (Advanced Biomatrix公司);杜氏改良培养基 (dulbecco′s modified eagle medium,DMEM)、胎牛血清(fetal bovine serum,FBS)、青霉素、链霉素及胰蛋白酶 (Gibco公司);硅脂 (Baysilone公司);细胞增殖试剂盒 (碧云天生物技术有限公司);Fibronectin Rabbit Polyclonal Antibody (Abcam公司)。
CO2细胞培养箱(Thermo公司);生物安全柜(BSC-1304ⅡA2,苏州安泰空气技术有限公司);倒置荧光显微镜、激光共聚焦显微镜(LSM 710)(德国 Zeiss公司);原子力显微镜(JPK Nanowizard3,德国Bruker公司);等离子清洗机(Potentlube PT-5S,深圳三和波达机电科技有限公司)。
1.2 方法
1.2.1PDMS微弦的制备 首先,将Sylgard 184和交联剂以10∶1比例混合并浇筑在硅模具上,高温固化后得到PDMS微弦负模。再将PDMS负模表面涂布1% PVA的脱模剂。将PDMS预聚物加入负模的微槽内,80 ℃固化4 h后,正方形微弦四角位置粘合4个2 mm高的PDMS圆形支持块。四个支持块通过等离子处理,键合于一个18 mm圆形盖玻片上。将装置浸泡在水中过夜后,剥离反模得到PDMS微弦结构。最后将微弦装置放置于12孔培养皿中备用。
1.2.2细胞及微组织培养 NIH-3T3成纤维细胞(7-12代)培养于含10%胎牛血清的高糖DMEM中,置于37 ℃、5% CO2培养箱。I型胶原蛋白经pH中性调解后与一定数量的细胞混合,得到终浓度为106细胞/mL和2 mg/mL胶原蛋白的混合物。4 ℃条件下,将20 μL细胞胶原混合物滴加于微弦中央位置,转移至培养箱固化50 min后,再向培养孔板中加入2 mL培养基,然后置于培养箱或显微镜下进行长期成像。
1.2.3微弦收缩的力学仿真计算 使用COMSOL Multiphysics模拟正方形微弦因微组织收缩而产生的应力分布。微组织收缩48 h后获取图像中一条微弦边界的形变进行函数拟合,得到y=(-6E-05)x2+0.205 9x+286.96为微弦的应变函数。设置微弦内区域为可压缩超弹性材料 (密度为1 kg/m3,杨氏模量为380 Pa,Neo-Hookean模型),建立平面应力模型计算。
1.2.4微组织的活细胞成像及透光率变化测量 倒置荧光显微镜的多点成像载物台可同时对12孔板内的多个微组织目标进行长时自动成像。显微镜的环境维持在37 ℃和5% CO2。使用5×/0.16 NA物镜和ORCA-Flash 4.0相机(日本滨松)进行相成像(1 h/帧)。使用Image J测量不同时间正方形微组织对角线之间的灰度值变化,量化微组织不同区域的透光率。
1.2.5细胞增殖检测 微组织培养48 h后,加入10 μM的EDU(5-乙炔基-2′-脱氧尿苷)增殖试剂[23]孵育12 h,将EDU结合到新合成的DNA中。微组织经固定、通透化处理后,加入反应液,室温避光染色3 h;加入Hoechst溶液,室温避光染色1 h;最后使用3% BSA洗涤3次/5 min。用Zeiss 710共聚焦显微镜于10×/0.3 NA或20×/0.5 NA物镜下分别在绿色(488 nm)和蓝色(405 nm)通道对微组织3D成像。使用Image J对图像进行高斯处理,对微组织100 μm深度的区域进行量化分析,计算单位面积下EDU阳性和细胞总数的比率。
1.2.6荧光成像和图像分析 微组织培养48 h后,对其固定、通透化和封闭处理。使用结合Alexa Fluor Plus 647的鬼笔环肽(phalloidin-AF647)与DAPI对F-actin和细胞核室温避光染色3 h,最后使用PBS洗3次/10 min。用Zeiss 710共聚焦显微镜于20×/0.5 NA物镜下,分别在红色(633 nm)和蓝色(405 nm)通道对微组织3D成像。使用Image J对微组织100 μm深度区域的细胞排列分布和细胞核密度进行量化分析。
微组织纤连蛋白(Fibronectin)免疫荧光染色:微组织培养48 h后,对其固定、通透化和封闭处理,FN一抗4 ℃冰箱孵育过夜。使用PBS洗3次/5 min,AF488 G-ANTI-Rb二抗室温孵育4 h。再用结合Alexa Fluor Plus 647的鬼笔环肽(phalloidin-AF647)与DAPI对F-actin和细胞核室温避光染色3 h,最后使用PBS洗3次/10 min。用Zeiss 710共聚焦显微镜于10×/0.3 NA物镜下,分别在绿色(488 nm)、红色(633 nm)和蓝色(405 nm)通道对微组织3D成像。通过Image J将微组织Z轴进行投影成像,量化组织内部到组织边界的荧光强度。
1.2.7微组织杨氏模量测量 微组织培养48 h后,使用0.5% TritonX-100室温处理1 h,去除细胞活性。将微组织取下并反向粘在载玻片上(注意微组织的距离与初始状态相同),用AFM探针(MLCT-O10)对样品进行压痕实验。设定在50×50 μm范围内采集4×4个测点,在每个微组织直角和中心区域取3~5个位置进行测量,得到力-距离曲线。用JPK数据处理软件确定微组织的弹性模量。
1.2.8FITC-葡聚糖扩散检测 制备细胞胶原混合物时,加入0.5%的单分散荧光微球(546 nm),用于标记微组织轮廓。微组织培养48 h后,分别加入0.5 mg/mL的4 kDa或40 kDa FITC葡聚糖分子。用Zeiss 710共聚焦显微镜于10×/0.3 NA 物镜下分别在红色 (561 nm)和绿色(488 nm)通道对微组织3D成像。使用Image J对微组织100 μm深度的区域进行量化分析,计算其相对荧光强度(1 h时微组织的荧光强度/10 min微组织的荧光强度)。
2 结果
2.1 正方形微弦约束下微组织的形成
为了解生长在正方形微弦上的微组织受力情况,对微弦装置进行力学仿真计算。由图1(a)左图可知,对正方形微弦加载收缩力后,正方形直角区域产生较高的应力,而正方形中心区域的张力较小。因此,正方形内应力呈非均一分布,可诱导微组织非均一结构的生成。在成功制备悬空的正方形PDMS微弦装置后(见图1(a)右图),将细胞-胶原混合物加载到正方形微弦中,并进行活细胞时间成像。由图1(b)可知,微组织在成纤维细胞的作用下持续收缩,48 h后形成一个近似正方形的微组织结构。微组织内部的透光率由于致密化而逐渐下降。其中,直角区域的透光率低于中央区域(见图1(c)),提示微组织逐渐形成了非均一结构。
2.2 微组织内细胞的非均一性
为进一步研究该微组织的非均一性,本研究首先聚焦于微组织内细胞的空间分布。通过用荧光鬼笔环肽核标记细胞微丝骨架,发现在正方形微组织的直角区域,细胞排列显示出高度的各向同性,与张力呈90 °分布。而在微组织中心区域,细胞则呈各向异性排列,见图2(a)。此外,本研究还通过细胞核染色对微组织不同区域的细胞密度进行了测量,结果显示,两区域中细胞个数基本在380左右,其细胞分布无显著性差异,见图2(b)。
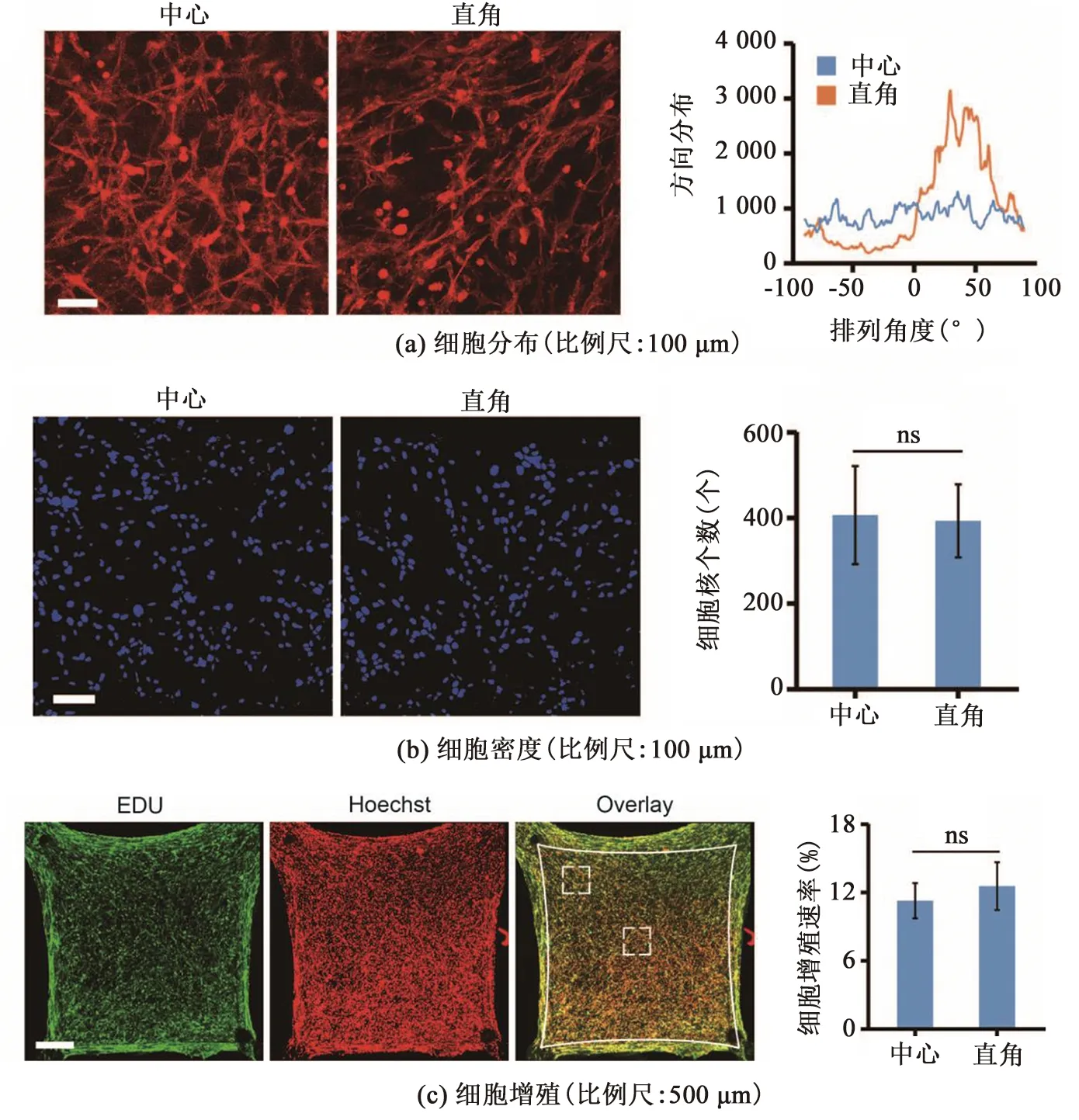
图2 微组织不同区域内细胞的非均一性
为研究力学约束是否影响微组织内细胞增殖的速度,在正方形微组织收缩培养48 h时,本研究使用EDU标记增殖细胞的DNA。图2(c)中,实线框表示微弦的位置,虚线框表示微组织内的直角和中心区域。共聚焦成像显示,微组织边界区域的EDU阳性率高。通过计算EDU标记的细胞核与总细胞核数量的比值,对细胞增殖进行定量分析,结果显示,微组织直角区域的细胞增殖率为12.37%,中间区域的细胞增殖率为11.08%,无显著性差异。
2.3 微组织内细胞外基质的非均一性
为表征微组织内细胞外基质的非均一性,本研究对细胞产生的纤连蛋白(Fibronectin)进行测定。图3(a)中,实线表示微弦的位置,虚线框表示荧光强度的位置。免疫荧光成像显示,微组织中心区域到直角区域的纤连蛋白的荧光强度逐渐增加。由图2(b)可知,中心区域到直角区域中细胞数量接近,直角区域的纤连蛋白水平较高,可能是由于该区域内细胞产生了较多的纤连蛋白。

图3 微组织内细胞外基质的非均一性
组织硬度是反映细胞外基质致密化水平的重要力学指标。因此,本研究使用AFM探针分别对微组织的直角区域和中心区域进行压痕实验,测量其杨氏模量,见图3(b)。实验结果表明,微组织直角区域杨氏模量为378.04 Pa,比中心区域的杨氏模量113.59 Pa高出2倍左右,证明微组织直角区域的致密化程度高于中央区域。
2.4 微组织非均一性对分子扩散的影响
上述研究证实正方形力学约束可导致微组织内非均一结构的形成。为研究微组织非均一性对大分子扩散的影响,本研究向微组织培养基中加入荧光标记的葡聚糖,使用共聚焦显微镜分别对微组织不同区域内100 μm深的区域进行成像,见图4(a)。通过定量分析10~60 min微组织的荧光变化,发现4 kDa葡聚糖在微组织中心区域的扩散速度高于直角区域,见图4(b),说明对比力学约束低的区域,力学约束高的大分子通透性更高。然而,40 kDa葡聚糖的扩散速度不仅显著低于4 kDa葡聚糖,在不同力学约束区域中也未显示出明显差异,表明力学约束对组织通透性的影响程度还取决于扩散物质的分子量。
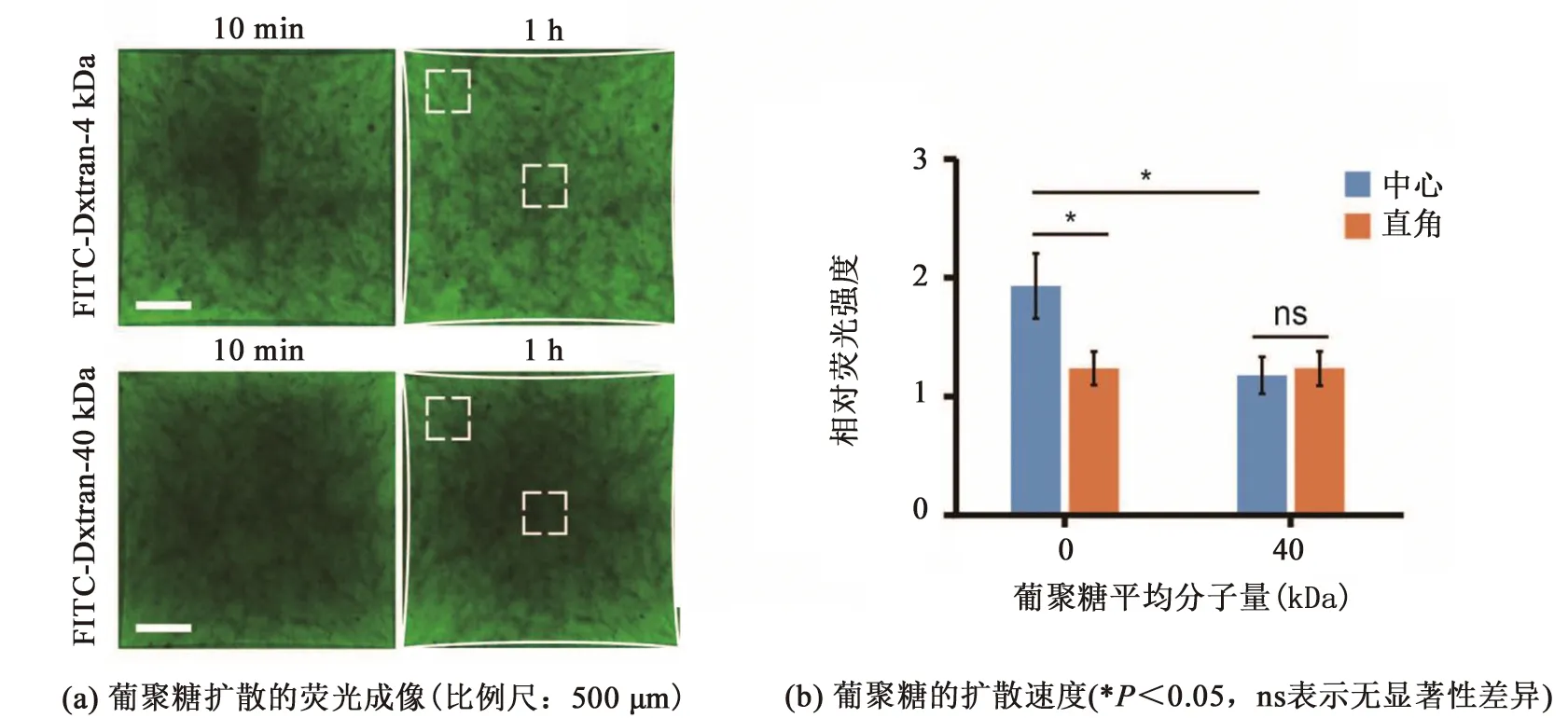
图4 微组织非均一性对分子扩散的影响
3 结束语
胚胎发育及组织创伤愈合[24]过程中普遍存在致密组织的渐进形成[25],表现为短时间内剧烈的形态变化和组织刚度的提高[26]。该过程不仅受生化因子的调控,还受细胞的收缩力和微环境张力之间的平衡以及由此产生的复合力场的调控。本研究利用正方形PDMS微弦产生的力学约束诱导微组织形成非均一结构,从细胞及细胞外基质两个角度对其非均一结构进行表征。结果显示,3D环境中细胞排列受力学约束的调控,呈现出垂直于力场的各向同性分布现象,这可能是细胞为减少机械牵拉而作出的适应性反应。此外,细胞密度和增殖在不同力学约束条件下,未发生明显变化。在对细胞外基质研究中,纤连蛋白丰度及微组织硬度都显示出与力学约束的相关性,即较高的力学约束会导致较高的组织致密化水平。组织致密化不仅参与组织发育和修复,还与肿瘤等病理过程密切相关。过度致密化的细胞外基质会阻碍分子扩散,进而影响大分子药物接近靶细胞[15]。本研究使用荧光标记的葡聚糖[27]模拟大分子药物,发现4 kDa的大分子在微组织低力学约束区域具有较高的扩散速度,在高力学约束区域的扩散速度降低至与40 kDa的大分子相当的水平。该结果将有助于后续进一步了解大分子药物在组织内的传递。

