自愈合咪唑盐聚离子液体/聚丙烯酸多层结构构建及抗菌性能研究*
熊晨崴,周鑫叠,周超,张俊杰,王皓,黄勇△
(1.南京医科大学附属常州第二人民医院 骨科,常州 213000; 2.南京医科大学 常州医学中心,常州 213000;3.大连医科大学 研究生院,大连 116000;4.共和县中医院 骨科,青海省海南藏族自治州共和县 811800;5.常州大学 医学与健康工程学院,常州 213164)
0 引言
植入型医疗器械在临床上广泛使用,若使用前其表面灭菌不彻底,极易造成微生物被膜的粘附,且难以去除,一旦植入患者体内会导致患者体内细菌感染,危害患者健康[1-3]。因此,为防止植入型医疗器械表面微生物被膜的形成,最有效的方法是在医疗器械表面涂覆抗菌涂层[4-5]。传统抗菌涂层通常采用两种方式构建,即:(1)表面修饰亲水性聚合物[6],如聚乙二醇(PEG)、聚(甲基丙烯酸羧基乙酯)或聚N-乙烯基吡咯烷酮,以减少蛋白质和细菌吸附;(2)表面修饰金属离子[7]、NO抗菌剂[8]等,通过药物释放或接触等抗菌。由于医疗器械在运输、储存或临床使用过程中易受划痕、摩擦等破坏,导致表面抗菌涂层脱落,失去抗菌作用,限制了抗菌医疗器械的临床应用。为此,有必要设计具有自愈合特性的抗菌涂层[9-10]。
层层自组装技术(layer-by-lager,LbL)具有自愈合的特性,该技术由相邻电荷的聚电解质交替的多层结构构建而成,其愈合特性主要通过异电荷聚电解质层之间的静电力和离子作用力下发生链段的迁移运动实现。目前,国内外多个课题组报道了采用层层自组装技术构建表面抗菌涂层的研究,实现了良好的自愈合和抗菌效果[3,11-12]。但层层自组装抗菌涂层在动态的生理环境中极易脱落,失去抗菌作用,这是由于其自组装层内的聚电解质层因非共价键作用可逆断开所致。因此,有必要构建一种既不影响自愈合性能,又具有较好结构稳定性的自组装抗菌涂层。
周超等[16]在结构稳定的自愈合抗菌涂层上有了一定研究,本研究在此基础上优化了涂层制备工艺,采用呋喃结构的咪唑盐聚离子液体(PILF)作为聚阳离子电解质层和高效抗菌剂,以含有马来酰亚胺的聚丙烯酸(PAAF)作为聚阴离子电解质层,通过层层自组装技术构建多层结构;然后以末端修饰有马来酰亚胺的聚乙二醇(MPEG)与聚阳离子电解质层发生“Diels-Alder”点击化学反应,将自组装层交联,赋予其结构的稳定性、快速自愈性和长期抗生物膜的效果。
1 实验
1.1 原料
乙烯基咪唑-3-溴乙烷根据文献自制,盐酸多巴胺(99%)、聚乙二醇(PEG,Mn= 6 000 g/mol)、聚丙烯酸(PAA,MW=100 000 g/mol)、溴丁烷(99%)、呋喃-2-羧酸钠(99%)、偶氮二异丁氰(AIBN,99%)、糠胺(99%)、N-羟基琥珀酰亚胺(NHS, 99%)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC,99%)、4-二甲氨基吡啶(DMAP,99%)、三乙胺(99%)和其他化学品均从上海阿拉丁生化科技股份有限公司购买,并按接收方式使用。
1.2 呋喃结构的咪唑盐聚离子液体合成
首先,将乙烯基咪唑-3-溴乙烷(4.12 g,20.00 mmol),AIBN(0.03 g,0.20 mmol)溶于20 mL甲醇中,氮气保护下60 ℃反应12 h,聚合物在丙酮中沉淀;接着,在DMF中与等量的呋喃-2-羧酸钠混合,与溴离子发生离子交换;然后,用去离子水透析24 h,以去除过量的呋喃-2-羧酸钠;最后,冷冻干燥后,得到呋喃羧酸咪唑盐聚离子液体(PILF)。
1.3 合成聚丙烯酸接枝2-呋喃胺(PAAF)
首先,PAA(1.00 g,0.01 mmol)溶于磷酸盐缓冲盐水(50 mL,pH 7.4)搅拌2 h;其次,依次加入NHS(0.32 g,2.80 mmol)和EDC(0.54 g,2.80 mmol),在室温下快速搅拌6 h;接着,加入 2-呋喃胺(0.27 g,2.80 mmol),在37 ℃下再搅拌48 h;然后,用去离子水透析2 d,经冷冻干燥后得到该产品。
1.4 双马来酰亚胺聚乙二醇(MPEG)的合成
首先,将PEG(5.88 g,0.98 mmol)溶于二氯甲烷(30 mL),同时常温下滴加三乙胺(0.30 g,2.94 mmol)和DMAP(0.36 g,2.94 mmol);其次,将3-马来酰亚胺丙酰氯(0.55 g,2.94 mmol)溶解在二氯甲烷(30 mL)中,冰浴条件下恒速滴加到上述PEG溶液中;接着,在室温下搅拌混合物过夜;然后,分别用盐酸溶液1 M(50 mL)、饱和碳酸氢钠溶液(50 mL)、饱和NaCl溶液(50 mL)洗涤溶液,并用硫酸镁干燥,并在冰乙醚中沉淀,过滤干燥得到白色固体。
1.5 通过混合反应制备交联表面多层涂层
首先,将不锈钢片(d=10 mm)在去离子水和乙醇超声浴中洗涤15 min;其次,用食人鱼溶剂(v(硫酸):v(过氧化氢)=7∶3)预处理10 min,以清洁表面杂质,并使表面富含羟基;接着,将预处理后的SS载玻片浸入含有盐酸多巴胺(4 mg/mL)的pH 8.5溶液中,在室温下快速搅拌,直至颜色由金属变成深棕色。用去离子水洗涤涂有聚多巴胺的不锈钢片3次,并在50 ℃的真空烘箱中干燥30 min。
配有1 g/mL的聚电解质溶液(PILF为带正电荷聚电解质,PAAF为负电荷聚电解质),采用层层自组装技术在涂覆有聚多巴胺的不锈钢片表面沉积PILF/PAAF自组装层。每一层聚电解质在不锈钢片表面沉积吸附10 min,然后用去离子水冲洗1 min,沉积20层聚电解质层,以PILF为外层。然后,将涂覆有PILF/PAAF多层结构不锈钢片浸没于含有MPEG交联剂的溶液中(1 mL,c=0.5 mM)在50 ℃ 发生Diels-Alder 反应4 min,涂层定义为(C-PILF/PAAF)。以不交联的PILF/PAAF自组装层作为对照,定义为(PILF/PAAF) 。
1.6 表征方法
聚合物结构采用核磁共振波普1H NMR(Bruker AVANCE III, 400 MHz,美国)表征。不锈钢片表面涂层结构分别采用红外光谱表征(Nicolet-460,赛默飞世尔)和X射线光电子能谱表征(KRATOS Axis Ultra HAS,岛津)。静态水接触角使用JC2000D1测角器(Powereach,中国),并在室温下采用无柄水滴法测量。不锈钢片上的LbL自组装多层涂层的厚度通过椭圆偏光显微镜(VASE J. A. Woollam)进行测量,涂层表面电位通过Zeta电位仪测定(安东帕,瑞士)。
1.7 涂层自愈合过程和涂层稳定性表征
用手术刀在表面涂层上划10~15 μm宽的裂纹,且深度至基材层。然后,将破坏的涂层浸入室温下的PBS溶液中。用原子力显微镜(布鲁克,美国)和偏光光学显微镜(尼康,Nikon, ECLIPSE E200,日本)观察并拍摄每个样品的自愈合过程。涂层稳定性可通过自组装涂层浸泡于PBS溶液中,并通过紫外-可见分光光度计表征(日本岛津 UV-2450分光光度计)。
1.8 涂层的体外抗菌活性表征
采用革兰氏阳性细菌、金黄色葡萄球菌、革兰氏阴性细菌和大肠杆菌评价自组装涂层的抗菌性能。每个样品(d=10 mm,先前紫外线消毒1 h)被放入24孔板中,将1 mL细菌悬浮液(大肠杆菌或金黄色葡萄球菌)分别以107CFU/mL的浓度播种到每个孔中,在37 ℃和5% CO2下培养,分别培养1、3、5和7 d。用PBS溶液轻轻清洗不锈钢片3次,以去除未附着的细菌,然后放入含有PBS(10 mL)的离心管中,超声波沐浴30 min,将所有附着的细菌从涂层表面分离出来,将剥离的细菌悬浮液在PBS溶液中适当稀释,并分别在溶菌汤琼脂(LB琼脂)和Mueller-Hinton琼脂(MHA)板上计数。使用式(1)计算菌落减少对数:
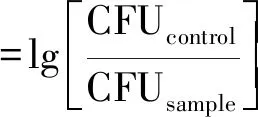
(1)
1.9 涂层细胞毒性表征
首先,采用MC3T3-E1细胞(Beyotime Bio,中国)在含10%胎牛血清和1%青霉素-链霉素的DMEM培养基在37 ℃培养,用0.25%胰蛋白酶和0.02%乙二胺四乙酸(EDTA)消化并离心;其次,用细胞计数仪计算细胞悬浮液的浓度,使其细胞密度为105个细胞/mL;接着,采用3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2-H-四唑溴化铵(MTT,Beyotime Bio,中国)法检测细胞存活率。每个样品浸泡在37 ℃,24 h;然后,将100 μL MC3T3-E1细胞悬液和100 μL浸提液接种到96孔板中,并准备6个平行重复。以100 μL PBS溶液作为空白对照。在37 ℃、5%二氧化碳中孵育24 h后,每孔加入20 μL MTT(5 mg/mL),再孵育4 h。每个孔中的溶液用150 μL的二甲亚砜(DMSO)取代,然后摇匀15 min。采用酶标仪(F50 TECAN)测定562 nm处的吸光度。式(2)为计算细胞存活率:
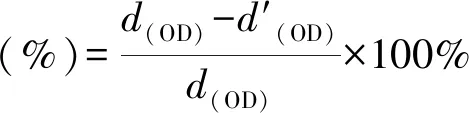
(2)
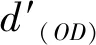
2 结果与讨论
2.1 聚电解质的制备及自组装抗菌涂层的构建
在制备涂层前,根据已有文献分别制备了聚阳离子电解质PILF、聚阴离子电解质PAAF和交联剂MPEG(见图1)[17]。其中,聚阳离子电解质即含呋喃结构的咪唑盐聚离子液体,具有较高的电负性,已证明其具有高效的抗菌活性和较好的生物相容性[18]。 所构建的聚电解质和交联剂分别通过核磁共振1H NMR进行了表征,见图2。图2(a)中PILF的1H NMR的化学位移,对应连接季铵盐的质子,其质子浓度为4.01 ppm,呋喃(7.50、6.85和6.48 ppm)的质子积分比为2∶1∶1,证实目标聚离子液体PILF已成功合成[18];在图2(b)中,化学位移6.3~6.4 ppm出现的双重峰证明了呋喃接枝到聚丙烯酸上制成PAAF,图2(c)中化学位移6.1和6.3 ppm出现的峰,以及峰面积的计算证明了马来酰亚胺不饱和双键成功修饰到PEG末端,制备成MPEG。


表1 不锈钢基材表面物理性能

图3 (a).面涂层红外光谱图;(b).PS光电子能谱宽频扫描;(c).接触角
2.2 自组装涂层的自愈合性能和稳定性
基材表面的自组装涂层的自愈合性能通过划痕实验表征。修饰有交联后的C-PILF/PAAF自组装涂层的不锈钢基材经人工划痕后, 通过AFM表面形貌和光学显微镜观察,见图4(a)。交联后的C-PILF/PAAF自组装涂层上形成了宽度和深度分别为10~15 μm和20 μm的裂缝。将样品浸入PBS溶液后,交联后的C-PILF/PAAF自组装涂层的裂缝在15~30 min内愈合,而在相同时间内未交联的自组装涂层PILF/PAAF未能完全愈合。这是由于交联自组装涂层一方面在PBS中溶胀引起交联剂双马来酰亚胺聚乙二醇(MPEG)将聚电解质层快速牵引,另一方面聚电解质层之间的静电吸引,诱导聚合物链的移动,使得受损涂层在短时间内重建[16,19-20]。
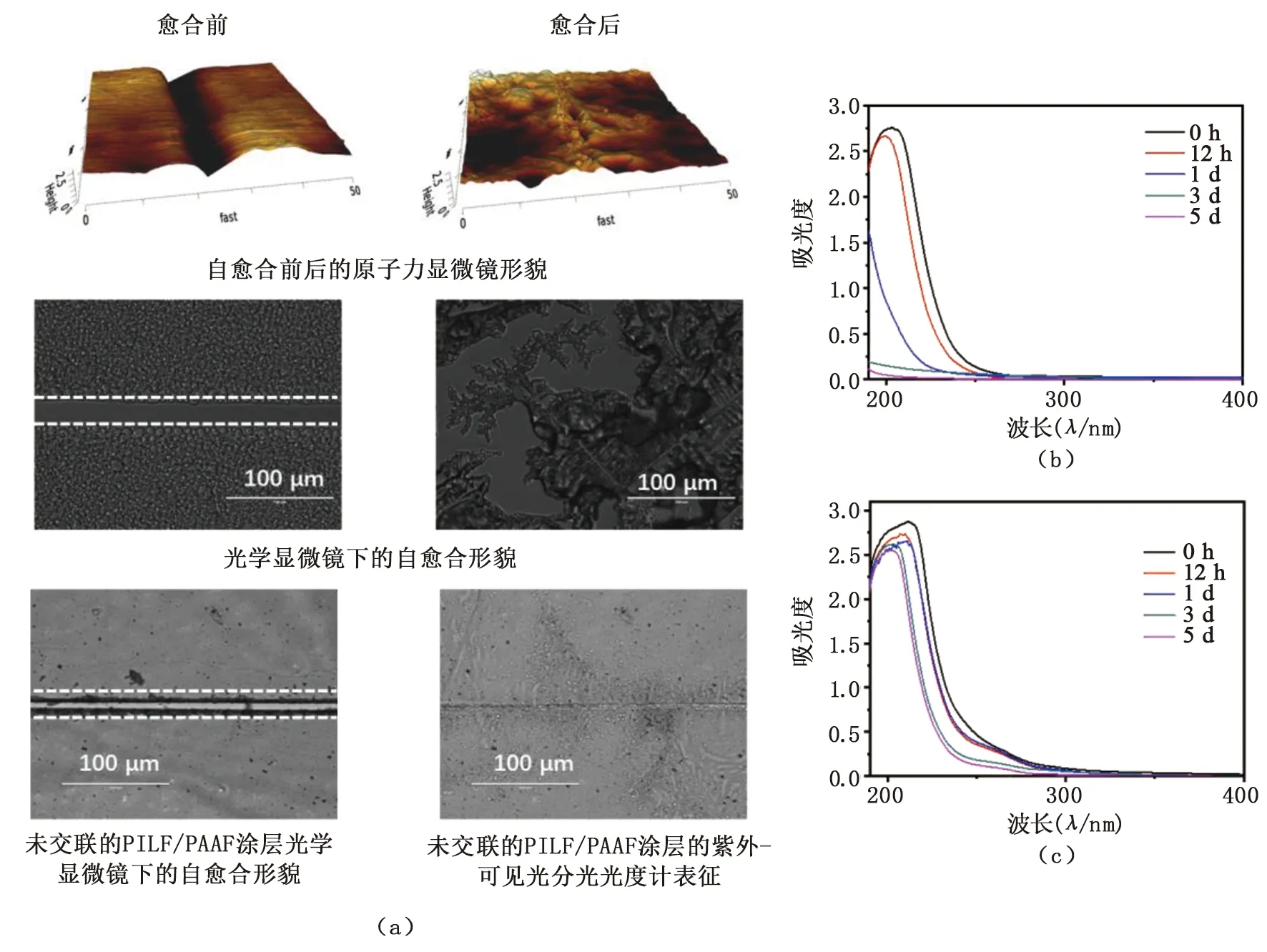
图4 (a). C-PILF/PAAF涂层的自愈合性能;(b).未交联的PILF/PAAF涂层的稳定性;(c).交联后的C-PILF/PAAF涂层的稳定性
自组装涂层的长期稳定性在医疗器械的临床使用中至关重要,不仅可延长其使用寿命,还能降低使用成本。将修饰有未交联的自组装涂层PILF/PAAF与交联后的自组装涂层C-PILF/PAAF的石英片浸泡在PBS溶液中,通过紫外-可见光分光光度计证明了未交联的自组装涂层PILF/PAAF在1 d后从基材表面脱落,而交联的自组装涂层C-PILF/PAAF在5 d内均保持较好的稳定性,见图4。
2.3 自组装涂层的抗菌活性和细胞相容性测定
通过对金黄色葡萄球菌和大肠杆菌菌落数的统计,评价自组装涂层表面的体外抗菌活性,见图5(a)、(b)。在7 d内,附着在不锈钢片内的金黄色葡萄球菌和大肠杆菌逐渐增加,而涂覆有交联自组装涂层C-PILF/PAAF 的不锈钢片,菌落数明显少于无涂层的不锈钢片。通过式(1)可得,交联自组装涂层C-PILF/PAAF在7 d内对金黄色葡萄球菌的菌落数平均减少了1.74 lgCFU/(杀菌率98.2%),对大肠杆菌的菌落数平均减少了1.19 lgCFU/(杀菌率93.6%),具有持续抗菌的性能。这是由于自组装涂层最外层的咪唑盐聚离子液体既是阳离子聚电解质层,又是高效的抗菌剂,具有较强的正电荷效应,结合表1交联自组装涂层C-PILF/PAAF的表面Zeta电位为8.14 mV,能有效破坏细菌细胞壁和细胞膜[18]。
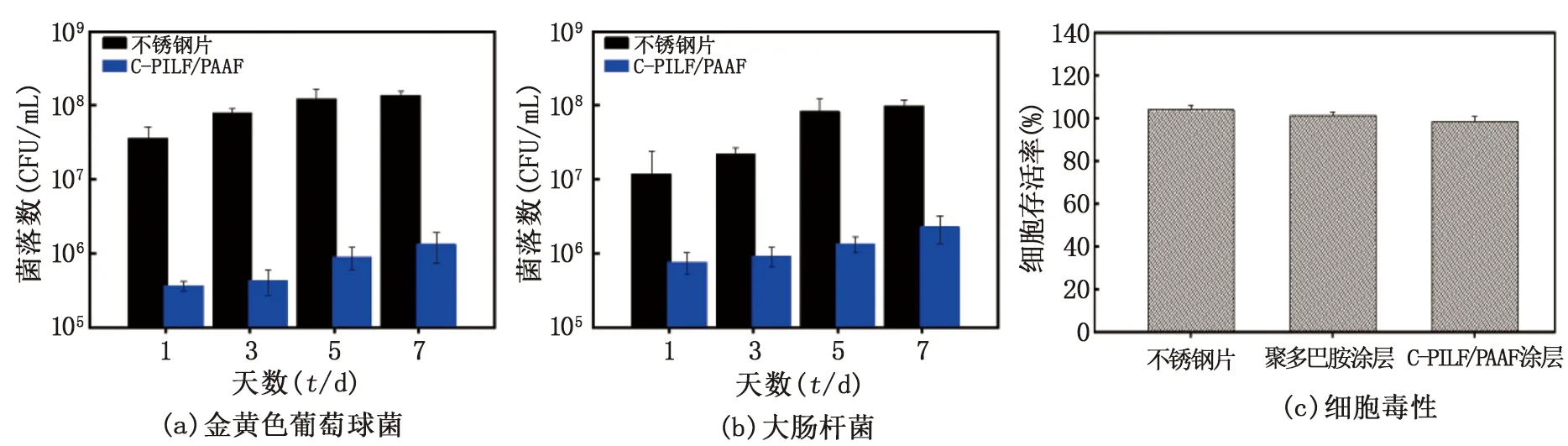
图5 7 d内菌落数统计及其细胞毒性对比
使用MC3T3-E1细胞评价自组装表面涂层的细胞相容性。图5(c)中的MTT检测所示,涂覆自组装表面涂层的不锈钢片具有良好的细胞存活率,达到90%左右,证明了C-PILF/PAAF涂层不仅具有较高的抗菌活性,还具有较低的细胞毒性。
3 结论
本研究以咪唑盐聚离子液体抗菌剂作为聚阳离子电解质层和抗菌聚合物,与聚阴离子电解质层聚丙烯酸,采用层层自组装技术在不锈钢片表面构建多层结构,并通过Diels-Alder技术使用MPEG将聚电解质层交联,由此制成具有自愈合性能和长期稳定特性的涂层。通过体外生物评价证明,所构建的自组装涂层具有良好的持久抗菌能力和较低的生物毒性,该方法将为抑制生物医疗器械在临床使用过程中的细菌感染提供有效策略。

