基于柔性微弦的微组织纤维化力学测量装置*
徐乐乐,邓林红△,王翔△
(1.常州大学 生物医学工程与健康科学研究院,常州 213164;2.常州大学 药学院,常州 213164;3.常州大学 生物与食品工程学院,常州 213164)
0 引言
纤维化是一种组织因损伤或发生炎症而硬化和结疤的病理现象,主要特征是组织基质过度生长、硬化和形成瘢痕,可导致功能障碍,并损害人体的重要器官,包括肝脏、肺、肾脏和皮肤[1-2]。其发病机制主要由于损伤导致成纤维细胞持续分化为肌成纤维细胞[3-5],后者表达α-平滑肌肌动蛋白(α-SMA),并大量沉积于细胞外基质(ECM)所致[6-7]。近年来,纤维化疾病的发病率及与纤维化相关的死亡人数逐渐上升。然而,目前市场获批的抗纤维化药物较少且不能阻止疾病进展[8-9]。因此,迫切需要建立新的检测模型用于抗纤维化药物筛选。
目前,将二维培养细胞阵列配置成高通量的格式,已广泛用于抗纤维化药物的分子机制研究中[2,10-11],但其无法真实反映纤维化所处的复杂三维细胞微环境。因此,无法满足抗纤维化药物筛选的特殊要求。早期研究试图从不同器官制备的组织切片中保留较好的组织特征,但模型的低可靠性限制了其在抗纤维化药物评估中的应用[12-13]。此外,通过测量肌成纤维细胞诱导三维胶原的宏观收缩已被用作抗纤维化筛选的一种表型参数[14-15]。然而,该方法缺乏形态学控制和有效量化分析指标,导致预测药物疗效的能力和准确性有限。目前,一般通过测量肌成纤维细胞分化标志物α-SMA水平、TGF-β依赖性基因表达或ECM蛋白丰度来评估抗纤维化药物[16-17]。然而,由于体内纤维化的复杂性,这些测定往往只反映纤维化进程中的单一分子事件,无法综合反映待测药物对纤维化的作用[18-19]。考虑到肌成纤维细胞产生较强的收缩力作用于ECM并最终导致组织致密化,本研究建立了一种基于胶原(纤维化组织中主要的ECM蛋白)包埋成纤维细胞的自由收缩三维微组织模型。该模型可快速致密,以模拟纤维化组织的形成。通过结合已开发的基于微弦的力传感器[20],本研究测量了微组织纤维化过程中的收缩力变化,并定量分析了上皮细胞及其产物前列腺素E2对微组织致密化和收缩力的抑制作用。结果显示,该方法在三维培养环境中成功测量了纤维化微组织的收缩力。
1 材料与方法
1.1 材料、试剂与仪器
I型鼠尾胶原(Advanced Biomatrix公司);Sylgard 184(Dow Corning公司);鬼笔环肽(Af647-Phalloidin);胎牛血清(fetal bovine serum,FBS)、三氯硅烷(1H,1H,2H,2H- Perfluorooctane);杜氏改良培养基(Duchenne's modified medium,DMEM)、硅脂 (Baysilone公司);青霉素、链霉素、胰蛋白酶(Gibco公司);小鼠单克隆抗体(α-SMA,博士德生物工程有限公司);纤连蛋白兔克隆抗体(Abcam公司);Alexa Fluor488 Donkey-ANTI-Mouse、Alexa Fluor488 Donkey-ANTI-Rabbit(Thermo公司);前列腺素(E2,Sigma公司)。
细胞培养箱(Thermo公司);激光共聚焦显微镜(LSM 710,Zeiss公司);活细胞工作站(Cell observer,Zeiss公司);精密天平(赛多利斯公司);三维电动显微操作系统(InjectMan NI2,Eppendorf公司);等离子清洗机 (Potentlube PT-5S,深圳三和波达机电科技有限公司)。
1.2 方法
1.2.1聚二甲基硅氧烷微弦的制备 采用深度反应离子蚀刻技术制备微弦的硅模具(苏州汶颢微流控技术股份有限公司)。将固化剂和Sylgard 184(1∶10比例)的混合物浇铸在硅模具上,经80 ℃固化4 h后得到聚二甲基硅氧烷(PDMS)反模,包括两个平行、含有锯齿结构的微槽(高50 μm、宽100 μm、长15 mm,间隔1 000 μm)。PDMS反模表面经氧等离子体处理后,涂覆1%聚乙烯醇/水。干燥后,将未固化的PDMS填充到PDMS反模的微槽中。使用未固化的PDMS作为粘合剂,将矩形PDMS块(高2 mm)固定在两端,在80 ℃下固化4 h。然后,将一直径为22 mm的玻璃盖玻片与两个PDMS块粘在一起。将该装置浸入水中溶解PVA涂层,使微弦从PDMS反模中脱离。最后将圆形PDMS支架(直径3 mm,高1.5 mm)粘在微弦中心区域下方的玻璃盖上。
1.2.2微弦弹性系数的测量 微弦的力学表征和力学仿真已有详细描述[20],本研究通过直接测量一定载荷下微弦的挠度来表征微弦的弹性系数。将装有微弦的装置水平放置在电子分析天平上,使用微操控系统对微弦中心部位施加垂直压力。以20 μm为步进距离,记录天平质量读数及相应的微弦挠度(D)。将天平质量读数(mg)转换为力(μN)后,得到微弦挠度-应力曲线。根据胡克定律,计算弹性系数。
1.2.3细胞培养和微组织的构建 NIH/3T3成纤维细胞(7-12代)、MLE 12小鼠肺泡上皮细胞以及MDCK犬肾细胞均培养于高糖DMEM(添加10% FBS)中,置于37 ℃、5% CO2培养箱。
使用硅脂将微弦底部粘到12孔培养板的基底上,以避免设备在长期成像期间漂移。将培养的NIH/3T3细胞胰蛋白酶化,然后与中和后的鼠尾I型胶原蛋白与密度为106个成纤维细胞/mL的浓度为2 mg /mL胶原蛋白溶液混合。将8 μL的细胞胶原混合液播种在微弦中心,在培养箱中放置40 min聚合。12孔培养板每孔充1.8 mL新鲜培养基,置于培养箱中孵育至96 h,或安装在显微镜上定时成像。
为进行上皮细胞与微组织共培养实验,微组织在培养箱聚合40 min后,将MDCK细胞和MLE 12 细胞(8 ×106细胞,5 μL)悬浮液分别滴在聚合的NIH/3T3细胞和胶原蛋白混合物上,使细胞液滴包裹在NIH/3T3-胶原混合物外部,然后在培养孔底部加入200 μL培养基以保持湿度,置于培养箱培养90 min后,每孔补充1.8 mL新鲜培养基,置于培养箱中或安装在显微镜上成像。药物处理时,在培养板的单孔中加入200 μL预先加热的含有该药物的培养基。本研究使用的药物和剂量为前列腺素E2(PGE2, 1 μM, 10 μM , 100 μM)。
1.2.4微组织活细胞成像与免疫荧光成像 荧光倒置显微镜同时对12孔板内的多个微组织进行活细胞成像。使用ORCA-Flash 4.0相机(日本滨松)和5×/0.16 NA物镜进行定时成像(1 h/帧)。
为进行微组织α-SMA和纤连蛋白(Fibronectin)免疫荧光染色,微组织培养72 h后,进行固定、通透化和封闭处理。α-SMA 、FN一抗4 ℃冰箱孵育16 h使用。使用PBS洗涤3次,每次持续10 min,Alexa Fluor488 Donkey -ANTI-Mouse、Alexa Fluor488 Donkey -ANTI-Rabbit二抗室温孵育4 h。再用结合Alexa Fluor Plus 647的鬼笔环肽(phalloidin-AF647)与DAPI对F-actin和细胞核室温避光染色3 h,最后使用PBS洗涤3次,每次持续10 min。用Zeiss 710共聚焦显微镜于10×/0.3 NA或20×/0.5 NA物镜下对微组织进行3D成像,通道分别选取绿色(488 nm)、红色(633 nm)和蓝色(405 nm)。
1.2.5微组织收缩力的计算 对完全固定在两个微弦上的微组织进行定量分析。使用Image J测量微弦中点内侧的间距。将培养第1 h测定的间距设为标准d0,待测时间点微弦间距为dt,弦间距变化量Δd=(d0-dt)/2。根据胡克定律,微组织产生的收缩力F= Δd×k。使用SPSS进行t检验,P<0.01即认为差异具有统计学意义。
2 结果
2.1 微弦力学传感器的制备和纤维化微组织模型的建立
本研究采用PDMS微弦结构作为检测纤维化微组织收缩力的传感器。对制备的微弦结构分别进行形态表征和力学表征。该装置由两根长为15 mm的微弦构成,该平行微弦的两端固定于两个长方形PDMS块,见图1(a)。该PDMS微弦结构带有锯齿,可锚定微组织,防止其产生横向收缩,见图1(b)。将制备批次不同的微弦装置进行宽度、间距和高度的测量,证实其无显著性差异,确保力学测量的可重复性,见图1(c)。PDMS聚合物具有良好的弹性性能,可在μN级作用力下产生形变。经实验测定,微弦所受应力载荷与其挠度变化呈线性关系,见图1(d)。因此,根据胡克定律,计算其弹性系数k=0.083 μN/μm,结合显微镜的光学分辨率,可获得较高的力学灵敏度(100 nN)。此外,当15 mm长的微弦达到 500 μm 的最大偏转挠度时,其拉伸应变仅增加了 0.2%,保证了其力学稳定性。同时,长为15 mm微弦装置保证了该传感器较高的线性测量范围(0~25 μN)。
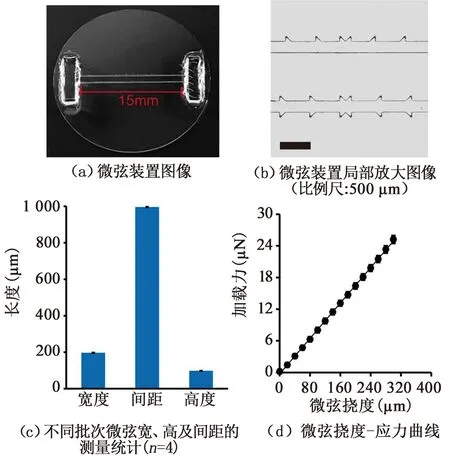
图1 微弦的几何及力学表征
当细胞胶原团接种到微弦中央位置后,在37 ℃ 环境中,胶原蛋白逐渐固化,使混合物锚定于微弦上。图2(a)为致密组织的形成,红线显示微弦间距。由图2(a)可知,随培养时间增加,混合物持续收缩并逐渐形成致密微组织,导致两根微弦间距离减少。纤维化组织的收缩和致密化由肌成纤维细胞驱动,因此,肌成纤维细胞的α-SMA蛋白是纤维化的重要标志。故此,本研究首先利用免疫荧光技术分析了微组织培养72 h后α-SMA蛋白的表达水平。共聚焦成像显示,NIH/3T3细胞中α-SMA大量表达(见图2(b)),表明在该微组织模型中,NIH/3T3细胞在无外源性TGF-β刺激的情况下,分化为肌成纤维细胞。本研究随后对纤维化过程中的ECM沉积进行观察。免疫荧光显示,纤连蛋白(fibronectin)在微组织中有较高水平的表达,见图2(c)。通过对纤维化标志性蛋白的观察证实,NIH/3T3细胞和胶原混合物可在微弦上形成纤维化微组织。

图2 微组织致密化及主要纤维化标志物蛋白的表达
2.2 微组织纤维化过程中的力学测量
微组织纤维化过程中,体积显著缩小,透光率也随之降低,见图2(a)。为定量分析其致密化水平,本研究测量了微组织图像的灰度变化。由图3(b)可知,微组织致密化程度在培养24 h后显著上升,并在48 h后趋于稳定。为检测微组织纤维化过程中的收缩力,本研究测量了不同培养时间点微弦的间距(即图2(a)的红线)。由图3(a)、(c)可知,微组织的持续收缩导致两根微弦间的位移逐渐减小,96 h后约缩至起始间距的50%。结合微弦弹性系数,计算可得该培养期间纤维化微组织收缩力,发现其随培养时间而持续增加。72 h后,收缩力趋向稳定,可达(13.1±0.4) μN。该现象说明微组织致密化稳定后(48 h),其内部收缩力依然持续增大直至趋于稳定,同时也证实本力学测量系统比形态学观察更加灵敏。
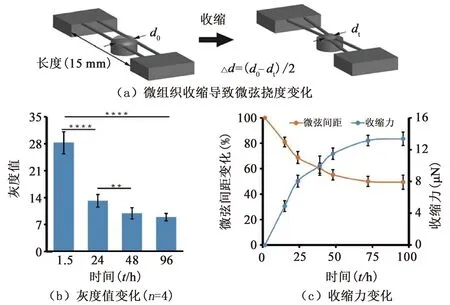
图3 微组织纤维化过程中的力学变化
2.3 细胞或药物抑制纤维化导致微组织收缩力下降
除收缩性成纤维细胞/肌成纤维细胞外,非收缩性上皮细胞也参与调节纤维化过程[21]。为探究上皮细胞在纤维化过程中如何调控微组织收缩力,本研究在微弦上构建上皮细胞-微组织共培养体系。当小鼠肺泡上皮细胞(MLE 12)和犬肾细胞(MDCK)两种上皮细胞分别于微组织共培养时,微组织的致密化受到了显著抑制,见图4(a)。通过测量微弦间距的变化,发现两种上皮细胞均对微组织收缩力产生了抑制作用,其中,MDCK细胞的抑制效果最为显著,见图4(a)右。该结果证实上皮细胞可通过抑制微组织的收缩力而延缓其致密化进程。
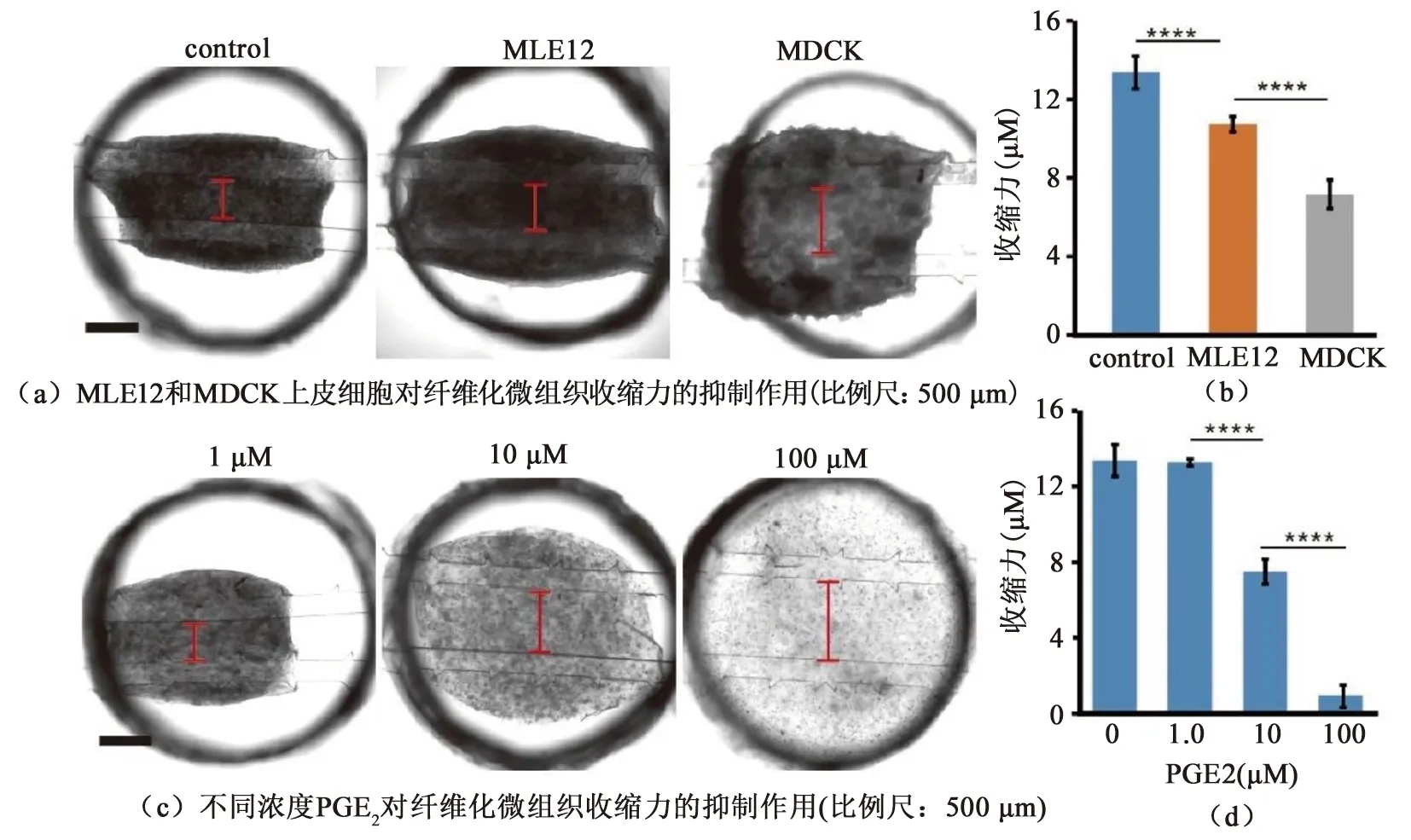
图4 细胞或药物抑制纤维化微组织的收缩力
为模拟抗纤维化药物筛选,本研究使用前列腺素E2(PGE2)验证该纤维化微组织收缩力的测量模型。健康上皮细胞通过PGE2信号通路抑制成纤维细胞-肌成纤维细胞转变(FMT)[22-23]。分别用1、10、100 μM三种不同浓度的PGE2处理微组织至96 h,并测量微弦间距。由图4(c)可知,不同浓度PGE2处理后微组织的致密化水平呈现明显差异。当PGE2浓度高于10 μM时,其对微组织的收缩力产生了显著的抑制效应,见图4(d)。上述结果证明,该力学测量装置可用于抗纤维化药物筛选及浓度梯度测试。此外,本研究还发现10 μM PGE2产生的抑制效果与MDCK细胞相当,表明该浓度可能是上皮细胞维持抗纤维化活性所需的PGE2有效水平。
3 结束语
本研究在微弦力学传感器上构建了基于NIH/3T3细胞的纤维化微组织模型,通过原位实时成像研究微组织纤维化过程中的形态和力学变化。与以往研究纤维化模型需要加入外源性TGF-β刺激形成相比,本研究微组织模型在无外源TGF-β条件下,培养72 h后即自发开始纤维化,表现为肌成纤维细胞分化的关键蛋白表达以及细胞外基质的沉积。这可能是由于微组织致密化进一步刺激肌成纤维细胞产生TGF-β,从而增强肌成纤维细胞的激活[24-26]。这种正反馈机制使得该微组织成为不依赖于TGF-β的快速纤维化模型。细胞的收缩力是生物组织纤维化致密化的主要物理驱动力。本研究成功测得上皮细胞及抗纤维化分子对纤维化组织收缩力的抑制作用,一方面表明组织收缩力是评估纤维化进程的理想量化指标,另一方面验证了该微弦系统作为抗纤维化药物评测工具的可行性。因此,结合了灵敏微弦力传感器的微组织模型有望为抗纤维化药物评估和筛选系统的开发,以及探索纤维化疾病的病理机制提供参考。

