兔源A 型多杀性巴氏杆菌双重PCR检测方法的建立
王锦祥 付环茹 孙世坤 陈冬金 高承芳 桑 雷 谢喜平*
(1.福建省农业科学院畜牧兽医研究所 福州 350013;2.福建省畜禽遗传重点实验室 福州 350013)
多杀性巴氏杆菌(P.multocida)是感染家兔的重要病原菌。 根据该菌致病性和感染部位的不同,被感染兔可表现出多种病症,如呼吸道疾病、败血症、中耳炎、结膜炎和组织器官脓肿等[1-2]。 多杀性巴氏杆菌广泛流行于世界各地的兔群中, 给养兔业造成了巨大的经济损失[3-5]。 近年来,随着福建省兔产业的集约化和规模化发展, 该菌在福建省兔群中的广泛流行也严重制约着福建省兔产业的高质量发展[6-7]。 根据多杀性巴氏杆菌荚膜抗原的不同,可将其划分为A、B、D、E 和F 五种血清型。 本研究室前期从福建省重要兔养殖区福州市、 龙岩市和南平市等地9 个兔场的呼吸道病死兔肺脏中分离到205 株多杀性巴氏杆菌,其中A 型多杀性巴氏杆菌的占比高达76.10%[7]。 由此可见,A 型多杀性巴氏杆菌是引起福建省兔巴氏杆菌病的主要病原。目前,用于兔源A 型多杀性巴氏杆菌的病原学检测方法有细菌分离鉴定和多重PCR 方法[6-8],尚未见双重PCR 方法的报道。 本研究以兔源A 型多杀性巴氏杆菌kmt1 和hyaD 基因为靶基因, 分别设计特异性引物进行扩增,经反应条件优化,建立特异性强且敏感性高的检测兔源A 型多杀性巴氏杆菌的双重PCR 方法,为该病原的快速检测提供有力的技术支持。
1 材料与方法
1.1 试剂和菌株 胰蛋白胨大豆肉汤(TSB),购自广东环凯微生物科技有限公司;2×PCR Mix(TaKaRa)、 细菌基因组DNA 提取试剂盒(TaKaRa)和胶回收试剂盒(TaKaRa),购自宝生物工程(大连)有限公司;兔源A 型多杀性巴氏杆菌及其它兔源病原菌,包括D 型和F 型多杀性巴氏杆菌、支气管败血波氏杆菌、大肠杆菌、肺炎克雷伯菌和金黄色葡萄球菌均由本研究室保存。
1.2 引物设计 应用Primer Premier 5.0 软件,以A型多杀性巴氏杆菌CQ2 分离菌(GeneBank 登录号:CP033599)的kmt1 基因(1729512~1730248)和hyaD基因(169389~172307)为参考基因,通过BLAST 分析,设计并合成2 对特异性引物。 kmt1 基因引物序列为:kmt1-F:5'-cgatcctgaccaacaaacctatt-3'/kmt1-R:5'-cttcaataatggccataagaaacgtaa-3';hyaD 基因引物序列为:hyaD-F:5'-atatgaaaaaatatgatgtcggc-3'/hyaD-R:5'-ggcaggatgtgatgactt-3'; 两对引物的Tm 值均为57.5 ℃。 kmt1 基因引物和hyaD 基因引物的预期扩增片段分别为541 bp 和221 bp。
1.3 目的基因的扩增及鉴定 分别应用kmt1 基因引物和hyaD 基因引物进行单重PCR, 从兔源A 型多杀性巴氏杆菌基因组DNA 中扩增相应的目的片段。 反应体系:PCR Mix 25 μL, 上游和下游引物(10 μmol/L)各2 μL,基因组DNA 1 μL,灭菌双蒸水补齐至50 μL。 反应条件:95 ℃预变性5 min;95 ℃30 s,57.5 ℃30 s,72 ℃30 s,35 个循环扩增;72 ℃延伸10 min,12 ℃保存。 PCR 产物经1%琼脂糖凝胶电泳分析,用胶回收试剂盒纯化回收,并将回收产物测序, 测序结果与相应的参考基因进行BLAST 比对分析,确定相应引物的特异性。
1.4 双重PCR 的建立及反应条件的优化 以兔源A 型多杀性巴氏杆菌的基因组DNA 为模板, 应用kmt1 基因引物和hyaD 基因引物同时进行扩增,建立双重PCR 方法。 反应体系:2×PCR Mix 25 μL,4 条引物(10 μmol/L)各1 μL,基因组DNA 1 μL,灭菌双蒸水补齐至50 μL。 反应程序:95 ℃预变性5 min;95 ℃30 s,57.5 ℃30 s,72 ℃30 s,35 个循环扩增;72 ℃延伸10 min,12 ℃保存。将退火温度设置为54~60 ℃,进行温度梯度试验,确定双重PCR的最佳退化温度;将4 条引物等量混合,在混合引物浓度为0.4~1 μmol/L 进行引物浓度梯度试验,确定反应体系中最佳的混合引物浓度。
1.5 双重PCR 的特异性试验 以兔源A 型多杀性巴氏杆菌以及其它兔源细菌性病原菌,包括D 型和F 型多杀性巴氏杆菌、支气管败血波氏杆菌、大肠杆菌、肺炎克雷伯菌和金黄色葡萄球菌的基因组DNA为模板, 应用建立的双重PCR 方法分别进行扩增,验证该方法的特异性。
1.6 双重PCR 的敏感性试验 将反应体系中兔源A 型多杀性巴氏杆菌基因组DNA 的终浓度设置为1×108~1×100拷贝/μL,应用建立的双重PCR 方法分别进行检测,验证该方法的敏感性。
1.7 双重PCR 的重复性试验 取兔源A 型多杀性巴氏杆菌阳性样品24 份,同时设置阴性对照,应用建立的双重PCR 方法进行检测,每份样品重复检测3 次,验证该方法的重复性。
1.8 双重PCR 的初步应用 应用本试验建立的双重PCR 方法和已报道的多重PCR 方法[8]同时检测103 份呼吸道病死兔样品, 根据两种方法的检测结果,评估该方法的临床实用性。
2 结果与分析
2.1 目的基因的扩增及鉴定 经单重PCR 扩增,kmt1 基因引物和hyaD 基因引物分别特异地从兔源A 型多杀性巴氏杆菌的基因组DNA 中扩增出大小分别为541 bp 和221 bp 的目的片段(见图1)。目的片段的测序结果显示, 其序列均与参考基因的序列完全一致。
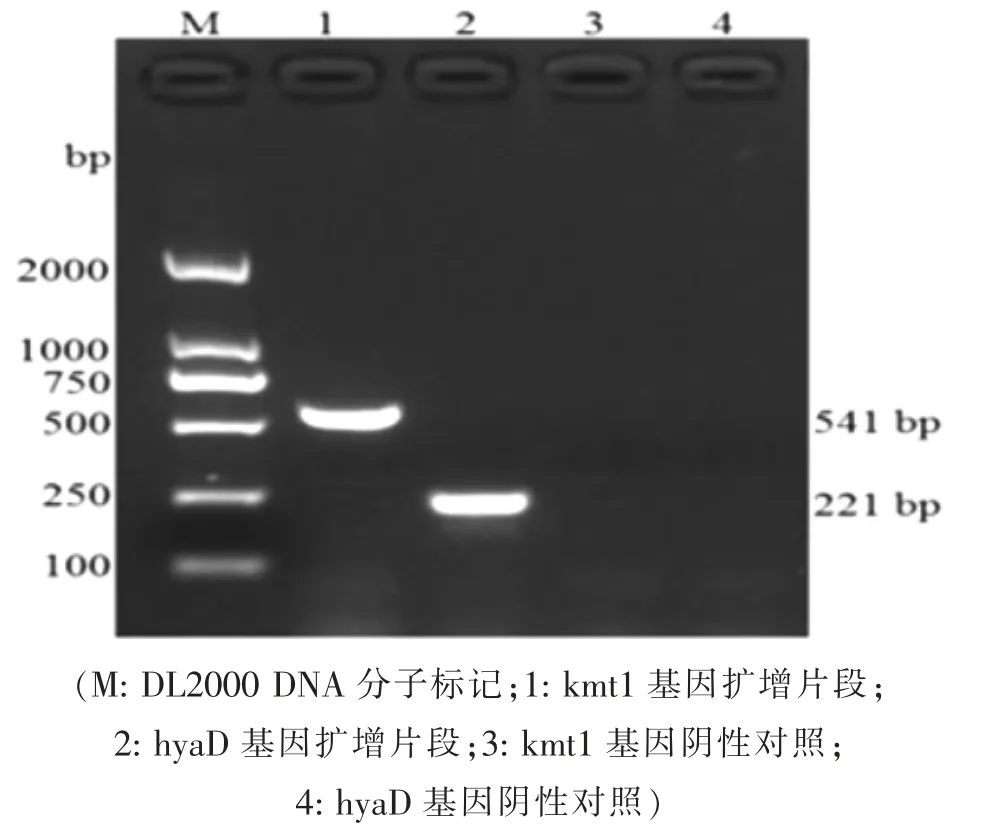
图1 kmt1 和hyaD 基因的单重PCR 扩增
2.2 双重PCR的建立及反应条件的优化 双重PCR 扩增结果显示,kmt1 基因引物和hyaD 基因引物能同时特异地扩增出相应的目的片段 (见图2)。对双重PCR 方法的退火温度和混合引物浓度进行优化后, 确定该方法最佳退火温度为57.8 ℃(见图3),最佳混合引物浓度为0.8 μmol/L(见图4)。 优化后, 该双重PCR 方法的反应体系为:2×PCR Mix 25 μL,4 条引物(10 μmol/L)各1 μL,基因组DNA 1 μL,灭菌双蒸水补齐至50 μL。 反应程序为:95 ℃预变性5 min;95 ℃30 s,57.8 ℃30 s,72 ℃30 s,35 个循环扩增;72 ℃延伸10 min,12 ℃保存。

图2 kmt1 和hyaD 基因的双重PCR 扩增

图3 反应温度的优化

图4 混合引物浓度的优化
2.3 双重PCR 的特异性试验 该双重PCR 方法对兔源A 型多杀性巴氏杆菌为kmt1 基因和hyaD基因双阳性,对兔源D 型和F 型多杀性巴氏杆菌为kmt1 基因单阳性,对支气管败血波氏杆菌、大肠杆菌、肺炎克雷伯菌、金黄色葡萄球菌和阴性对照则均为阴性(见图5),表明该方法特异性强。
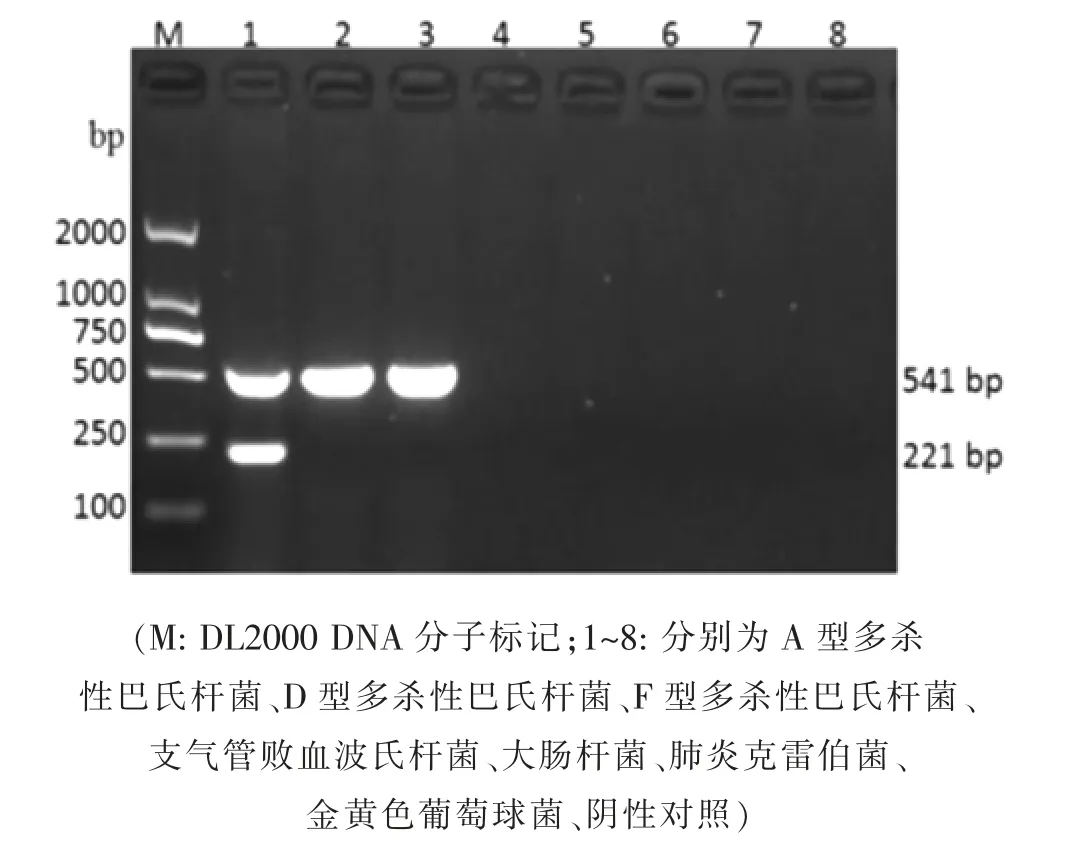
图5 特异性试验
2.4 双重PCR 的敏感性试验 双重PCR 对kmt1基因的最低检测限为1×103拷贝/μL, 对hyaD 基因的最低检测限为1×104拷贝/μL(见图6),表明该方法敏感性高。

图6 敏感性试验
2.5 双重PCR 的重复性试验 应用建立的双重PCR 方法检测兔源A 型多杀性巴氏杆菌阳性样品24 份和阴性对照,每份样品和阴性对照均重复检测3 次,3 批次的检测结果完全一致, 表明该方法重复性好。
2.6 双重PCR 的临床应用 应用建立的双重PCR方法和已报道的多重PCR 方法[8]同时检测103 份呼吸道病死兔样品。结果显示,双重PCR 检出kmt1 基因和hyaD 基因双阳性样品27 份,检出kmt1 基因单阳性样品11 份, 阴性样品65 份; 多重PCR 检出kmt1 基因和hyaD 基因双阳性样品26 份,检出kmt1基因阳性样品10 份,阴性样品63 份,非特异扩增4份。 根据两种方法的检测结果,双重PCR 方法与已报到的多重PCR 方法的符合率为96.12%, 表明该双重PCR 方法具有良好的临床实用性。
3 讨 论
兔巴氏杆菌病是制约兔产业发展的重要疫病,虽然我国已有商品化兔巴氏杆菌病疫苗用于该病的预防,但该病还是广泛流行于我国兔群中[5,7,9]。 A 型、D 型和F 型多杀性巴氏杆菌感染兔后都能引起兔巴氏杆菌病[10],但从我国不同地区兔群中分离到的多杀性巴氏杆菌主要还是A 型菌株[5,7,10]。 因此,建立兔源A 型多杀性巴氏杆菌的快速检测方法,掌握该菌在兔群中的流行情况对兔巴氏杆菌病的防控意义重大。
本试验以kmt1 和hyaD 基因为靶基因, 建立了检测兔源A 型多杀性巴氏杆菌的双重PCR 方法。该方法对兔源A 型多杀性巴氏杆菌的检测结果为kmt1 和hyaD 基因双阳性, 对兔源D 型和F 型多杀性巴氏杆菌的检测结果为kmt1 基因单阳性,对其它兔源常见细菌性病原包括支气管败血波氏杆菌、大肠杆菌、 肺炎克雷伯菌和金黄色葡萄球菌的检测结果均为阴性。由此可见,以kmt1 基因和hyaD 基因为靶基因建立的双重PCR 方法对兔源A 型多杀性巴氏杆菌具有很强的特异性。该方法对兔源A 型多杀性巴氏杆菌kmt1 基因的最低检测限为1×103拷贝/μL,对hyaD 基因的最低检测限为1×104拷贝/μL, 其检测最低限与兔源F 型多杀性巴氏杆菌双重PCR 检测方法最低检测限的数量级相同[10],敏感性高。 建立的双重PCR 方法对103 份临床病死兔肺脏样品的检测结果与Townsend 等[8]建立的多重PCR 方法的符合率为96.12%。在对103 份临床样品的检测过程中, 该多重PCR 方法对4 份样品出现了非特异扩增,导致结果无法判断,而本试验建立的双重PCR方法对103 份临床样品均未出现非特异扩增, 且阳性样品检出数和阴性样品检出数均高于该多重PCR 方法。由此可见,与该多重PCR 方法相比,本试验建立的双重PCR 方法能更好地适用于临床样品的检测。 本研究建立的兔源A 型多杀性巴氏杆菌双重PCR 检测方法特异性强、敏感性高,且临床适用性好,为临床上掌握兔群中A 型多杀性巴氏杆菌的流行情况以及兔巴氏杆菌病的防控提供了有力的技术手段。

