动物源性食品中氟苯尼考残留检测方法的研究进展
吕小玲 福建圣农发展股份有限公司 福建南平 354100
氟苯尼考(Florfenicol,FF)是酰胺醇类广谱抗菌药, 与同类药物氯霉素和甲砜霉素相比,FF 抗菌效果更好、安全性更高,因而在我国被广泛用于畜禽和水产养殖业。近年来,由于兽医知识的缺乏或受经济利益的驱使, 不合理使用FF 的现象在我国一些养殖企业时有发生, 导致FF 残留物在动物源性食品中常常被检出。 毒理学研究证实,FF 及代谢物可诱导肝毒性[1-2]、生殖毒性[1]、胚胎毒性[1,3]、血液毒性[4-5]和免疫毒性[4-8],它们在动物源性食品中的残留给消费者健康带来了潜在的风险, 也影响到养殖业的可持续发展。为保障食品安全,农业部在第235 号公告中明确规定FF 的残留标志物为代谢物氟苯尼考胺(Florfenicol amine,FFA), 其最大残留限量(Maximum residue limit,MRL)见表1[9]。2017 年,农业部组织专家修订了动物源性食品中兽药的MRL, 规定FF 的残留标志物为FF 和FFA 的总和[10]。考虑到FF在食品动物体内可代谢生成大量结合残留物[1,11-12],欧盟和日本对FF 的残留监控制定了更为严格的标准,规定动物源性食品中FF 及其代谢物的总和(以FFA 表示)作为FF 的残留标志物[13-14]。
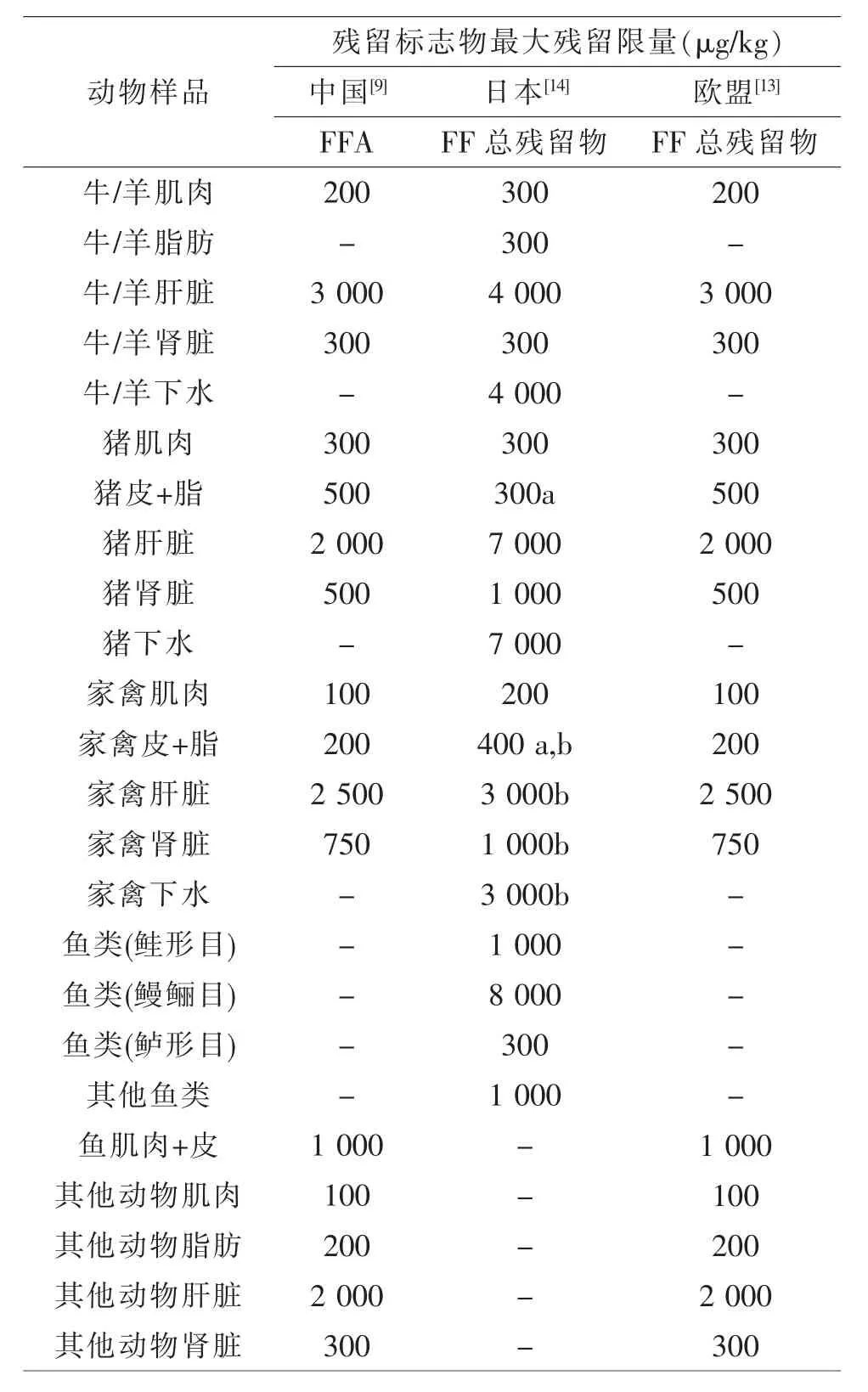
表1 中国、日本和欧盟关于动物源性食品中氟苯尼考最大残留限量的规定
1 动物源性食品中氟苯尼考残留检测方法
检测方法对于FF 的残留监控至关重要。 截至目前, 已有大量文献报道了动物源性食品中FF 的残留检测方法。其中绝大多数为理化分析方法,如高效液相色谱法[15-31]、气相色谱-质谱联用法[32-35]、液相色谱-质谱联用法[11-12,36-65]和毛细管电泳法[66-68]。 此外还包括一些生物分析方法,如免疫分析法[69-77]、生物传感器[78-79]和生物芯片技术[80]。 液相色谱-质谱联用法特异性好、灵敏性高、定量可靠,在已报道的FF残留检测方法中占比最高。 但是,液相色谱-质谱联用仪价格昂贵,运行和维护成本较高,不利于其在基层检测机构中推广。 气相色谱-质谱联用法在样品前处理环节需要对FF 和FFA 进行衍生以使之气化,增加了操作步骤,目前已不常用。 高效液相色谱法的各项性能指标均能满足FF 残留监控的需要,且分析仪器普及率高,检测成本低廉,因而仍然被广泛使用。 由于液相色谱系统配备的检测器区分目标化合物和基质干扰的能力远不如质谱检测器, 为了确保方法具有良好的特异性, 必须在样品前处理程序中增加必要的纯化步骤, 同时需要对色谱条件进行反复优化,使得该类方法变得繁琐,并令分析结果的重现性受到影响。 免疫分析法灵敏度高、操作简便、分析时间短、检测成本低,作为一种快速筛选方法有广阔的应用前景。一些新型的检测技术,如生物传感器和生物芯片也逐渐趋于成熟并被应用于FF 残留监控。 从待检测的目标分析物来看, 多数方法能检测可被萃取的FF 原型[19,21,23,25-30,32,34,38,40,47,51-52,55,57,61-63,66-68,71,73,76-77,79-80]或同时检测FF 和FFA[15,17-18,20,22,24,33,35-37,39,41,43,45-46,49,53-54,56,58-60,65,70,72,74-75,78],少数只能检测单一的代谢物FFA[48]。 值得注意的是,FF 在食品动物体内能够代谢生成大量的结合残留物, 它们在动物源性食品中浓度高,残留时间长[1,11-12],因而逐渐受到关注。近年来, 检测畜禽可食性组织中FF 总残留物 (以FFA 表示)的方法越来越多[11-12,16,31,42,44,50,64,69]。从待分析的样品基质来看,以畜禽和水产的肌肉、肝脏和肾脏为主[11-12,15-18,21-25,27,32-33,35-39,41-51,53-55,57,59-60,62-64,66-67,69-73,75-76,78,80],牛羊乳[19,26,29-30,34,40,49,52,61,68,76,79]、 禽蛋[20,28,49,56,58,65]、 蜂蜜[41,52,76]、鸡爪[60]和火腿肠[74]的文献报道也有一定数量。羽毛和畜禽排泄物虽然不属于可食性组织的范畴,但由于这些生物样品易于采集,且其中可检出的FF残留物浓度更高,残留时间更长,因而它们也被用于FF 残留的日常监控, 相应的检测方法已有文献报道[81-84]。
2 样品前处理技术
先进的分析仪器在FF 残留检测中的应用不仅明显增强了方法的特异性和灵敏性, 也让样品前处理变得更加简单。但是,这并不意味着样品前处理在FF 残留检测方法中的地位变得不再重要。 相反,对于复杂样品基质(如动物源性食品)中痕量FF 残留物的检测, 样品前处理往往对分析结果的可靠性起着决定性的作用。 样品前处理旨在从动物源性食品中提取、纯化和浓缩FF 残留物,使其能够被分析仪器检测。 为了实现这样的目标, 各种样品前处理技术被开发并应用于FF 残留检测。
2.1 动物源性食品中氟苯尼考残留物的提取技术常用于从动物源性食品中提取FF 残留物的技术包括溶剂提取技术和基于固相吸附材料的提取技术。溶剂提取技术包括液-液萃取(Liquid-liquid extraction)、固相支持的液-液萃取(Solid-supported liquid extraction)、 超声辅助提取 (Ultrasonic assisted ex-traction)、酶-微波辅助萃取(Enzymeatic microwaveassisted liquid extraction)、QuEChERS (Quick, easy,cheap, effective, rugged and safe)方法、分散液-液微萃取(Dispersive liquid-liquid microextraction)、快速溶剂萃取(Accelerated solvent extraction)和亚临界水萃取(Subcritical water extraction)。液-液萃取是一种经典的溶剂提取技术,提取效率较高,所需的仪器设备简单, 且同时适用于液态和固态样品, 因而在FF 残留检测中应用最为广泛[11-12,15-18,20-22,24-25,27,31-39,42,48-49,51,53-54,56-57,59-62,66,69-78,80]。 提取溶剂的选择对于液-液萃取十分重要,FF 的亲脂性较强, 可用乙酸乙酯[21,25,27,38,73,76-77]、乙腈[32,34,51,61,66]、乙酸乙酯-氨水混合物[57]、乙腈-水混合物[71]来提取,但也有方法以缓冲盐溶液[27,80]作为提取溶剂。 FFA 含有伯胺基,略显碱性,多用乙酸乙酯(碱性环境下提取)[11-12,16,31,42,58,74]、乙酸乙酯-氨水混合物[22-33,35,37,48-49,53-54,69,74]、乙酸乙酯-乙腈-氨水混合物[20,58,65]和乙腈-氨水混合物[59]来提取;也有一些方法采用甲醇-三氯乙酸-磷酸盐缓冲液混合物[39,75]、丙酮-水混合物[15,17-18,24,36,60]和乙腈[56,78]从动物源性食品中提取FFA。FF 的部分代谢物被证实可以与可食性组织发生牢固结合,无法被直接提取[1,11-12]。 通过高温条件下以强酸水解组织样品,可将这些结合残留物充分释放出来。 在此过程中,FF 及代谢物(除FFA 外)侧链上的酰胺键被水解,全部转化为FFA(见图1)。 将水解所得样品的pH 调节至碱性,再以乙酸乙酯提取可以获得令人满意的提取回收率[11-12,16,31,42]。在实施液-液萃取的过程中,操作者需要经常接触到乙酸乙酯、乙腈等有机提取溶剂,因而对他们的健康会造成一定的危害。 固相支持的液-液萃取是一种改良的液-液萃取技术, 以多孔硅藻土为液-液分配的载体,液态样品(或样品提取液)加入后可在硅藻土的表面形成高比表面积的液膜。 随着有机提取溶剂(如乙酸乙酯)的加入,目标分析物能够在水相与有机相之间进行高效分配, 从而获得较高的提取回收率。 该技术降低了操作者暴露于有机提取溶剂的风险,安全性更好。 目前,Saito-Shida S 等[64]已将其用于牛和鳗鱼可食性组织中FF 总残留物的提取。 超声辅助提取利用超声波的空化效应和搅拌作用促使样品基质中的FF 残留物进入乙腈、冰乙酸溶液、丙酮-水混合物等提取溶剂中,提取效率高、 安全性好, 常被用于畜禽可食性组织[23,41,55,67]、禽蛋[58,65]和牛乳[19]中FF 残留物的提取。酶-微波辅助萃取以蛋白酶K 水解组织样品,以低频微波促进FF 向乙腈-水混合物中扩散,可有效提取小龙虾肌肉中的FF[63]。QuEChERS 方法是近年来美国农业部开发的一种快速样品前处理技术, 目前已经商品化。 它能同时实现生物样品中目标分析物的提取和净化,而且提取回收率高、重现性好、操作简便快速,在FF 残留检测中也有应用[19,45,52]。 分散液-液微萃取通过快速混合一定比例的超纯水、 萃取溶剂(氯仿)和分散溶剂(脱脂牛乳),形成浑浊体系,增大FF 与氯仿的接触表面积, 达到提取和浓缩的目的[29]。 该技术可对生物样品中的目标分析物进行高倍浓缩,而且操作简单、快速,价格低廉,但通常绝对提取回收率不高,而且不适用于固体样品。快速溶剂萃取是一种在高温高压条件下以有机溶剂提取目标分析物的技术,提取回收率高、速度快,且易于实现自动化,被广泛用于兽药残留分析。王波等[65]采用该方法提取鸽蛋中的FF 和FFA,结果表明在80 ℃和1 500 psi 压力下,以甲醇-氨水-水混合物作为提取溶剂, 提取回收率高于92%, 相对偏差小于等于2.57%,比同等条件下液-液萃取法更有优势。 亚临界水萃取利用水在亚临界状态下对目标分析物溶解性明显提高的特点, 能有效地将目标分析物从生物样品中提取出来。通过比较,亚临界水萃取对鸡可食性组织中FF 和FFA 的提取效率比液-液萃取和超声辅助提取更好[46]。而且更重要的是,亚临界水萃取以水作为提取溶剂,更加环保。 但是,该提取技术依赖于特殊的高压快速溶剂萃取系统,为了确保安全,操作者需要进行专业的培训。

图1 氟苯尼考及代谢物水解生成氟苯尼考胺的示意图
基于固相吸附材料的提取技术也被用于从动物源性食品中提取FF 残留物。 这些技术包括固相萃取(Solid-phase extraction)[44,68]、基质固相萃取(Matrix solid-phase dispersion extraction)[19,40,43,47]、 磁性分散固相萃取(Magnetic dispersive solid phase extraction)[28,30]和织物相吸附萃取 (Fabric phase sorptive extraction)[26]。 它们所用的固相吸附材料为Strata X[19]、 溶胶-凝胶短链聚乙二醇 (Sol-gel short-chain ethylene glycol)[26]、磁性分子印迹聚合物[28]、磁性适配子改性吸附剂[30]、C18[40,43,47,68]和Oasis MCX[44],这些固相吸附材料均能较好地吸附牛乳、 禽蛋或组织消解液中的FF 残留物。 基于固相吸附材料的提取技术能同时完成生物样品中目标分析物的提取、 净化和浓缩,而且提取回收率高,重现性好,有机试剂消耗较少。 尽管如此,这些技术也有一些不足,如它们对样品基质的洁净度要求较高,通常只适用于牛乳、禽蛋和肌肉等内源性干扰物较少的生物样品。 为了减少内源性干扰物对提取回收率的影响, 在提取之前还需要对这些样品进行去蛋白[19,28,68]、脱脂[44]或稀释[30,44]等处理。 此外,磁性分散固相萃取和织物相吸附萃取只能适用于牛乳等液态样品。 最后,提取FF残留物的固相吸附材料价格较为昂贵(如C18、Oasis MCX、Strata-X),有的制备工艺较为复杂(如溶胶-凝胶短链聚乙二醇、 磁性分子印迹聚合物和磁性适配子改性吸附剂)。
2.2 动物源性食品中氟苯尼考残留物的纯化技术动物源性食品中含有大量的内源性干扰物。 其中的部分干扰物可随FF 和FFA 被共萃取而进入待检测样品中,这些干扰物的存在不仅降低方法的特异性,也损害分析仪器,缩短色谱柱的使用寿命。对于生物分析方法, 内源性干扰物的存在影响FF 或FFA 与检测分子(如抗体)的特异性结合,使方法的准确性和精确性降低。 如何有效地消除内源性干扰物带来的基质效应已经成为FF 残留检测面临的重要挑战之一。
事实上, 动物源性食品中部分内源性干扰物在样品提取步骤已经被去除掉。 但是,那些随FF 残留物被共萃取的内源性杂质仍然能够显著地干扰检测,它们的种类和含量取决于提取方法和提取溶剂。如对于畜禽可食性组织中FF 总残留物的检测,在提取之前需要对组织匀浆进行水解以释放其中的结合残留物,但在这一过程中,大量的内源性干扰物会被释放出来,令后续样品的纯化变得更加困难。而以乙酸乙酯-氨水混合物直接提取组织样品中的FF和FFA, 样品提取液中的内源性干扰物就明显少很多。 又如,用乙酸乙酯提取畜禽可食性组织、禽蛋和牛乳中的FF 残留物, 样品提取液中往往含有大量的脂肪;将乙酸乙酯换成乙腈,样品提取液中脂肪的含量则明显减少。 还有,以乙酸乙酯-氨水混合物提取猪肝脏中的FF 和FFA,样品提取液呈现浅黄色,杂质较少;而将提取溶剂换为乙酸乙酯,样品提取液中则含有大量酒红色未知干扰物。由此看来,在保证FF 残留物被充分提取的前提下,可以通过优化提取方法和选择合适的提取溶剂来减少样品提取液中的内源性干扰物。
那些进入样品提取液中的内源性干扰物还可以使用相应的样品纯化技术去除掉。 对于共萃取的脂肪, 通常用正己烷[12,15,17-18,20-22,24-25,27,31,33,35-38,42,44-45,47-50,53-56,58-60,64-65,71,73-74,77]去除,也可用乙酸乙酯[16,31,50]和庚烷[57]脱脂,还能通过冷冻[33]和高速离心[76]的方式去掉。 正己烷脱脂效率高,不会导致FF 残留物的损失[45],因而被广泛使用。 乙腈饱和的正己烷似乎更加适合去除禽蛋提取物中的脂肪[58,65]。乙酸乙酯在脱脂的同时也能提取少量的FFA。 但是FFA 结构中含有胺基,更易于溶解于酸性水溶液中,所以,用乙酸乙酯洗涤强酸水解后的组织消解液并不会影响FFA 的回收率[16,31,50]。 畜禽可食性组织、牛羊乳和禽蛋中含有大量的蛋白质,会干扰FF 残留物的检测,并堵塞色谱柱。这些蛋白质可用膜分离技术[15]去除掉,也可加入乙腈使之形成沉淀,然后通过离心去除[28-29,34,61]。 此外,甲基叔丁基醚[45]和盐酸溶液[68]也是较好的蛋白沉淀剂。 QuEChERS 方法将液-液萃取、 盐析和分散固相萃取结合起来, 也可有效地去除这些蛋白质[19,45,52]。 脱脂和去蛋白的操作并不能有效地去除那些在性质或结构上与FF 残留物相似的内源性杂质,为确保方法的特异性,还需要使用其它一些样品纯化技术。 固相萃取技术依赖特殊的固相吸附材料分离FF 残留物和内源性杂质,操作简单,能够同时对样品进行提取、纯化和浓缩,还可实现自动化,因而被广泛用于动物源性食品中FF 残留物的检测[11-12,16-17,19,21,23-24,28,30,32-35,37,40-47,50,54-55,59,61,64,66-68]。 固相吸附材料的选择对于样品的纯化效果至关重要, 文献报道的固相吸附材料包括C18[11-12,21,32,40,43,47,59,66-68]、Oasis MCX[17,24,35,37,41,44-45,64]、Oasis HLB[23,33-34,41,46,61]、 硅藻土[16,50,55]、Strata-X[19]、磁性分子印迹聚合物[28]、磁性适配子改性吸附剂[30]、PSA[42]和苯基[54]。 其中,Oasis MCX 填料利用反相吸附和离子键吸附的双重保留机制, 可较好地将FFA 与内源性杂质区分开来;磁性分子印迹聚合物是以FF 为模板分子制备的固相吸附材料,选择性也很好;磁性适配子改性吸附剂通过DNA 适配子特异性吸附FF 的原理, 可有效去除内源性杂质。除此以外的其它固相吸附材料选择性普遍不高,难以取得令人满意的纯化效果。 免疫亲和色谱是基于抗原抗体特异性的结合反应而发展起来的一种样品纯化技术, 目前, 已经被应用于猪肌肉中FF 和FFA 的分离纯化[39];免疫亲和色谱具有纯化效率高、有机试剂用量少的优点,但也存在抗体稳定性不高、制备过程复杂和价格昂贵等不足。 薄层色谱是一种经典的色谱分离技术, 它利用样品中各组分对吸附材料亲和力的差异, 在连续的吸附和解吸附过程中将它们彼此分离开来; 薄层色谱板比固相萃取小柱具有更高的理论塔板数, 这使它能够更加高效地纯化复杂的生物样品。 Zhou D 等[31]将猪可食性组织的消解液分别用固相萃取技术(Oasis MCX 吸附剂)和薄层色谱(普通的硅胶吸附剂)纯化,结果表明薄层色谱的纯化效果明显优于固相萃取技术。此外,与固相萃取技术和免疫亲和色谱相比, 薄层色谱还具有明显的价格优势。 当然, 薄层色谱也存在一些不足, 如薄层色谱板载样量小, 为了确保方法的灵敏性,点样前需要对样品提取液进行高倍浓缩;若提取液中含水,会令浓缩过程变得非常困难[31]。 又如,薄层色谱对样品的洁净度有一定的要求, 共萃取的脂肪和蛋白质会干扰点样和展开过程, 需要预先去除[31]。还有,薄层色谱的操作比固相萃取和免疫亲和色谱更加复杂、费时。 最后,操作者在点样环节也容易暴露于有机试剂中, 对其健康造成危害。 尽管如此, 薄层色谱作为一种样品纯化技术仍然有着巨大的应用前景,将它与高效液相色谱法结合起来,以薄层色谱优秀的样品纯化效果弥补液相色谱仪在特异性上的不足, 有助于拓宽高效液相色谱法在兽药残留分析中的应用[31,83]。
2.3 待测样品中氟苯尼考残留物的浓缩 浓缩也
是样品前处理程序中重要的环节。 通过浓缩, 可以让待测样品中目标分析物的浓度成倍增加, 对于提高方法的灵敏性很有帮助。 浓缩往往是在样品提取之后、检测之前。 如上所述,大多数的FF 残留检测方法都以溶剂萃取法从动物源性食品中提取FF 和FFA。 对于所得到的样品提取液,若是沸点较低的有机溶剂,通常采用旋转蒸发法[17,25,32,35,37,48,64]和氮气吹扫法[11-12,15,18,20-24,27,31,33,36,38,42,45,49,52-60,62-63,69,71,73-74,77-78]进行浓缩,也可以采用离心浓缩法[65];若为含水的缓冲液或混合溶液,则常采用固相萃取[16,34,41,44,46,50,61,68]和免疫亲和色谱[39]等技术进行浓缩。 旋转蒸发法在减压条件下对样品提取液进行连续蒸馏,从而达到浓缩的目的;它能迅速去除样品提取液中易挥发的有机溶剂,特别适合较大体积(如50~100 mL) 样品提取液的浓缩。旋转蒸发法也存在一些不足,如浓缩在减压条件下进行, 若温度过高则容易发生爆沸, 使样品被污染,因而需要有专人看管;其次,旋转蒸发仪一次只能处理一个样品, 浓缩效率不如氮气吹扫法。 氮气吹扫法是在常压条件下以氮气(或空气)吹扫经过加热的样品提取液来达到浓缩的目的, 比较适合较小体积(如0.5~50 mL)样品提取液的浓缩,也常常配合固相萃取技术[17,21,23-24,31-35,37,41,44-45,50,54,61,68]、免疫亲和色谱[39]和QuEChERS 方法[19,45,52]同时使用。 绝大多数氮吹仪能同时处理几十个样品, 效率比旋转蒸发法更高。 固相萃取小柱和免疫亲和小柱能够将样品提取液中的FF 残留物保留于特殊的吸附材料上, 然后再用少量的洗脱溶剂将它们洗脱下来, 从而同时完成提取、纯化和浓缩三个步骤。由于浓缩过程中无需对样品提取液进行蒸馏或挥干, 因而固相萃取和免疫亲和色谱非常适合含水较多的样品提取液的浓缩。 随着样品前处理技术向更加简单快捷的方向发展,一些集样品提取、纯化和浓缩于一体的新技术也不断被应用于动物源性食品中FF 的残留检测。 其中最具有代表性的是分散液液-微萃取[29]、磁性分散固相萃取[28,30]和基质固相萃取[19,40,43,47],它们的优缺点已在上述进行了比较。
3 样品的检测
多种方法被用于检测样品中的FF 残留物。 高效液相色谱法是其中较为常见的一种, 液相色谱-质谱联用法在FF 残留检测中应用最为广泛。 气相色谱-质谱联用法、 毛细管电泳法和生物分析方法虽有报道,但并不多见、不作详细介绍。
高效液相色谱法多使用紫外检测器进行定量,检测波长通常为220~240 nm[15-19,21-31];也有个别方法采用荧光检测器进行定量, 激发波长为224 nm,发射波长为290 nm[20]。 样品中的FF 残留物可采用反相C8[16,23]和C18 色谱柱[15,17-22,24-31]分离。若目标分析物为FF,流动相可为乙腈-水混合物[21,25,27-29]、乙腈-乙酸铵溶液混合物[23,26]和甲醇-水混合物[30];若目标分析物中含有FFA,则需要使用梯度洗脱程序[15-16]将FFA 与内源性杂质分离开, 也可以在流动相中加入庚烷磺酸钠[15,17]或十二烷基磺酸钠[18,20,24,31]来获得良好的色谱分离效果。 梯度洗脱虽然有助于提高色谱分离效果,但会导致基线漂移,并延长样品分析时间。庚烷磺酸钠和十二烷基磺酸钠是常用的离子对试剂,它们可与FFA 形成离子对,增强FFA 在反相色谱柱上的保留。 流动相中离子对试剂的浓度对FFA的保留时间影响很大, 提示可通过调整离子对试剂的量来获得良好的色谱分离效果。但是,这些离子对试剂在水中的溶解性不好, 在配制流动相时往往需要超声助溶。 离子对试剂加得过多不仅会使流动相难以配制, 而且已溶解的离子对试剂在较低的室温下还可能析出,影响方法的重现性。 此外,十二烷基磺酸钠等离子对试剂很难从色谱柱上冲洗干净,这会让下一次分析前平衡色谱柱所需要的时间大大延长。一些研究表明,FFA 结构中的胺基可能与色谱柱填料中残留的硅醇基结合,导致色谱峰拖尾[15-17,20]。为了获得良好的峰型, 需要在流动相中加入三乙胺作为扫尾剂[15-18,20,22,31]。 Zhou D 等[31]、Qian M 等[83]较系统地考察了流动相组成与比例对FFA 检测的影响,确定了最佳的流动相为乙腈-磷酸盐缓冲液(含2.5 mM 十二烷基磺酸钠和体积百分比0.1%三乙胺)的混合物(33.3:66.7)。
液相色谱-质谱联用法检测待测样品中的FF残留物,可用于色谱分离的分析柱有反相C18 柱[11-12,36-37,39-40,43-47,49-51,53-65]、苯基柱[38,42]、苯基-己基小粒径快速分析柱[41]、亲水作用(HILIC)色谱柱[48]和甲基丙烯酸月桂酯-甲基丙烯酸-乙二醇二甲基丙烯酸酯聚合物整体柱[52]。 流动相通常为乙腈-水混合物[12,37,39,53-55,58-59]或含有氨水[11]、甲酸[63-64]、冰乙酸[36]、甲酸铵[42,49]、乙酸铵[36,48,65]的乙腈-水混合物,甲醇-水混合物[46-47,50]或含有甲酸[38,43,57,61]、冰乙酸[41,60]、甲酸铵[61]、乙酸铵[40-41,43]的甲醇-水混合物。 也有的方法采用更为复杂的甲醇-乙腈-水混合物作为流动相[44-45,56,62]。 梯度洗脱被几乎所有的液相色谱-质谱联用法采用[11,36-65]。 对于FF 残留物的检测, 绝大部分方法采用电喷雾电离源[11,36-40,42-49,51-58,60-65],也有一些方法采用加热电喷雾电离源[12,41,50,59]或大气压化学电离源[50]。 FF 的扫描方式通常为负电子模式, 毛细管电压为1~4.5 kV[36-40,43,45-47,49,51-58,60-63,65];FFA 的扫描方式通常为正电子模式,毛细管电压为1~5.5 kV[11-12,36-37,39,41-46,48-50,53-54,56,58-60,64-65]。 质谱的工作模式通常为多反应监测模式[11,37,39,42-52,54,56-58,60-63,65],也有方法采用选择反应监测模式[12,38,40-41,53,55,59,64]或全扫描模式[36]。
4 动物源性食品中氟苯尼考残留检测方法面临的问题
4.1 目标分析物的认定 FF 在食品动物体内可被广泛代谢,部分代谢物可与生物大分子(如蛋白质)形成牢固的结合残留物而长期蓄积在动物源性食品中。 在治疗剂量下,FF 结合残留物占总残留物的比例,牛肝脏和肾脏中分别为71.1%~91.1%和22.2%~76.1%,残留持续时间长达30 d[1];猪肾脏和肌肉中分别为76.8%~96.0%和65.7%~88.5%, 残留持续时间为14 d[11];鸡肾脏、肝脏和肌肉中分别为81.9%~87.7%、80.7%~98.0%和47.0%~58.8%, 残留持续时间长达20 d[12]。 这些结合残留物无法被溶剂直接萃取,需经过强酸水解才能从组织中释放出来,同时自身转化为FFA[11-12,16,31,42,44,50,64,69]。考虑到FF 结合残留物可能带来的食品安全风险, 欧盟和日本均规定FF的残留标志物为以FFA 计算的FF 总残留物,包括FF 原型及各种代谢物[13-14]。 但是在我国,农业部2017 年修订的动物性食品中兽药MRL 标准规定FF 和代谢物FFA 的总和被指定为FF 残留监控的残留标志物[10]。监控对象上的不同给FF 残留检测方法的开发者和使用者带来了困惑,目前已报道的FF残留检测方法中,绝大多数只能检测可被萃取的FF和FFA。 笔者认为, 采用这些方法监控动物源性食品中FF 的残留可能得到 “假阴性” 的检测结果,导致误判。 以Imran M 等[12]的研究为例,肉鸡按照30 mg/kg 剂量连续口服5 d,休药7 d 后从肾脏中检测到可被萃取的FF 残留物浓度为125.04 μg/kg,低于MRL(750 μg/kg),应该判定为合格;而事实上,在该批样品中还有806.50 μg/kg 的FF 结合残留物未被发现。 类似这样的动物源性食品一旦流入市场将会威胁食品安全,若销往欧盟,则可能使我国的养殖企业面临巨额赔偿。 近年来,动物源性食品中FF 的总残留物逐渐受到关注, 可检测FF 总残留物的方法也陆续有报道, 这些方法通过高温条件下强酸水解组织样品来释放其中的FF 结合残留物, 避免了“假阴性”的检测结果。
4.2 氟苯尼考和氟苯尼考胺的回收率 准确性是FF 残留检测方法的重要评价指标,通常用回收率表示。 不恰当的样品前处理可能导致方法的回收率偏低。 如检测组织样品中的FF 总残留物,须先将组织匀浆充分水解之后才能进行提取。酸的强度、孵育温度、水解时间以及FFA 在高温、强酸环境中的稳定性对方法的回收率都有影响, 需要进行系统研究。Faulkner D 等[11]发现,70 ℃下不足以将组织样品完全消解,FF 结合残留物无法充分释放;100 ℃下在6 N 盐酸溶液中孵育8 h,FFA 的含量没有明显减少。Imran M 等[12]研究表明,在95~100 ℃下以6 N 盐酸水解鸡可食性组织2 h, 无法完全释放其中的FF结合残留物, 而同样条件下水解4 h 回收率则明显升高。 类似的结果也出现在Kong A 等[42]的研究中。在样品提取步骤,FF 和FFA 可能因为提取溶剂的组成和提取环境的pH 值等因素损失。FFA 呈碱性,若以乙酸乙酯等有机溶剂进行提取, 需要同时加入少量氨水[20,22,33,35,37,48-49,53-54,58-59,65,69,74],或者将样品溶液的pH 调节为碱性[11-12,16,31,42,58,74]。 Imran M 等[12]研究了pH对于乙酸乙酯提取FFA 的影响,结果表明组织消解液的pH 小于10.5 时,至少有10%~15%FFA 在乙酸乙酯提取时损失掉,FF 侧链上的酰胺键似乎容易在碱性条件下发生水解。 Qian M 等[83]发现,将尿液的pH 调节至大于12,再用乙酸乙酯提取其中的FF 和FFA,FF 的回收率小于33.7%, 而FFA 的回收率则大于126.3%, 提示若同时检测可被萃取的FF 和FFA,调节pH 时需要特别注意。 浓缩通常不会导致分析物的损失,但对FFA 是一个例外。 研究表明,以旋转蒸发或氮气吹扫法浓缩样品提取液(如乙酸乙酯)都可导致FFA 大量损失[17,31,37,83]。尽管原因尚不明确, 但在旋转蒸发前于样品提取液中加入异丙醇3 mL 和5%冰乙酸溶液1.5 mL[17],或在氮气吹扫前于样品提取液中加入少量5%冰乙酸溶液[31,37,83],能有效避免FFA 在浓缩过程中的损失。 样品纯化过程中同样伴随着FF 和FFA 的损失, 如用乙腈等蛋白沉淀剂去除牛乳中的蛋白质时,FF 可能会发生共沉淀,从而导致方法的回收率下降[19]。 Wei S 等[28]用乙腈对蛋白沉淀物进行了再次提取, 提高了FF 的回收率。 在用薄层色谱净化组织提取液时,FFA 的胺基能与硅胶的硅醇基结合导致其在薄层色谱板上拖尾,使得方法回收率下降。调节展开液的组成以增强洗脱能力, 或在刮取硅胶时向下延伸一定距离都可以减少FFA 的损失[31,83]。 总之,样品前处理的每个环节都可能导致FF 和FFA 的损失,且步骤越多,损失的可能性就越大,回收率也就越低。为保证方法的准确性, 系统地研究样品前处理过程中影响回收 率的因素, 并在此基础上优化样品前处理程序很有必要。
5 小 结
氟苯尼考(FF)在我国养殖业中应用广泛,建立可靠的残留检测方法对规范FF 的使用、 保障食品安全至关重要。 动物源性食品中大量存在的FF 结合残留物值得关注, 为减少误判,FF 残留检测方法应该能够检测动物源性食品中FF 的总残留物。 样品前处理是FF 残留检测方法的重要组成部分,优化样品前处理程序, 能够提高方法的特异性、 灵敏性、准确性和精确性。 薄层色谱纯化效果好、价格低廉、绿色环保,可用来解决兽药残留分析中基质干扰这一技术难题。

