血根碱在小鼠烟曲霉菌性角膜炎中的抗炎作用
鲁叶慧,栾军杰,刘星,吴瑗,林静
(青岛大学附属医院眼科,山东 青岛 266003)
真菌性角膜炎是一种严重的角膜感染性疾病,在亚洲和非洲等发展中国家发病率高[1]。丝状真菌如烟曲霉菌和镰刀菌是诱发真菌性角膜炎的主要原因,一旦其分生孢子透过角膜上皮进入到基质,孢子会迅速萌发,诱发症状。目前,真菌性角膜炎的一线治疗是局部使用那他霉素、伏立康唑、两性霉素B等药物[2],但这些药物存在水溶性差、渗透性差及严重的不良反应,因此亟待开发可用于临床的低毒高效的治疗药物。血根碱(SAN)为一种季铵盐类苯并菲啶生物碱,是来源于血根草、大白屈菜和博落回的一类重要的天然异喹啉生物碱[3-4]。 SAN具有多种药理活性,包括抗肿瘤、抗菌、抗炎和改善心血管功能等[5-9]。最近的研究显示,在大鼠的神经源性疼痛模型中,SAN可以通过抑制白细胞介素1β(IL-1β)、白细胞介素6(IL-6)等炎症因子的表达来减轻疼痛[10-12]。SAN在急、慢性炎症中发挥抗炎作用。但是SAN能否在真菌性角膜炎中发挥抗炎作用尚未见报道。本研究旨在探讨SAN对烟曲霉菌感染的巨噬细胞及小鼠角膜炎症的调节作用,为治疗真菌性角膜炎提供一种新思路。
1 材料和方法
1.1 实验材料
小鼠来源的RAW264.7巨噬细胞系购于中国科学院细胞库(上海)。实验所用40只8周大小健康的C57BL/6雌鼠购于山东济南朋悦有限公司,体质量20~30 g,按照青岛大学附属医院动物委员会批准的方案饲养。SAN(100 mg,纯度98%)由麦克林试剂公司提供,用体积分数0.001的DMSO溶解后以2 g/L储备液-20 ℃储存;RNAex pro reagent裂解液(艾科瑞生物工程有限公司);酶联免疫吸附试验(ELISA)检测试剂盒(Biolegend公司);苏木精-伊红(HE)染色试剂盒(碧云天,中国);烟曲霉菌(CPCC 3.0772,中国普通微生物菌种保藏管理中心(北京))。
1.2 研究方法
1.2.1烟曲霉菌丝制备 烟曲霉菌丝及灭活烟曲霉菌丝制备方法基于本实验室原有步骤,进行优化[13]。将烟曲霉标准菌株接种于酵母膏胨葡萄糖培养液(葡萄糖10 g、蛋白胨100 g、酵母5 g溶解于双蒸水中定容1 L),置35 ℃培养箱孵育4~7 d后于超净工作台研磨菌丝至20~30 μm大小,一半经3次离心后重悬,用DMEM稀释至1×1011CFU/L;另一半浸泡于体积分数0.75乙醇中,24 h后重复前述步骤,获得灭活烟曲霉菌用于后续实验。
1.2.2CCK-8实验检测SAN对RAW264.7细胞活力的影响 RAW264.7细胞以4×108CFU/L接种于96孔板中,孵育12 h至细胞密度约70%更换含SAN(浓度分别为0、62.5、125.0、250.0、500.0、1 000.0 μg/L)培养液,继续孵育24 h后,以无菌PBS洗涤3次,更换含CCK-8的培养液继续孵育2 h后,使用酶标仪(PerkinElimer, 美国)测各孔450、600 nm波长处的吸光度值。每个样本设5个复孔,实验重复3次。
1.2.3小鼠分组及处理 32只健康小鼠随机分为N组、500.0 μg/L SAN处理组(SAN组)、AF处理组及AF+500.0 μg/L SAN处理组(AS组),每组8只,每只小鼠的右眼为实验眼,左眼为空白对照眼。建模:AF组和AS组小鼠腹腔注射80 g/L水合氯醛约0.08 mL后,用手术无菌刀片刮除中央角膜上皮形成约2 mm×2 mm缺损区域,做井字划痕、涂抹烟曲霉菌、覆盖光滑的角膜接触镜并缝合眼睑,24 h后拆除缝线。N组和AF组小鼠以双蒸水点眼治疗,每次5 μL,每天4次;SAN组和AS组小鼠以500.0 μg/L SAN点眼治疗,每次5 μL,每天4次。治疗第3天,以颈椎脱臼法处死小鼠,获得小鼠角膜组织。6只健康小鼠随机分为AF处理组和AS处理组,建模后分别以双蒸水和500.0 μg/L SAN点眼治疗,每次5 μL,每天4次,治疗第3天以颈椎脱臼法处死小鼠,取小鼠眼球。
1.2.4细胞刺激 RAW264.7细胞接种于12孔板,孵育至细胞密度约80%后换液。将细胞分为N组、SAN组、AF组、AS组,AF组及AS组每孔加入60 μL灭活烟曲霉菌丝,2 h后SAN组及AS组加入SAN溶液使SAN终浓度为500.0 μg/L,8 h后收集细胞样本用于细胞RT-PCR实验(每组6孔); 24 h后收集细胞上清液,离心后取上清液用于细胞ELISA检测(每组8孔)。
1.2.5HE染色检测小鼠角膜中炎症细胞的浸润AS处理组(n=3)和AF处理组(n=3)的眼球分别在含OCT包埋剂的EP管(2 mL)中调整至合适位置后迅速液氮冻存,使用Leica冷冻切片机切取角膜中央最大截面处8 μm厚的角膜切片。应用HE染色试剂盒染色,按说明书方法进行操作,自然晾干后中性树胶封片。光学显微镜下观察小鼠角膜中炎症细胞浸润情况。
1.2.6实时荧光定量PCR(RT-PCR)检测细胞因子的mRNA表达 细胞中加入RNAex pro reagent裂解液后,在冰上裂解0.5 h,用无菌的200 μL黄枪头刮取细胞收集至2 mL的 EP管中,根据RNAex pro reagent试剂说明书进行逆转录,建立2 μg逆转录反应体系。使用RT-PCR仪进行扩增反应,以β-actin为内参,检测巨噬细胞中IL-1β、IL-6、TNF-α及单核细胞趋化蛋白(MCP-1)的mRNA表达。引物及其序列来自GenBank,由艾科瑞生物有限公司设计及合成。见表1。
1.2.7相关蛋白表达检测 应用ELISA试剂盒检测小鼠RAW264.7细胞中IL-1β、IL-6、TNF-α以及MCP-1及小鼠角膜组织中TNF-α和COX-2的蛋白表达,根据试剂盒说明书方法进行实验。使用酶标仪检测450 nm及570 nm波长处吸光度。
1.3 统计学方法

2 结 果
2.1 不同浓度SAN溶液对巨噬细胞活力的影响
不同浓度的SAN(0、62.5、125.0、250.0、500.0、1 000.0 μg/L)与RAW264.7细胞共孵育24 h后,1 000.0 μg/L SAN溶液处理组巨噬细胞的存活率低于其他各组,差异有统计学意义(F=2.272,P<0.05)。500.0 μg/L浓度以内的SAN处理组的细胞存活率与正常对照组比较差异无统计学意义(P>0.05)。见图1。后续实验选择500.0 μg/L作为研究浓度。

与其他浓度组比较,*F=2.272,P<0.05。
2.2 烟曲霉菌对小鼠角膜组织中炎症细胞浸润的影响
HE染色观察结果显示,感染烟曲霉菌3 d后,500.0 μg/L SAN组和AF组相比,小鼠角膜基质层水肿明显减轻,炎症细胞数量显著减少,组织病理结构更为有序(图2)。

A:AF组;B:500.0 μg/L SAN组。HE染色, 400倍。
2.3 各组细胞中IL-1β、IL-6、TNF-α以及MCP-1 mRNA 表达水平比较
析因设计的方差分析结果显示,灭活菌丝处理产生的单独效应(FAF=131.211~253.824,P<0.01)、SAN处理产生的单独效应(FSAN=28.794~119.300,P<0.01)、不同灭活菌丝处理组间(F=141.468~360.577,P<0.01)和不同SAN处理组间(F=10.373~18.560,P<0.01)差异均有统计学意义,灭活菌丝处理与SAN处理之间存在交互作用(FAF×SAN=10.566~18.536,P<0.01)。与N组和SAN组相比较,AF组细胞炎症递质IL-1β、IL-6、TNF-α和MCP-1的mRNA表达水平明显升高;与AF组相比,AS组炎症递质IL-1β、IL-6、TNF-α和MCP-1的mRNA表达水平明显下降,差异均有统计学意义(F=20.939~37.097,P<0.01)。见表2。
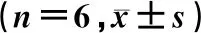
表2 SAN对RAW264.7细胞各种炎症递质mRNA表达影响
2.4 各组细胞中IL-1β、IL-6、TNF-α和MCP-1 蛋白表达水平比较
析因设计的方差分析结果显示,灭活菌丝处理产生的单独效应(FAF=1 765.400~6 636.850,P<0.01)、SAN处理产生的单独效应(FSAN=98.002~3 070.111,P<0.01)、不同灭活菌丝处理组间(F=1 490.936~9 367.445,P<0.01)和不同SAN处理组间(F=63.775~1 347.574,P<0.01)差异均具有统计学意义,灭活菌丝处理与SAN处理存在交互作用(FAF×SAN=61.187~1 342.599,P<0.01)。与N组和SAN组相比,AF组中炎症递质IL-1β、IL-6、TNF-α和MCP-1的蛋白表达水平明显上调;AS组与AF组相比,炎症递质IL-1β、IL-6、TNF-α和MCP-1的蛋白表达水平明显降低,差异有统计学意义(F=124.949~2 690.170,P<0.01)。见表3。
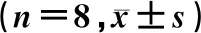
表3 SAN对RAW264.7细胞炎症递质蛋白表达影响
2.5 各组小鼠角膜中TNF-α和COX-2 蛋白表达水平比较
析因设计的方差分析显示,灭活菌丝处理产生的单独效应(FAF=1 207.798、1 569.370,P<0.01)、SAN处理产生的单独效应(FSAN=75.086、260.364,P<0.01)、不同灭活菌丝处理组间(F=942.588、1 554.091,P<0.01)和不同SAN处理组间(F=295.009、356.222,P<0.01)的差异均有显著性,灭活菌丝处理与SAN处理有交互作用(FAF×SAN=275.643、340.296,P<0.01)。与N组和SAN组相比较,AF组小鼠感染烟曲霉菌3 d后,炎症递质TNF-α和COX-2蛋白表达水平明显升高;AS组与AF组相比,小鼠感染烟曲霉菌3 d后,炎症递质TNF-α和COX-2的蛋白表达水平明显降低,差异有显著性(F=570.488、696.427,P<0.01)。见表4。

表4 SAN对小鼠角膜中炎症递质蛋白表达的影响
3 讨 论
真菌性角膜炎是由致病真菌诱导的严重眼部感染性疾病,其致病因素中植物划伤引起的角膜损伤约占40%~60%[14],另外隐形眼镜的使用[15]、长期使用抗生素或类固醇[16]、既往眼部手术史[17]都是重要的致病因素。当烟曲霉菌首次攻击宿主时,其毒力决定簇诱发宿主发生强烈的固有免疫反应[10],固有免疫系统包括巨噬细胞、中性粒细胞和树突状细胞等,是抵御真菌感染的第一道防线;它能够快速启动并消除入侵的烟曲霉菌[11]。这种防御机制涉及特异性受体的识别、指示信号通路的激活和多种炎症递质的产生,从而加强炎症反应。但是大量的炎症递质可引发严重的炎症反应,会加重感染组织的损伤,使真菌感染的病程延长,产生一系列危险的并发症如角膜穿孔甚至患眼失明[12]。真菌性角膜炎的发病率逐渐增高,且临床缺乏有效治疗药物,迫切需要找到新的高效低毒治疗药物。
SAN是一种以苯并菲啶结构为特征的生物碱类天然小分子,具有高效抗炎[18-19]、抗菌[4,7,20]、抗肿瘤[21]等药理活性。已有研究表明,在大鼠LPS介导的H9c2心肌细胞炎症反应中,SAN可以通过抑制大鼠H9c2心肌细胞释放炎症递质IL-1β、IL-6和TNF-α发挥抗炎作用[22]。此外有研究显示,在LPS诱导的小鼠巨噬细胞内毒性休克模型中,SAN通过抑制小鼠巨噬细胞释放TNF-α及NO发挥抗炎作用[18]。然而,SAN在真菌性角膜炎中是否发挥抗炎作用尚未有报道。炎症从本质上说是机体的防御反应,在初期往往起到积极作用,例如炎性充血可增加局部组织血流量,使组织得到更多的氧气、营养物质等,增加组织代谢和抗击力[23]。但持续的炎症反应使得巨噬细胞产生过量的炎症递质,可能加重角膜损伤;还会导致角膜蛋白沉积,造成角膜水肿甚至角膜穿孔。本研究首先探究SAN在小鼠巨噬细胞中的安全浓度,结果表明500.0 μg/L SAN对小鼠巨噬细胞没有影响,可作为安全浓度用于后续实验。本文研究感染第3天的小鼠角膜组织HE染色结果显示,500.0 μg/L SAN组和AF组相比,小鼠角膜基质层水肿明显减轻,炎症细胞数量显著减少,组织病理结构更为有序。ZHENG等[24]研究显示,在LPS诱导的小鼠乳腺炎模型中,SAN通过显著减少LPS引起的中性粒细胞浸润、减轻腺泡结构的破坏,进而修复血-乳屏障发挥抗炎功能。本文研究结果与其一致。因此,SAN可能通过抑制炎症反应中的免疫细胞过度激活,对烟曲霉菌性角膜炎起到治疗作用。
在真菌性角膜炎中,炎症细胞过度激活会导致大量的炎症递质释放加重炎症反应[25]。已有研究证实,IL-1β是参与角膜抗真菌免疫应答的重要炎症因子,主要由激活的单核细胞产生,介导急性炎症应答[26]。在右旋糖酐硫酸钠诱导的小鼠溃疡性结肠炎模型中,SAN通过阻断NLRP3-(Caspase-1)/IL-1β通路,降低炎症因子IL-1β的表达,对小鼠结肠炎具有治疗作用[27]。本研究结果显示,SAN能够明显抑制小鼠RAW264.7细胞中烟曲霉菌刺激引起的IL-1β基因及蛋白表达升高。提示SAN可能通过抑制IL-1β的表达发挥抗炎作用。炎症因子TNF-α、IL-6及趋化因子MCP-1为反映角膜炎症的重要指标,TNF-α、IL-6和MCP-1的表达升高可以介导白细胞募集和巨噬细胞迁移及浸润[28]。LIN等[29]研究显示,在吲哚美辛诱导的大鼠肠道炎症模型中,SAN可以通过降低大鼠肠道组织中TNF-α和IL-6的水平发挥抑炎作用。有研究显示,在LPS刺激的人单核细胞白血病THP-1细胞系中,SAN可以通过下调炎症递质IL-1β、MCP-1和IL-6的基因表达发挥保护作用[30]。本文实验结果显示,SAN能显著减少烟曲霉菌刺激的小鼠巨噬细胞中IL-6、TNF-α和MCP-1的表达。另有研究显示,在真菌感染宿主后,宿主体内的单核巨噬细胞等会迅速诱导COX-2的表达增加,导致下游的抑炎因子表达被抑制,对角膜炎的预后造成不利影响[31]。本文对真菌性角膜炎小鼠模型研究显示,SAN能显著下调COX-2及TNF-α的表达。LI等[19]研究显示,在LPS诱导的小鼠急性肺损伤模型中,SAN通过抑制COX-2的表达抑制炎症细胞因子的释放,进而抑制炎症反应,降低急性肺损伤小鼠的致死率。本文研究结果与其相一致。因此,应用SAN治疗也可以通过减轻真菌性角膜炎中炎症递质的过度表达,从而改善真菌性角膜炎的预后。
综上所述,SAN可以通过减少炎症细胞的浸润和下调炎症递质的表达,减轻小鼠角膜烟曲霉菌感染后的炎症反应,有望成为治疗真菌性角膜炎的新型药物。但SAN在真菌性角膜炎中的具体抗炎机制还需要进一步研究。