慢性冷热应激对繁殖母牛血清指标的影响
施 安, 王建东 , 侯鹏霞, 陈志龙, 孙文阳, 梁小军, 王瑞刚, 姜 武
(1.宁夏农林科学院动物科学研究所,宁夏银川 750002;2.宁夏农林科学院固原分院,宁夏固原 756099;3.宁夏犇旺生态农业有限公司,宁夏永宁 750100)
宁夏属典型的温带大陆性气候, 冬夏两季气候迥异, 冬季严寒夏季酷暑, 冬夏温差最高可达32 ℃左右,秋冬交节之际,昼夜温差可达17 ℃左右(姜鑫等,2021)。宁夏冬夏交替的气候特征容易引发反刍动物的慢性冷热应激症, 较大的温差导致机体长时间处于高温或低温环境, 机体已经暂时适应环境之后的冷热应激状态(Cui 等,2016),尤其是繁殖母牛受到冷热应激所产生的一系列非特异性反应使母牛产生应激综合征, 从而导致繁殖功能障碍等 (Hagiya 等,2017;Wheelock 等,2010)。受冷热应激的自适应代谢损失给肉牛养殖带来巨大的经济损失, 是潜在的风险管控重点。通常将温湿指数(THI)作为评价动物冷热应激状态的重要参考指标,THI 不同的阈值范围代表冷热应激程度, 其中38≤THI≤72 为舒适区间,72≤THI≤78 为轻度热应激,78≤THI≤89 为中度热应激,THI >89 为重度热应激;25≤THI≤38为轻度冷应激,8≤THI≤25 为中度冷应激,THI <8 为重度冷应激。 目前关于宁夏地区反刍动物冷热应激研究多集中在奶牛方面, 鲜有繁殖母牛冷热应激的相关研究。 因此本试验以宁夏地区规模化肉牛养殖场的全年THI 监测数据为参考依据,研究慢性冷热应激对繁殖母牛的生理生化以及繁殖激素的动态调节规律, 筛选出判别冷热应激的关键指示物, 为集约化条件下母牛生产环境的精准控制提供理论和数据支撑。
1 材料与方法
1.1 试验动物和样品采集 试验在宁夏银川市犇旺生态养殖公司进行, 采用单因素水平试验设计,选择体重[(680±58)kg]和胎次[(1 ~3)胎]相近的繁殖母牛10 头为试验动物, 参考肉牛饲养标准 (NY/T 815-2004) 保证试验组的全混合日粮(TMR)营养水平一致,自由采食和饮水,试验设对照组(秋季)、冷应激组(冬季)和热应激组(夏季)3个阶段进行。
1.2 试验设计 选择肉牛场生产区的西边和东边为测定点, 距地面1.8 m 窗台处放置温湿仪GPS-600(浙江精创科技有限公司),选取放置点有效通风,防止阳光直接照射和雨淋,并避免母牛触及。 每3 h 自动记录温度和湿度, 计算THI。THI=0.8×AT(温度)+[RH(湿度)×(AT-14.4)]+46.4(McDowell 等,1976)。
1.3 指标测定 参照牛场THI 动态监测结果,分别把秋季、冬季和夏季的极端THI 数值依次作为对照组、冷应激组和热应激组的对应采样时间,从尾根部采集血样并分离血清保存。
1.3.1 血清生化指标 用比色法试剂盒(中生北控股份有限公司) 测定总蛋白 (TP)、 白蛋白(ALB、)球蛋白(GLB)、尿素氮(BUN)、葡萄糖(GLU)和甘油三酯(TG)。
1.3.2 血清免疫指标 用比色法试剂盒(中生北控股份有限公司)测定免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM);酶免法(北京华英生物技术公司)测定白细胞介素-2(IL-2)白细胞介素-4(IL-4)。
1.3.3 抗氧化能力指标 用酶免法(北京华英生物技术公司)测定总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、丙二醛(MDA)和谷胱甘肽过氧化物酶(GSH-PX)。
1.3.4 繁殖相关激素指标 用放免法测定雌二醇(E2)、孕酮(P)、三碘甲状腺原氨酸(T3)、甲状腺素(T4)。
1.4 统计分析 所有数据均采用Excel 软件进行处理, 使用SPSS 软件进行ANOVA 方差分析和Duncan 多重比较。
2 结果与分析
2.1 全年THI 指数测定结果 根据THI 指数全年监测结果发现(图1),牛场在夏季六、七、八月份属于轻度热应激(72≤THI≤78);冬季一、二月份属于轻度冷应激(25≤THI≤38),其余月份处于舒适区(38≤THI≤72)。 其中,一月份THI 指数最低,七月份THI 指数最高, 十月份最接近全年THI 平均值, 分别对应冷应激组 (THI=31.68), 热应激组(THI=75.22)和对照组(THI=53.78)3 个试验期。

图1 全年温湿度指数THI 动态监测曲线图
2.2 血清生化指标检测结果 由表1 可知,冷应激组的各项生化指标最高,除TG 外,均呈现冷应激组>对照组>热应激组的规律, 冷应激组的TP、ALB 和TG 相比热应激组分别提高了79.28%(P <0.01)、62.63%(P <0.01)和516.67%(P <0.01),其中BUN 冷应激组比对照组提高了34.28%(P <0.01); 对照组比热应激组提高了159.63%(P <0.01),GLB 和GLU 差异不显著(P >0.05)。
2.3 血清免疫指标测定结果 由表2 可知,IL-2热应激组比对照组提高了15.75%(P <0.01)、对照组比冷应激组提高了34.20%(P <0.01), 其他指标均呈现冷应激组>对照组>热应激组的规律,其中IgG、IgM、IL-4 和IgA 冷应激组比热应激组分别提高了50.40% (P < 0.01)、36.52% (P <0.01)、21.36%(P <0.01)和19.48%(P <0.05)。
2.4 血清抗氧化指标测定 由表3 可知,冷应激组的MDA 比对照组和热应激组分别降低了51.72%(P <0.01) 和47.34%(P <0.01),SOD、TAOC 和GSH-PX均呈现冷应激组>对照组>热应激组的规律, 且冷应激组相比热应激组分别提高了116.64% (P < 0.01)、58.38% (P < 0.01) 和38.33%(P <0.01)。
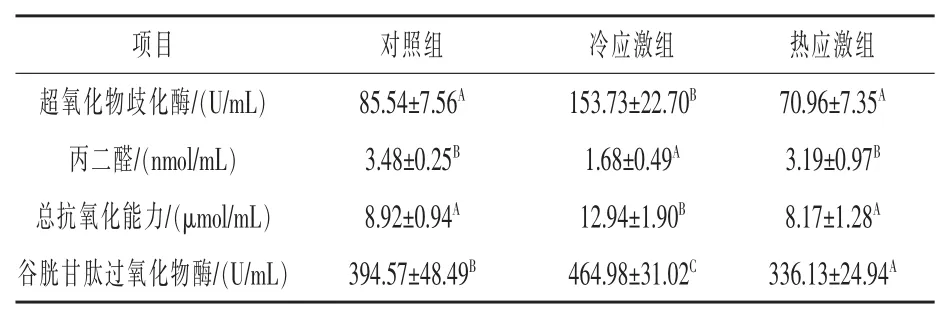
表3 血清抗氧化指标测定结果
2.5 血清内分泌激素测定 由表4 可知,冷应激组E2 比热应激组提高了89.23%(P <0.01);P 组间差异均极显著,冷应激组比热应激组提高了118.51%(P <0.01),热应激组比对照组又提高了136.38%(P <0.01);T3 和T4 各组间差异不显著(P >0.05)。
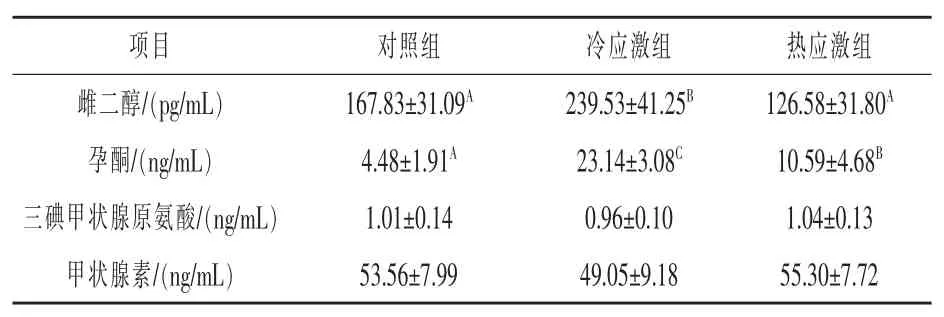
表4 血清内分泌激素测定结果
3 讨论
3.1 冷热应激对生化指标的影响 动物生化水平是反映健康状况和营养水平的重要指标(张建刚等,2012), 动物在环境应激胁迫下发生免疫应答,通过糖、能量和蛋白质三大代谢物质再分配以维持机体内环境稳定 (Srikandakumar 等,2004)。在冷热应激条件下, 由于动物采食量发生变化导致营养摄入不均直接影响生化指标的差异。 热应激时,繁殖母牛营养摄入水平降低,免疫与代谢功能弱化,而总蛋白(TP)含量是免疫力和代谢水平(高艳霞等,2014) 的准确反映,TP 含量也因此降低, 其中ALB 和GLB 是组成总蛋白的2 个关键蛋白,前者调节细胞渗透压后者参与免疫代谢,所以ALB 和GLB 含量也都呈现下降的趋势。 而冷应激时这3 个指标随着繁殖母牛采食量的升高而升高。 这就解释了试验中冷应激的TP、ALB 和GLB 极显著或显著高于热应激组的变化趋势(P <0.01)。 其次,繁殖母牛处于严重热应激时,动物无法通过糖、脂肪代谢满足能量需要,只能加速蛋白质分解代谢来维持机体稳态, 表现为TP 的降低。 尿素氮(BUN)含量可以反映繁殖母牛氨基酸平衡和蛋白质代谢状态(赵拴平等,2012),当母牛需要分解蛋白质来维持能量需要时, 相应的BUN 含量降低,试验中热应激组极显著低于对照组和冷应激组(P <0.01)也印证了这一结论。GLU含量是衡量肝脏功能的一个重要指标 (王兰等,2007), 试验中不同应激条件下差异不显著 (P >0.05),这与马毅(2020)不同季节GLU 无显著变化的研究结果一致, 但试验组表现为冷应激组>对照组>热应激组,说明当母牛营养摄入不足时,能量出现负平衡,糖代谢异常增加葡萄糖分解,表现为葡萄糖浓度降低(O’brien 等,2010)。 甘油三酯(TG)是血脂的主要成分,起到供给与储存能源的作用 (马毅等,2020)。 试验中冷应激组的TG含量显著高于对照组和热应激组(P <0.05),说明母牛处于热应激时, 不仅采食量下降摄入的脂肪类物质降低, 还会引起干物质分化受阻导致脂肪吸收率降低, 其次当体内营养偏低时会分解储存的甘油三酯供能,因此甘油三酯含量便会下降(冯亚杰等,2016)。
3.2 冷热应激对免疫指标的影响 免疫球蛋白是评估动物免疫状况的重要指标, 主要包括免疫球蛋白A(IgA)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM),其中IgA 是机体黏膜防御感染的主要物质,可以与周围细胞组成局部免疫系统(高锦萍等,2006);IgG 参与机体免疫防御反应,是血清免疫球蛋白的主要成分; IgM 是特异性免疫反应早期抗体(刘庆华,2009)。试验中IgG 和IgM 在冷应激组的含量极显著高于热应激组(P <0.01),IgA显著高于热应激组(P <0.05),有研究表明热应激可显著降低奶牛血清中IgA、IgG、IgM 含量(Safa等,2019;Schmautz 等,2018), 表明繁殖母牛在热应激时, 高温导致其机体的免疫组织和功能受到抑制,损害了体液免疫(彭孝坤等,2019;张灿等,2017)。但冷应激时IgG 和IgM 与对照组的差异不显著(P >0.05),说明肉牛对环境温度具有低温适应性强但高温耐受性差的特点 (湖南科技报,2020),所以低温对繁殖母牛的免疫功能损伤远低于高温的影响,因此要重视“三伏天”对肉牛严重的应激反应。 白细胞介素-2(IL-2)能促进T 细胞增殖分化和活性,间接反映机体免疫应答水平(李倜宇,2018);白细胞介素-4(IL-4)可诱导B 细胞成熟并刺激其产生免疫球蛋白, 主要以调节体液免疫为主(蔡明成,2014)。 试验中IL-2 在热应激组极显著高于冷应激组, 而IL-4 极显著变低。Sahin(2017)和Chance(1979)研究表明,热应激能抑制牛的免疫调节水平,表现为IL-2 升高和IL-4 降低,本试验结果与上述结果一致。
3.3 冷热应激对抗氧化指标的影响 动物正常代谢过程中会产生自由基, 其氧化不饱和脂类形成丙二醛(MDA),对哺乳动物细胞有诱变作用,MDA 含量越多对细胞膜的侵蚀作用也越大。而酶促体系就是机体主要的抗氧化防疫机制, 包括SOD、T-AOC 和GSH-Px(陈雯雯等,2012a;崔恒敏等,2003) 。 当动物遭受应激时,酶促体系的抗氧化水平被打破, 此时机体需要大量的抗氧化酶来消除自由基, 表现为SOD、T-AOC 和GSH-Px的活性数量变多,抑制MDA 升高。 试验中冷应激组SOD、T-AOC 和GSH-Px 极显著高于热应激组(P <0.01),而MDA 反之降低(P <0.01)。 胡煜等(2016)发现热应激时肉牛SOD、T-AOC 和GSHPx 有不同程度降低,而MDA 升高;同时肉牛在冷应激时有相反的变化趋势(么蕊,2021),本试验结果与其一致。 由于热应激导致动物体内氧循环代谢紊乱进而诱导自由基激增, 抗氧化酶系统平衡因此被打破, 应激状态下消耗的抗氧化酶多于新生成的,导致MDA 含量同样显著升高,试验中冷应激组的MDA 极显著低于热应激组, 表明繁殖母牛在冷应激中的抗氧化性较好, 热应激对自身造成了一定的氧化损伤,邓发清(2008)和陈雯雯(2012)对奶牛的报道中也证明了上述观点,进一步证实了肉牛耐寒不耐热的特性。
3.4 冷热应激对内分泌激素的影响 三碘甲状腺原氨酸(T3)和甲状腺素(T4)同属甲状腺素成员, 对动物的体温调节起着重要作用。 本试验中T3 和T4 在不同应激状态下的差异不显著 (P >0.05),但3 个试验组均表现为热应激组>对照组>冷应激组,说明热应激使下丘脑-垂体-甲状腺轴(HPT)受阻,导致促甲状腺激素(TSH)合成减少,甲状腺功能减退,T3 和T4 合成量减少,动物自适应调节体温以减缓热应激刺激。 冷应激则激活下丘脑-垂体-甲状腺(HPT)轴,TSH 合成增加,促进T3 和T4 分泌,提高肝糖原合成,促进动物产热提高对低温天气适应性(白丹丹,2017)。这与朱建营(2016)的研究结果也一致。 雌二醇(E2)主要由卵巢的卵泡细胞所分泌,生物活性最强,也是雌激素的重要参考指标(杨莹等,2017)。 孕酮(P)是动物自身调节的雌性激素,其主要由卵巢分泌,与雌二醇激素公共维持雌性动物的生殖周期, 促使乳腺发育成熟的作用(龙凤宜等,2006)。本试验中冷应激组的E2 和P 均极显著高于对照组和热应激组(P <0.01), 说明高温抑制了下丘脑-垂体-性腺轴的反应,使垂体促性腺激素(FSH、LH)的分泌受到抑制, 同时使雌激素的分泌下降并抑制雌二醇的生成和孕酮的分泌。 而在低温环境下机体自适应调节促进了性腺轴的分泌代谢,E2 和P 激素也随之升高。
通过对极端环境条件下繁殖母牛的生化、免疫、抗氧化和激素指标监测,结果分析发现4 种生理生化参数中BUN、IL-2、GSH-Px 和P 指标在正常组、冷应激组和热应激组之间均差异极显著(P <0.01),且与对照组相比,冷应激组和热应激组相差最多的是P,分别为416.52%和136.38%,说明孕酮对冷热环境的变化最敏感, 可作为判别繁殖母牛冷热应激反应的潜在指示物, 用于早期监测母牛的应激程度, 降低冷热应激对繁殖性能造成的不利影响。
4 结论
冷热应激均能影响母牛的营养代谢和繁殖性能,热应激对母牛生理生化参数的影响更大,而孕酮可作为判别繁殖母牛冷热应激反应指示物,用于早期监测母牛的应激程度。

