219份茶树资源1,2,6-三没食子酰葡萄糖变异分析
荀涵硕,王留彬,张 睿,王丽鸳,韦 康
中国农业科学院 茶叶研究所,浙江 杭州 310008
水解单宁1,2,6-三没食子酰葡萄糖(1,2,6-tri-O-galloyl-β-D-glucopyranose,1,2,6-TGGP)是一种多酚化合物,具有抗菌、消炎、抗氧化等作用[1-2]。然而目前对多酚类物质的研究主要集中在儿茶素类物质上,对1,2,6-TGGP的关注较少。茶是世界最受欢迎的饮料之一[3],具有多种保健(药理)功能[4]。茶叶中富含多酚类化合物,研究人员已从茶树中鉴定到1,2,6-TGGP,但是茶叶中关于1,2,6-TGGP含量变异范围的研究报道非常少。Zhang等[5]通过高效液相色谱结合二极管阵列和质谱检测了16个茶样(6个绿茶、6个乌龙茶和4个白茶),结果发现茶叶中1,2,6-TGGP含量非常低,在0~6.6 mg/g。Song等[6]通过高效液相色谱结合二极管阵列和质谱对13批龙井绿茶进行分析,也得到了类似的结果。Wei等[2]对17个茶树品种进行1,2,6-TGGP含量测定,发现其变化范围为1.96~43.20 mg/g。李强等[7]对‘中黄1号’‘中黄2号’‘白鸡冠’与‘中白1号’进行1,2,6-TGGP含量测定,结果发现含量在0~0.24 mg/g。
茶树种质资源是茶树种质创新及品种遗传改良的基础[8-9]。目前对茶树资源的分析多集中在水浸出物、儿茶素、氨基酸、咖啡碱等成分,尚无对1,2,6-TGGP优异资源鉴定与筛选的研究报道。本研究拟对219份茶树资源进行1,2,6-TGGP含量测定,分析其变异特性并探寻其与儿茶素类物质的相关性,从而筛选出高1,2,6-TGGP优异茶树资源,以期为高1,2,6-TGGP茶树新品种选育及其形成机理研究提供一定的理论依据。
1 材料与方法
1.1 试验材料
以53份种植于中国农业科学院茶叶研究所茶园(N 30°19′、E 120°10′)的茶树资源、166份种植于浙江省嵊州市中茶所嵊州实验基地(N 30°15′、E 121°22′)的茶树资源为材料。2019年、2020年和2021年3月在不同地块采摘试验茶树资源一芽二叶鲜叶样。具体样品名称见表1。其中编号1~21是杭州2019年样品,22~32是杭州2020年样品,33~53是杭州2021年样品;编号54~110是嵊州2019年样品,111~152是嵊州2020年样品,153~219是嵊州2021年样品。共计219份。

表1 219份茶树资源名称Table 1 The names of the 219 tea germplasms
1.2 主要仪器和试剂
仪器:Waters HPLC,Phenomenex色谱柱(Synergi 4 μ Polar-RP 80A, 4.6 mm×250 mm,5 μm);UV-2550紫外可见分光光度计(日本Shimadzu公司);Waters alliance 2695-2498高效液相色谱仪(美国Waters公司)。
试剂:甲醇、乙腈、甲酸(杭州硕科仪器设备有限公司),均为色谱纯级;1,2,6-TGGP,由上海源叶生物科技有限公司提取;没食子酸(GA)、没食子儿茶素(GC)、表没食子儿茶素(EGC)、儿茶素(C)、表儿茶素(EC)、表没食子儿茶素没食子酸酯(EGCG)、没食子儿茶素没食子酸酯(GCG)、表儿茶素没食子酸酯(ECG),上海源叶生物科技有限公司;抗坏血酸、EDTA(Disodiumethylendiaminetetrac etate,乙二胺四乙酸)钠盐。
1.3 方法
1.3.1 标准曲线绘制
分别精密称取1,2,6-TGGP、GA、GC、EGC、C、EC、EGCG、GCG、ECG标准品2.000 mg置于10 mL离心管中,加入70%甲醇(色谱纯级)溶液2 mL超声溶解,配成1 000 μg/mL的母液,再用70%甲醇溶液将对照品母液稀释成系列梯度浓度的标准溶液,绘制标准曲线。利用标准曲线对各代谢物进行定量。
1.3.2 HPLC检测
流动相A为1%甲酸水溶液,流动相B为100%乙腈。流速为1 mL/min,检测波长280 nm,柱温40℃,进样量10 μL。梯度洗脱程序详见表2。
1.3.3 样品制备
于2019、2020、2021年春季按一芽二叶的标准采摘鲜叶原料,置于电热式碧螺春烘干机中120℃烘30 min左右,烘干至恒重。
1.3.4 茶多酚提取与鉴定
多酚类物质提取和鉴定在课题组前期建立的方法上略有改进:取茶样0.1 g(0.999~0.100 3 g)精密称定,置于10 mL离心管中,准确加70%甲醇溶液5 mL,于70℃水浴锅水浴浸提20 min(每隔5 min上下摇动一次),待冷却至室温后转入离心机(3500 r/min,10 min)。吸取0.5 mL上清液至5 mL离心管中,加2 mL稳定液(10 mg/mL EDTA-Na 2、10 mg/mL抗坏血酸、纯乙腈、超纯水的质量比或体积比为1∶1∶2∶16混匀,使用0.45 μm有机微孔滤膜过滤,取滤液到进样瓶中,放至HPLC仪器中进行1,2,6-TGGP鉴定与含量测定。
1.3.5 数据处理
数据采用Excel 2108软件进行整理,数据统计采用SPSS 24数据统计分析软件进行统计分析。变异系数的计算公式为:变异系数=标准差/均值。
2 结果与分析
2.1 儿茶素组分含量
1,2,6-TGGP(峰9)含量的鉴定情况见图1,1,2,6-TGGP含量较高(> 5.00 mg/g)的茶树资源儿茶素组分及1,2,6-TGGP的具体含量测定结果见表3。

图1 茶叶中主要成分液相色谱图Figure 1 High performance liquid chromatogram of the main components in tea

表3 1,2,6-TGGP含量较高的茶树资源儿茶素及1,2,6-TGGP含量Table 3 Catechin and 1,2,6-TGGP content of tea germplasms with high content of 1,2,6-TGGP mg/g
对219份茶树资源9个组分含量进行统计分析(表4)后发现,1,2,6-TGGP含量为0.34~53.63 mg/g,平均为9.53 mg/g;GA含量为0.16~1.32 mg/g,平均为0.48 mg/g;GC含量为0.46~7.88 mg/g,平均为2.00 mg/g;EGC含量为3.03~27.41 mg/g,平均为12.36 mg/g;C含量为0.47~22.72 mg/g,平均为2.16 mg/g;EC含量为2.96~13.86 mg/g,平均为7.07 mg/g;EGCG含量为12.25~114.10 mg/g,平均为67.39 mg/g;GCG含量为0.29~4.50 mg/g,平均为1.80 mg/g;ECG含量为3.46~53.87 mg/g,平均为25.24 mg/g。219份茶树资源中9个成分变异系数从大到小排序为1,2,6-TGGP、C、GC、GA、GCG、EGC、ECG、EC、EGCG;变异系数最大的是1,2,6-TGGP,为101.45%。以上结果表明,219份茶树资源表现出丰富的遗传多样性。
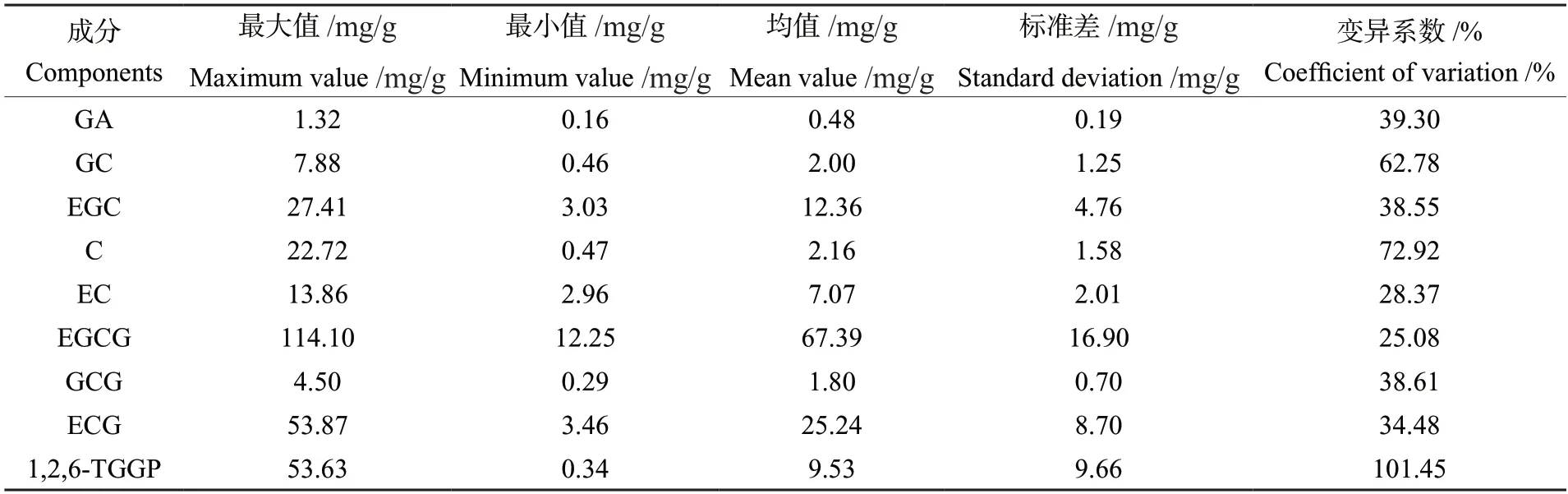
表4 219份茶树资源9个组分含量统计Table 4 Content statistics of 9 components in 219 tea germplasms
对219份茶树资源1,2,6-TGGP含量的分布进行分析(图2)可以看到,1,2,6-TGGP含量低于1%的资源材料最多,有149份,占比68.03%;1%~3%的有57份,占比26.03%;高于3%的最少,有13份材料,分别是‘中茗6号’(5.36%)、‘中茗6号’(4.92%)、‘恩施5号’(4.20%)、‘中茗6号’(4.11%)、‘4201’(4.02%)、‘ESN-5’(4.02%)、‘中茗6号’(3.82%)、‘中茗66号’(3.57%)、‘1118’(3.41%)、‘Z9’(3.30%)、‘4511’(3.23%)、‘ESN-8’(3.21%)和‘0401’(3.12%),占比5.94%。其中1,2,6-TGGP含量最高的‘中茗6号’在不同年份、不同地点均有较高含量,说明该品种受环境影响较小。
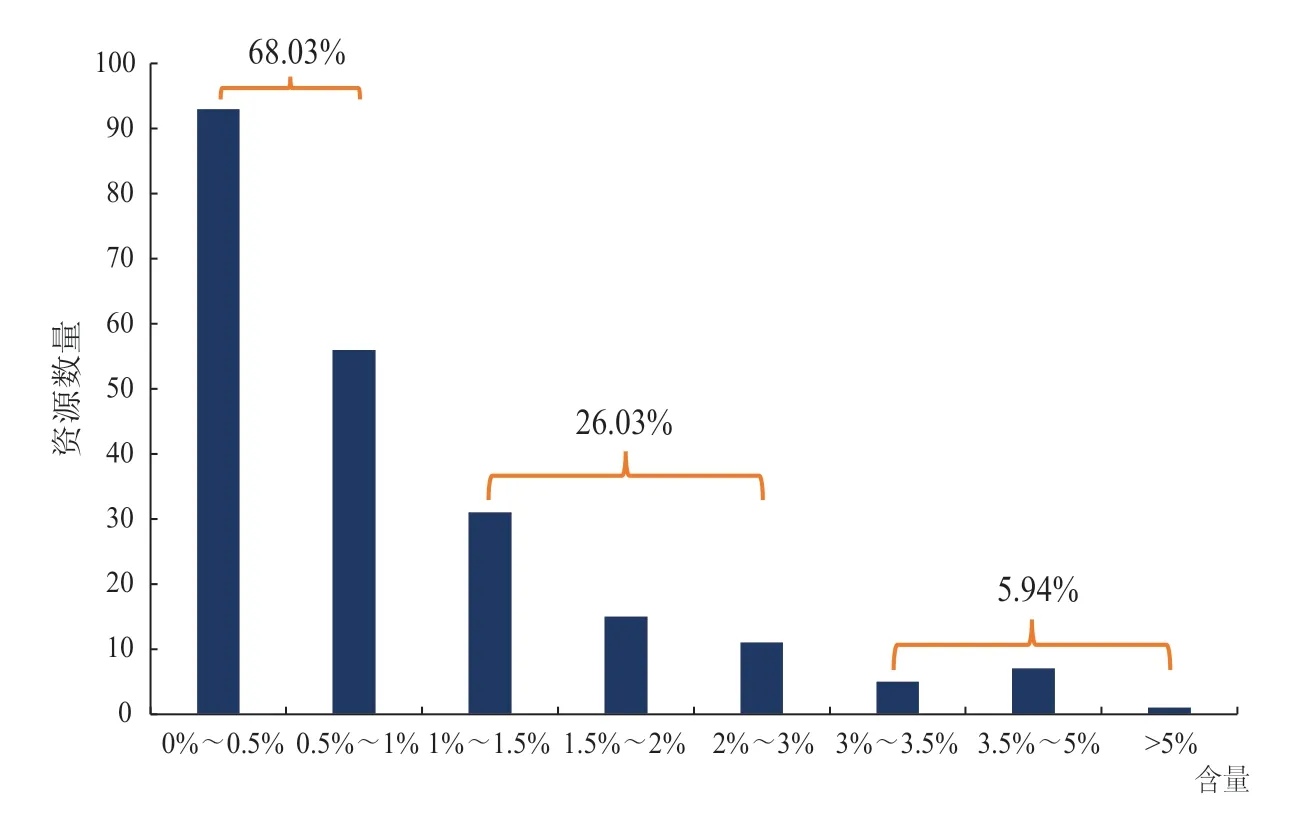
图2 219份茶树资源的1,2,6-TGGP含量分布Figure 2 Distribution of 1,2,6-TGGP content in 219 tea germplasms
2.2 儿茶素各组分的相关性
对219份茶树资源的9个组分进行相关性分析结果(表5)可看出,9个组分中有2/3的组分间存在显著性的相关关系。除GC外,EC与所有的组分存在显著性的相关关系,其中与EGC、C、EGCG、GCG、ECG呈极显著正相关,与GA、1,2,6-TGGP呈极显著负相关。除C外,1,2,6-TGGP也与所有的组分存在显著性的相关关系,其中与GA、EGCG、ECG呈极显著正相关,与GC、GCG呈显著正相关,与EGC、EC呈极显著负相关。1,2,6-TGGP与GA呈极显著正相关,结果与Wei等[2]研究结果一致。
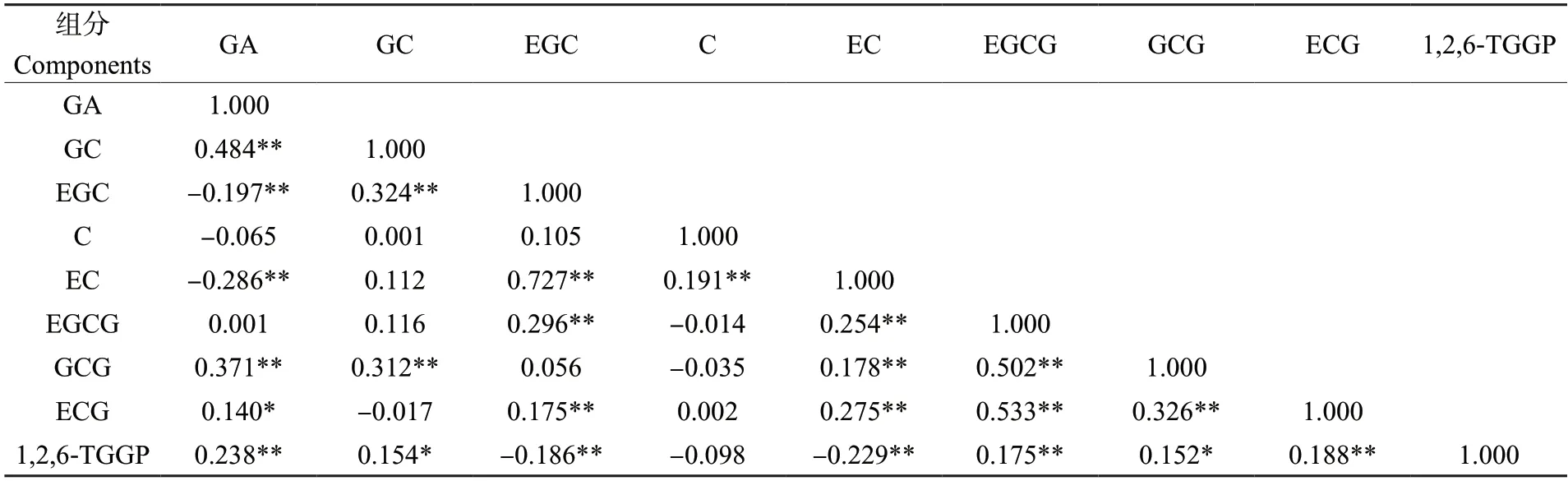
表5 219份茶树资源生化成分含量相关性分析Table 5 Correlation analysis of the content of biochemical components in 219 tea germplasms
3 讨论
茶多酚是茶树中酚类物质及其衍生物的总称。茶多酚包括儿茶素(黄烷醇类),黄酮、黄酮醇类,花青素、花白素类,酚酸及缩酚酸等,是茶叶的重要品质成分和构成茶汤滋味的主要物质[10]。目前大多数研究主要围绕儿茶素类物质,很少有酚酸衍生物的报道。1,2,6-TGGP作为酚酸衍生物的一种,具有抗菌、消炎等作用。本研究测定了219份浙江杭州和嵊州茶树资源中儿茶素和1,2,6-TGGP含量并对其进行了含量变异分析,结果发现9个组分的变异系数从大到小依次为1,2,6-TGGP、C、GC、GA、GCG、EGC、ECG、EC、EGCG,表明1,2,6-TGGP有巨大改良潜力。进而分析了1,2,6-TGGP的含量分布情况,从中筛选出13份高含量茶树资源。最后分析了1,2,6-TGGP与儿茶素的相关性,发现与其呈极显著正相关的GA、EGCG、ECG和呈极显著负相的EGC、EC。
前期研究表明,1,2,6-TGGP是UDP葡萄糖和没食子酸经过一系列严格位置的没食子酰基化步骤合成的。具体过程为UDP葡萄糖先与第一个没食子酸反应合成葡萄糖没食子鞣甙(β-glucogallin),后者再与第二个没食子酸反应合成1,6-二醛酰葡萄糖(1,6-digalloylglucose),1,6-二醛酰葡萄糖再与第三个没食子酸反应合成1,2,6-TGGP[11]。本研究发现1,2,6-TGGP与没食子酸有极显著的相关关系,这与李强等[7]的研究结果一致。有趣的是,EGC和EC都与1,2,6-TGGP呈极显著负相关,EGCG和ECG均与1,2,6-TGGP呈极显著正相关,EGC和EC经过酰基化后可形成EGCG和ECG,而1,2,6-TGGP中存在三个酰基,可能可以充当酰基供体。初步推测这5种物质间可能存在某种相关性关系。可能的过程是1,2,6-TGGP给EGC提供没食子酰基生成EGCG,给EC提供没食子酰基生成ECG。但具体的反应过程需要进行深入研究。
综上,我们筛选到富含1,2,6-TGGP的优异茶树种质资源并且对1,2,6-TGGP的变异范围、与儿茶素的相关性有了较为清晰的认识,这为后期1,2,6-TGGP合成机理研究及品种选育奠定了一定的基础。

