MOFs的制备及其载药性能初步评价
葛健文,陈浩,杨可欣,朱倩钰,曹高洁,徐青清,秦贵琳,牟伊,季鹏
(泰州学院 医药与化学化工学院,江苏 泰州 225300)
金属有机骨架(Metal-Organic Frameworks,MOFs)是由有机配体与金属离子通过配位作用形成的结晶性、多孔性固体材料,具有周期性网络结构[1-2]。Robson在1989年首次发现MOFs,在此之后研究人员对其开展了一系列研究,目前MOFs应用广泛,包括药物递送、气体分离和吸附、催化、传感等多个领域。MOFs的合成需要仔细考虑几个关键因素如pH值、温度、溶剂和添加剂,因为它们主要影响连接剂的溶解度、扩散速率和连接剂去质子化的程度[3]。因此,合成条件的改变会极大地影响金属的配位性、反应速度以及产物质量。常见的几种MOFs的合成方法有水热/溶剂热合成法、微波辅助合成法、机械化学合成法和喷雾干燥合成法等[4]。
青蒿琥酯(Artesunate,AS)是青蒿素的半合成水溶性衍生物,它从传统中药青蒿中被提取,最初用于临床治疗疟疾。AS表现出较强的抗肿瘤活性[5],但因其本身的生物利用度低,在临床上受到一定的限制。与原始药相比,可以携带药物的药物载体,在维持原本药理活性的基础上,不仅能降低或消除原始药的毒副作用、改善药物的传递效果,同时可以提高药物的生物利用度。因此,研发一种生物相容性好、安全性高且可降解的药物载体就显得尤其重要。因为MOFs具有良好的孔隙结构和过高的孔隙率,同时在装载多种药物方面有较高的利用性,所以选其作为药物载体[6]。目前,含有二价铁的MOFs比较少,从这方面考虑,选用二价铁作为金属中心,氨基对苯二甲酸作为有机配体,通过溶剂热合成法制得MOFs。随后将AS载入MOFs中,在单因素考察的基础上,从而评价MOFs的载药性能。最后将制得的AS@MOFs进行体外释放实验和溶血实验,考察其是否具有pH响应性的降解特性和良好的生物相容性,从而评价MOFs载药后的理化性质。
1 材料
1.1 主要仪器
FA2004型电子天平购自上海良平仪器仪表有限公司(中国上海);pHS-3C型pH计购自上海仪电科学仪器股份有限公司(中国上海);TDL-80-2B型台式低速离心机购自上海安亭科学仪器厂(中国上海);DHG-9070A型电热鼓风干燥箱购自上海一恒科学仪器有限公司(中国上海);HWCL-3型集热式恒温磁力搅拌浴购自郑州长城科工贸有限公司(中国郑州);KQ-500DB型数控超声仪购自昆山市超声仪器有限公司(昆山);UV-1200型紫外-可见分光光度计购自上海美谱达仪器有限公司(中国上海);RE3000A型旋蒸仪购自上海亚荣生化仪器厂(中国上海)。
1.2 主要药品与试剂
N,N-二甲基甲酰胺(DMF,批号C12749151)购自上海麦克林生化科技有限公司;2-氨基对苯二甲酸(2-NH2-BDC,批号C12066283,纯度98%)购自上海麦克林生化科技有限公司;乙酸亚铁四水合物(Acetate tetrahydrate,批号C11956657,纯度95%)购自上海麦克林生化科技有限公司;青蒿琥酯(AS,批号C10692323)购自上海麦克林生化科技有限公司;二甲基亚砜(DMSO,批号20191228)购自上海麦克林生化科技有限公司;无水乙醇(Ethanol absolute,批号20201029)购自中国医药集团有限公司;PBS购自中国医药集团有限公司;其余试剂为实验室常用规格,水为去离子水。
2 方法与结果
2.1 MOFs的合成
采用N,N-二甲基甲酰胺(DMF)为溶剂的溶剂热合成法,同时在醋酸存在的条件下,使用氨基对苯二甲酸(NH2-BDC)就不会出现副产物,从而实现合成MOFs的目的。具体方法如下:取0.5 g FeAc2溶于5 mL水中得到溶液A,称取0.45 g NH2-BDC溶于15 mL DMF中得到溶液B。用玻璃棒搅动溶液B的同时将溶液A缓缓滴入,随后在100 ℃条件下反应1 h,反应完毕后将反应液冷却至室温,然后离心(3 500 r/min,30 min)除去上清液,用DMF洗2次。接着用无水乙醇涡旋充分洗涤2次并离心(3 500 r/min,15 min),最终得到MOFs。
2.2 AS@MOFs的合成
称取适量的AS、MOFs分别加入20 mL无水乙醇中,然后将两个溶液混合,将其用超声充分混合。随后,在室温下继续恒定搅拌一定时间,使AS与MOFs混合更加充分,然后将混合溶液放置于旋蒸仪进行旋蒸至无溶液。最后用无水乙醇洗涤产物3次,离心(3 500 r/min,15 min),得到产物AS@MOFs。
2.3 MOFs纳米粒载药性能评价
2.3.1 测定方法
准确称量AS(10.0 mg)到容量瓶(10 mL)中,加入5%碳酸氢钠溶液到标记处,摇匀,得到备用溶液(1 000 μg/mL)。然后,用2%NaOH-无水乙醇混合溶液稀释至不同浓度(10,20,30,40,80,120和200 μg/mL),在60 ℃下水解30 min,冷却形成结构稳定的衍生物(λ=290 nm)。以2% NaOH-无水乙醇混合溶液为空白对照,采用紫外-可见分光光度计对不同样品的吸光度进行测定。
将二甲基亚砜(DMSO)与乙醇混合制得30%乙醇-DMSO混合溶液并从混合液中取5.2 mL,精确称量AS@MOFs 2.1 mg放于该混合液中,随后在超声的作用下使其充分溶解。溶解完全后使混合液在针式过滤器中通过孔径为0.45 μm的微孔滤膜。再利用紫外可见分光光度计在290 nm波长处测定其吸光度,然后利用标准曲线求出AS的含量,最后计算AS@MOFs的载药量。载药量(%)=We/Wm×100%;式中We表示AS@MOFs复合物中AS的质量,Wm表示称取的AS@MOFs的总质量。
2.3.2 结果与分析
2.3.2.1 AS标准曲线
为计算AS@MOFs中青蒿琥酯的载药量,精准绘制青蒿琥酯标准曲线:y=0.003 2x-0.005,R2=0.999 1 (y:290 nm处的吸光度值;x:AS浓度)。如图1所示,在5~200 μg/mL范围内青蒿琥酯溶液具有很好的线性关系。
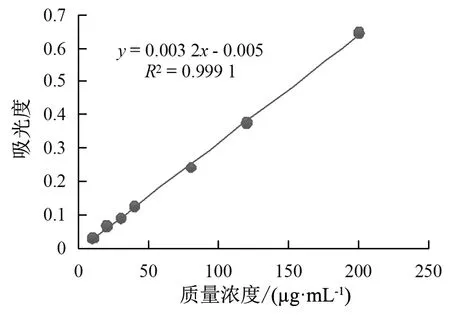
图1 青蒿琥酯标准曲线图
2.3.2.2 MOFs的载药影响因素
1)MOFs和AS比例的影响:将制备AS@MOFs的实验条件固定,选用AS和MOFs质量比分别为2∶2,3∶2,4∶2,5∶2,然后将制备好的AS@MOFs用紫外分光光度法,通过吸光度进行载药量的测定,可得出AS和MOFs质量比的改变对载药量的影响,结果如图2所示。

图2 AS和MOFs比例对载药量的影响
从图2可以看出,药物载药量先增大后降低,在AS与MOFs的质量比为4∶2时,载药量最大。在此之后,增加AS的比例并不能增加药物的载药量,这是由于MOFs的载药量逐渐达到饱和的原因。
2)反应温度的影响:将制备AS@MOFs的实验条件固定,确定AS和MOFs质量比为4∶2。在25,55,75 ℃时,对不同反应温度下的载药量进行了测定,结果如图3所示。药物载药量先增大后降低,过高的反应温度会使MOFs的载药量下降,55 ℃时MOFs的载药量最高。超声会促进AS渗透进入MOFs孔道里,但是相关研究表示AS较优水解温度是83 ℃,所以过高温度可能会使AS水解。
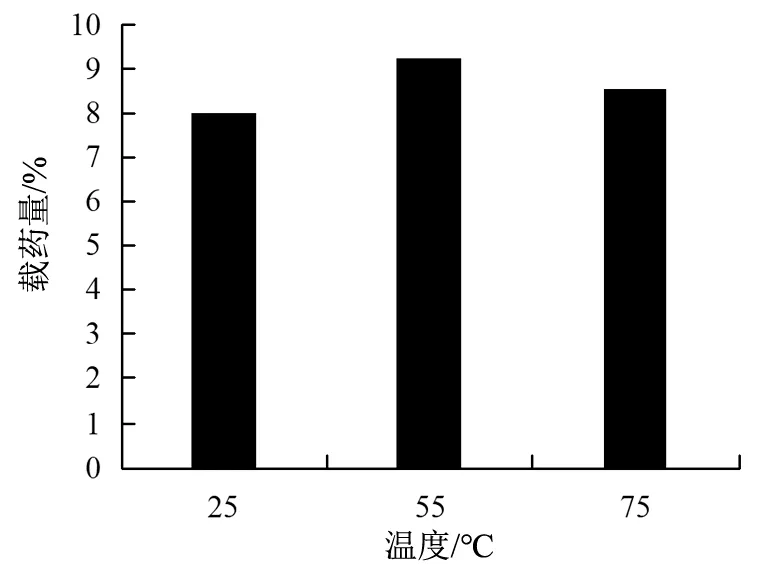
图3 反应温度对载药量的影响
3)搅拌时间的影响:将制备MOFs@AS的实验条件固定,确定AS和MOFs质量比为4∶2,反应温度为55 ℃。搅拌其间,分别在1,3,6,9,12 h时间点,吸取溶液并测其吸光度,查看载药量的改变,结果如图4所示。
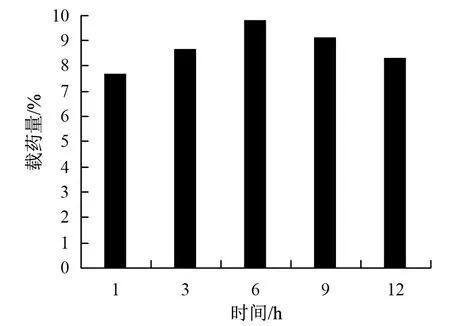
图4 搅拌时间对载药量的影响
随着载药时间的增长,MOFs的载药能力也随之增加,载药时间到达6 h时,载药量最大,这说明载药时间为6 h时,MOFs的载药量已经处于饱和状态,可能是由于经过6 h的作用,药物的吸附与解吸达到了平衡点,以致载药量出现最大。但是时间到达12 h时,MOFs的载药量明显降低,可能是因为长时间浸泡导致MOFs表面吸附的AS脱落。
2.4 AS@MOFs的体外释放行为
2.4.1 测定方法
以含20%乙醇、不同酸碱度为7.4,6.4和5.0的PBS为释放介质。将AS@MOFs置于相对分子质量为14 000 Da的透析袋,然后将其浸入释放介质(10 mL)中,并在37.0 ℃的黑暗中以100 r/min的搅拌速率进行释放试验。以预定的间隔(0.5,1,2,4,6,8,14,24,48 h),取出等份试品(0.4 mL),然后在0.45 μm微孔滤膜滤过,同一时间补充相同体积的新鲜PBS。之后,滤液被30%乙醇-DMSO混合溶液稀释到适当浓度,通过290 nm处的紫外-可见吸收光谱测定不同孵育时间的上清液中的AS。最后,计算药物释放量,并绘制与时间的关系函数。释放量计算如下:释放量(%)=释放的AS量/负载的AS总量。
2.4.2 结果分析
AS@MOFs在不同pH值下的体外释放:MOFs是一种具有pH响应性的骨架材料,在一定酸性条件下,MOFs结构不稳定,会导致孔道崩塌,然后释放出包载的药物。因此,为了探究在酸性环境下AS@MOFs中青蒿琥酯的释放行为,对AS@MOFs的pH响应释放行为进行测试。如图5所示,该图证明AS@MOFs中青蒿琥酯的释放行为具有明显的pH响应性。在pH值5.0,6.4和7.4环境下青蒿琥酯在前4 h释放速率较快,4 h释放量分别为57.70%,38.30%,24.47%,这是由于与金属有机骨架作用力弱的青蒿琥酯脱落,并快速进入释放介质中的原因。在随后的时间释放曲线比较平缓,48 h后在pH值5.0和6.4环境下的释放量分别达到79.44%,72.54%,而在pH值7.4环境下累计释放量为51.26%,表明酸性条件下青蒿琥酯的释放效果更明显,这是因为MOFs孔道里的青蒿琥酯随着时间的延长被释放。由此可见AS@MOFs具有pH响应释放的功能,能够有针对性地释放所包载的青蒿琥酯。

图5 AS@MOFs在不同pH条件下体外释放曲线
2.5 AS@MOFs的溶血实验
2.5.1 测定方法
将新鲜鼠血通过生理盐水洗涤,并以2%(体积分数)的细胞密度重悬制得2%红细胞悬液,然后将不同浓度(0.5,1.0,2.0,5.0,10.0 mg/mL)的AS@MOFs与红细胞悬浮液混合,在37 ℃培养1 h。然后,将离心混合物(1 000 r/min,15 min)通过紫外可见分光光度计在540 nm处测定上清液的吸光度。此外,将生理盐水和蒸馏水分别与红细胞悬液在相同条件下一起孵育,用作阴性对照和阳性对照。溶血率计算如下:溶血率(%)=(As-An)/(Ap-An)×100%;在上式中,As是样品的吸光度,Ap是阳性对照品的吸光度,An是阴性对照品的吸光度。根据国际性标准ISO 10993.4规定α%溶血率小于5%,则被认为是合格的。
2.5.2 结果分析
溶血实验主要是以实验制得的生物材料对红细胞的作用,来评价该材料的溶血性能。本实验中对装载青蒿琥酯的MOFs溶血性进行初步评价。当AS@MOFs的质量浓度为0.5,1.0 mg/mL用紫外分光光度计检测得到的溶血率均小于5%,符合溶血实验要求,具体如表1所示。同时,肉眼观察到质量浓度为0.5,1.0 mg/mL的溶液上清无色澄清,表明无溶血。因此,可以认为制备出来质量浓度为0.5,1.0 mg/mL的AS@MOFs的生物相容性良好,没有明显的溶血作用,可以用于静脉注射。质量浓度大于1 mg/mL的溶血率大于5%,说明其浓度较高导致红细胞破裂。由于MOFs制备中用到了亚铁离子,而亚铁离子可以帮助人体血红蛋白运输氧气,对人体有益,但是亚铁离子容易氧化成三价铁离子,会在一定程度上影响实验的准确性。此外,MOFs的吸附能力强,会吸附溶液中的水分子等,当达到一定程度,MOFs的孔道会坍塌,释放出AS,因此也会影响实验。
3 讨论
MOFs材料因具有优异的孔道内部结构,所以其具有优良的物理化学性能[7]。本实验采用溶剂热合成法制得MILs系列的MOFs(二价铁为金属中心),由于合成MOFs的有机配体NH2-BDC在常温常压下不易溶于水,且在溶剂热条件下其溶解度会增加,这样更有利于反应的进行,为后续合成一种负载青蒿琥酯的MOFs材料AS@MOFs提供可行性。之后在MOFs与AS的比例、反应温度、搅拌时间这三方面对MOFs载药能力进行研究,发现当m(AS)∶m(MOFs)为2∶4、反应温度为55 ℃、搅拌时间为6 h时MOFs呈现优异的载药性能。药物释放实验得到的结果充分证明了AS@MOFs在体外释放评价中具有良好的缓释效果,并且在酸性环境中也具有响应行为。在酸性条件下AS@MOFs会缓慢释放其包载的青蒿琥酯,48 h后在pH值5.0,6.4,7.4环境下的释放量达到79.52%,68.39%,47.12%。可见AS@MOFs是一个很有前途的pH响应药物传递系统。溶血实验中AS@MOFs的质量浓度为0.5,1.0 mg/mL用紫外分光光度计检测溶血度均小于5%,且肉眼观察上清无色澄清,因此可以认为制备出来浓度为0.5,1.0 mg/mL的AS@MOFs具有良好的生物相容性,没有明显的溶血作用,可以作为静脉注射。
综上所述,本研究成功制备出了MOFs材料,该材料具有良好的载药性能和生物相容性。后续将继续从动物水平入手,对材料的药效学、药动学等方面进行进一步探讨。

