狂犬病疫苗效价测定改良NIH法建立及应用
吴小红,曹守春,石磊泰,王云鹏,赵丹华,李加,李玉华
(中国食品药品检定研究院虫媒病毒疫苗室,国家药品监督管理局生物制品质量研究与评价重点实验室,北京 102629)
狂犬病疫苗(以下简称“狂苗”)的效价是保证疫苗有效性的重要指标。国内外人用狂苗效价测定均采用NIH效价试验方法(NIH法)。该方法于1953年由美国国立卫生研究院(NIH)建立,1972年世界卫生组织(WHO)推荐用于狂苗的质量控制[1-2]。NIH法使用实验动物量大,不符合国际上倡导“减少、替代、优化”的“3R” 动物使用原则[3],而且实验结果易受到攻击病毒、试验动物、人员操作等多种因素影响[4]。尤其是检验结果变异范围大,NIH试验95%的可信限在25%到400%之间[5]。近10年来,国际上遵循动物实验的3R原则以及动物福利考虑,一直呼吁建立狂苗效价测定替代方法。2010年及2017年相继开展了两次狂苗效价替代方法的国际合作研究[6-8]。目前兽用狂苗效价测定采用小鼠免疫后血清抗体检测已纳入欧洲药典[9],国内兽用狂苗替代方法也有研究报道[10]。本研究开展了改良NIH(modified NIH,M-NIH)法,即单一稀释法研究。只采用一个稀释度免疫小鼠,来替代采用3个稀释度的NIH方法,大大减少了动物用量。该方法经9家企业实验室联合验证,于2018年获得国家标准批件[WS4-(ZB-001)-2018],并收入《中国药典》2020年版(三部),应用于人用狂苗的批签发,提高我国狂苗的技术监管效能。
1 材料与方法
1.1 材料
1.1.1 主要试剂氯化钠、磷酸氢二钠、磷酸二氢钾购自国药集团化学试剂有限公司。稀释液(PBS)量取0.9%磷酸二氢钾溶液75 mL、2.4%磷酸氢二钠(NaHPO4·12H2O)溶液425 mL、8.5%氯化钠溶液500 mL,混合后加水至5 000 mL,调pH值至7.2~8.0。第八批人用狂犬病疫苗效力试验用国家标准品(简称标准品),批号:250009-201108,效价6.6 IU/剂。第六批人免疫球蛋白国家标准品,批号:250011-201306,效价37.0 IU·mL-1,均来源于中国食品药品检定研究院(简称中检院)。狂犬病毒标准攻击毒CVS来源于WHO,中检院虫媒室传代保存。
1.1.2 实验动物昆明小鼠12~14 g,SPF级,不分雌雄,购自中检院实验动物资源研究所。实验动物生产许可证号:SCXK(京)2022-0002,实验动物使用许可证号:SCXK(京)2022-0014。
1.1.3 实验用狂苗生产企业申报批签发狂苗、过效期狂苗、37 ℃加速热破坏狂苗以及上市后市场抽验狂苗共计332批次。
1.2 方法
1.2.1 NIH法参照“《中国药典》2015年版(三部)通则3503”进行检测[10]。
1.2.2 M-NIH根据不同企业效价标准及疫苗装量,参照WHO《狂犬病实验技术》第四版 Modified NIH Test公式计算样品单一稀释度(D)。Lg(D)=ED50(标准品加权均值)+Lg(样品效价)-Lg(标准品效价) -Lg(装量)[12],将不同企业来源的狂苗稀释成不同稀释度:效价标准为4.0 IU·mL-1,装量1.0 mL,稀释比例为1∶174;效价标准为4.0 IU·mL-1,装量0.5 mL,稀释比例为1∶347;效价标准为4.5 IU·mL-1,装量0.5 mL,稀释比例为1∶389;效价标准为4.3 IU·mL-1,装量1.0 mL,稀释比例为1∶186。标准品的稀释比例为1∶288。用单一稀释度的待测狂苗及标准品分别免疫12~14 g小鼠10只,每只小鼠腹腔注射0.5 mL,间隔一周再免疫一次。小鼠于第一次免疫后14 d,用预先测定的含5~100 LD50的病毒量进行脑内攻击,每只0.03 mL;同时将CVS攻击毒稀释成100、10-1、10-2和10-3进行病毒毒力回滴,每个稀释度10只小鼠。小鼠攻击后逐日观察14 d,记录死亡情况,统计第5天后死亡和呈典型狂犬病脑症状的小鼠。计算待测狂苗和标准品的小鼠保护率(小鼠保护率:小鼠存活只数/小鼠定只只数×100%),待测狂苗保护率不低于标准品保护率判定疫苗符合质量标准。
1.2.3 快速荧光灶抑制试验(RFFIT)参照“《中国药典》2020年版(三部)通则3512第二法”进行检测[13]。在96孔板上3倍系列稀释待检血清及参考品(50 μL+100 μL);然后每孔加入50 μL适量的病毒(可引起细胞达到80%~95%荧光病变灶面积的病毒量),同时设立病毒对照及细胞对照。37 ℃培养箱里中和1 h;取出96孔反应板后,每孔加入50 μL BSR细胞(1×106mL-1)。37 ℃ 5% CO2培养箱里培养24 h后弃培养液,用0.1 mol·L-1PBS(pH 7.2)洗1遍,然后加入-20 ℃预冷80%丙酮50 μL,4 ℃固定30 min。弃掉丙酮,待残余丙酮挥发后,每孔加入50 μL FITC标记的抗狂犬核蛋白单抗,37 ℃培养箱里孵育30 min,用0.1 mol·L-1PBS(pH 7.2)洗3遍,置酶联免疫斑点分析仪扫描观察,记录每孔荧光病变灶面积。根据标准品及血清样品荧光病变灶面积在50%上下的两个稀释度,按照药典公式计算ED50,根据已知标准品效价计算血清中和抗体效价。血清抗狂犬病中和抗体效价大于等于0.5 IU·mL-1为抗体阳转标准。
1.2.4 M-NIH国家标准品单一稀释度的验证根据第八批国家标准品协作标定结果,该标准品加权ED50均值为2.46,参照上述公式[12]确定标准品的单一稀释比例为1∶288。按照NIH免疫程序共计免疫183只小鼠,0 d免疫,7 d加强免疫,14 d攻毒(每只小鼠脑内攻毒量为含CVS攻击毒5~100 LD50/0.03 mL)。攻毒前眼眶静脉窦采血,用RFFIT法检测小鼠抗体效价,计算小鼠阳转率;攻毒后观察14 d,第5天起记录小鼠死亡情况,计算小鼠保护率。
1.2.5 M-NIH(单一稀释法)的重复性本实验室分别用NIH和M-NIH两种方法检测2批低效价及高效价狂苗,分别进行5次独立试验,计算变异系数,评价该方法的重复性、稳定性。同时选取申报批签发狂苗及过效期狂苗共计21批,进行编盲后分发至6个有资质的实验室,每个实验室接收6~9批样品,分别进行3次独立试验,由中检院汇总各实验室NIH法测定效价几何平均值(geometric mean,GM)为疫苗效价最终结果,M-NIH法半定量结果以合格占比多数者为最终结果,评价实验室间的变异及各实验室检测结果的重现性。
1.2.6 M-NIH(单一稀释法)与NIH法的一致性比较(准确度)本实验室采用13批上市后抽验及39批次申报批签发共52批次狂苗,分别用两种方法进行检测,分析两种方法的一致性,并确定M-NIH法标准品的保护率范围作为实验室内控标准。另外,9家实验室对各自企业生产的狂苗包括申报批签发疫苗、过效期疫苗、37 ℃放置28 d加速热破坏疫苗及上述编盲21批样品合计284批次,进行两种方法的比较。
1.2.7 M-NIH(单一稀释法)的适用性3家企业至少各5批申报批签发疫苗,分别用M-NIH及NIH进行3次试验,考察方法的适用性。
1.2.8 M-NIH(单一稀释法)在狂苗批签发中的应用M-NIH法获得国家标准批件后,2019年7月至2023年6月采用M-NIH法对申报批签发的狂苗合计820批进行了疫苗效价的抽验,M-NIH法不合格者,采用NIH法结果作为最终判定结果。
1.2.9 统计学方法采用SPSS 19.0对两种方法通过计算 Kappa系数和Mcnemar-Bowker检验来进行一致性分析。Kappa一致性检验结果有统计学差异(P<0.05),说明两种方法有一致性。当Kappa值在0.4到0.6之间说明一致性中等;在0.6到0.8之间说明一致性较高;在0.8到1之间说明有极好的一致性。Mcnemar-Bowker检验无统计学意义(P>0.05),说明两种检测方法效果相同。采用卡方检验对小鼠免疫后中和抗体阳转率和小鼠保护率比较以及不同实验室不同方法符合率进行比较,P<0.05为差异有统计学意义。
2 结果
2.1 第八批国家标准品单一稀释比例的验证标准品按1∶288稀释,共免疫183只小鼠,14 d采血检测抗体阳转率为53.0%(97/183),小鼠血清抗体滴度结果分布在0~27.2 IU·mL-1。14 d小鼠脑内病毒攻击后观察14 d计算保护率为54.6%(100/183)。标准品协作标定结果加权均值ED50为2.46,按照1∶288比例稀释后抗体阳转率及小鼠保护率均在50%左右,差异无统计学意义(χ2=0.137,P=0.711),结果见表1。

表1 国家标准品1∶288单一稀释比例的验证结果
2.2 M-NIH法重复性结果本实验室对标示为疫苗1,疫苗2的低、高效价两批狂苗各重复5次NIH及M-NIH法检测,M-NIH法检测标准品的保护率变异系数为11.3%;疫苗1保护率变异系数为34.3%;疫苗2保护率变异系数为15.4%。NIH法检测2批疫苗的效价检测变异系数分别为16.3%和8.9%,结果见表2。21批编盲样品在各实验室的重现性结果显示,实验室间变异系数为12.6%~80.3%,结果见表3。21批疫苗计算几何平均效价,其中编号13、14、15的3批狂苗因两个实验室间偏差较大未统计。纳入统计的18批疫苗的几何平均效价分布及符合率统计见表4。
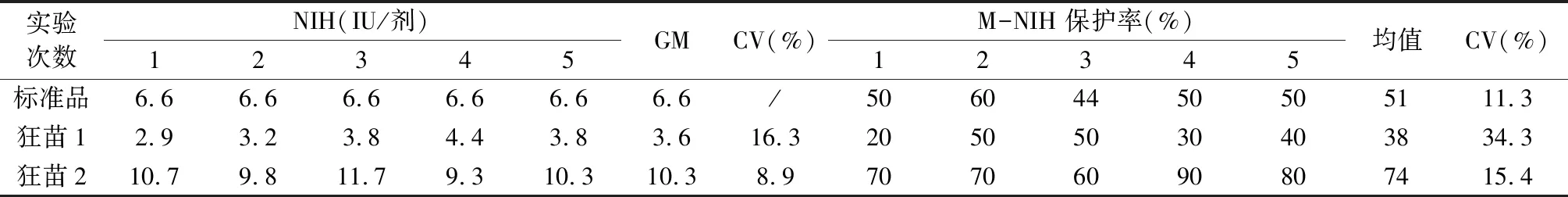
表2 重复性实验结果

表3 21批编盲样品重现性实验结果

表4 18批编盲狂苗几何均值效价分布及两种方法符合率结果
2.3 M-NIH和NIH的比较验证(M-NIH准确度)


表5 中检院实验室52批M-NIH与NIH法比较结果

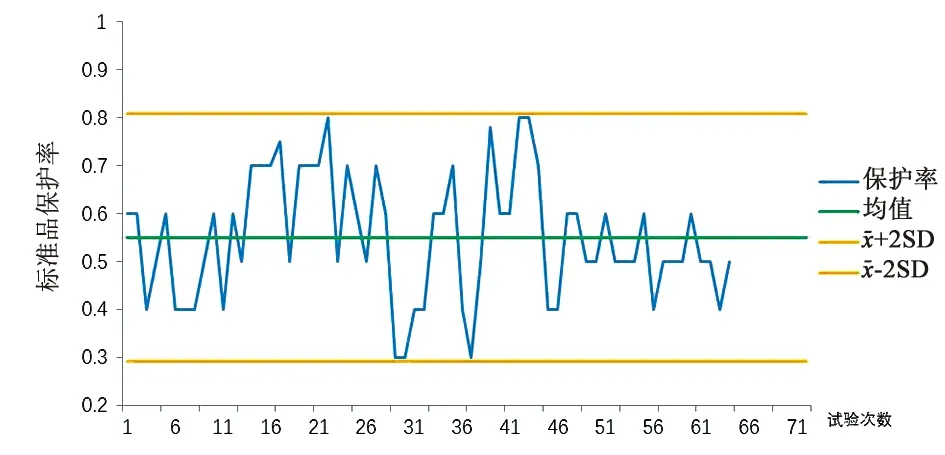
图1 国家标准品保护率M-NIH法验证结果

表6 9家实验室M-NIH法与NIH法的比较结果
2.4 M-NIH法的适用性采用M-NIH法和NIH法对3家企业申报批签发产品检测结果显示,16批狂苗按照重复性结果分析,NIH效价取几何均值,M-NIH半定量结果以合格占比多数者为最终结果。两种方法检测结果均符合规定,符合率为100%(16/16);按照每次配对实验结果统计,有5次试验结果不一致,符合率为89.6%(43/48),两种符合率差异无统计学意义(χ2=1.81,P=0.179)。各实验室M-NIH法检测结果批间变异系数在17.5%~32.1%之间,实验间变异系数在0%~34.1%之间,结果见表7~9。
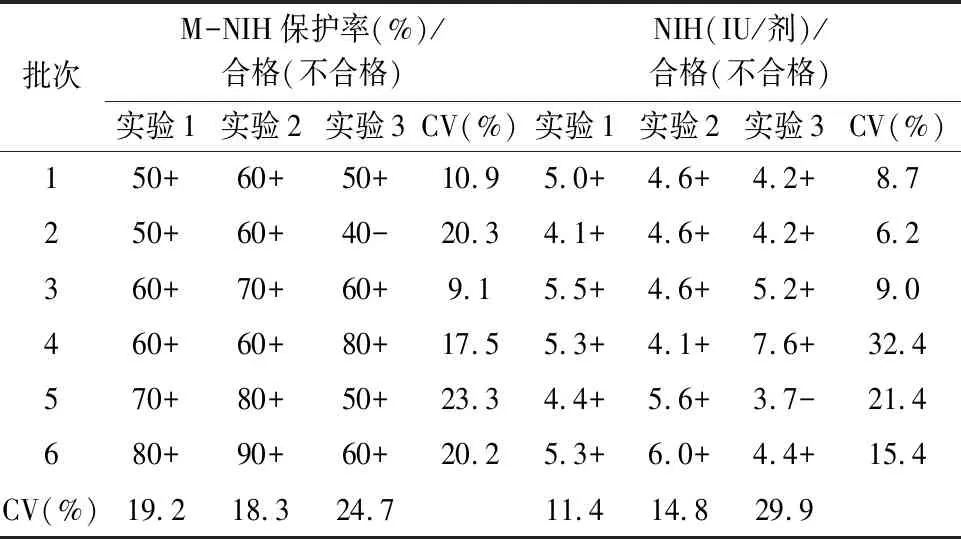
表7 企业A狂苗适用性验证结果(效价标准 4.0 IU/剂)
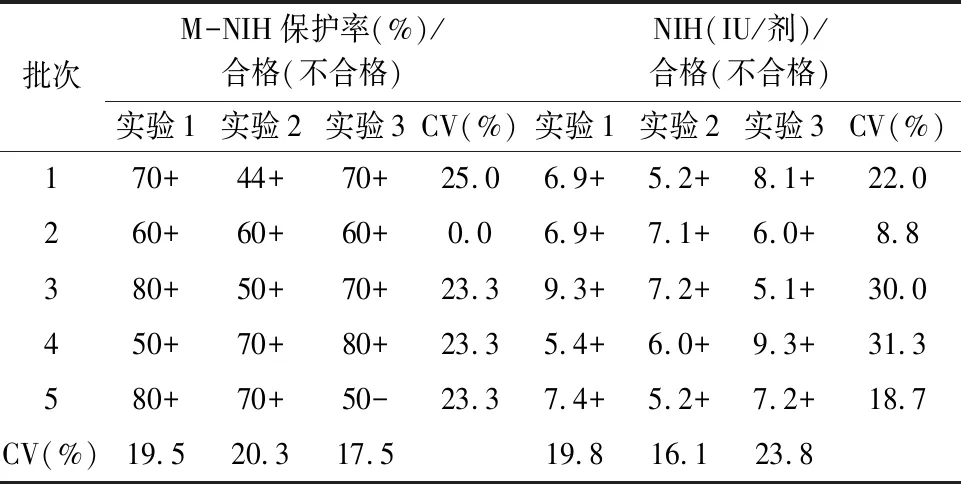
表8 企业B狂苗适用性验证结果(效价标准4.3 IU/剂)
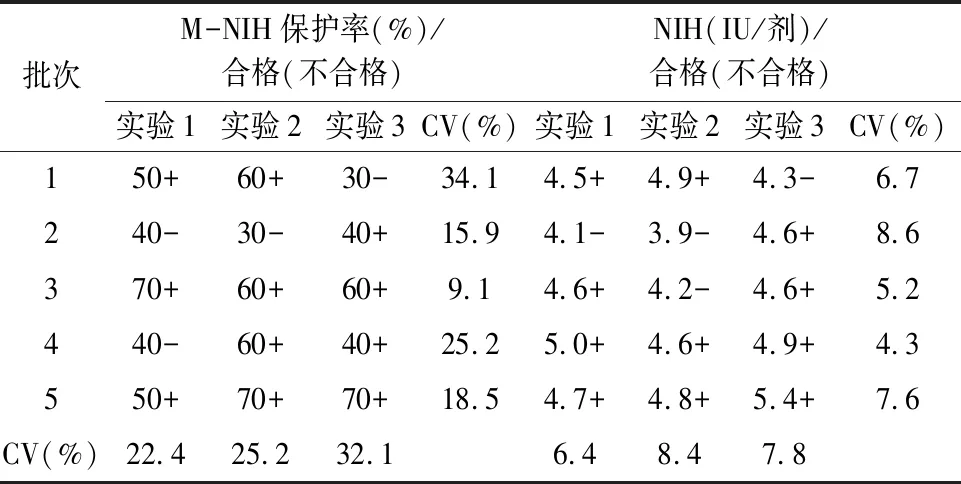
表9 企业C狂苗适用性验证结果(效价标准4.5 IU/剂)
2.5 M-NIH法在狂苗批签发中的应用2019年7月至2023年6月中检院应用M-NIH法对企业申报批签发狂苗抽样合计820批进行效价测定,M-NIH法不合格时,采用NIH法进行检测,作为最终判定结果。结果显示,820批狂苗经M-NIH法检验769批合格,合格率为93.8%(769/820),其中51批M-NIH法检验不合格批次,经NIH法检验49批合格,2批仍不合格,签发不合格报告。820批狂苗共计发出合格报告818批,合格率为99.8%(818/820),结果见表10。
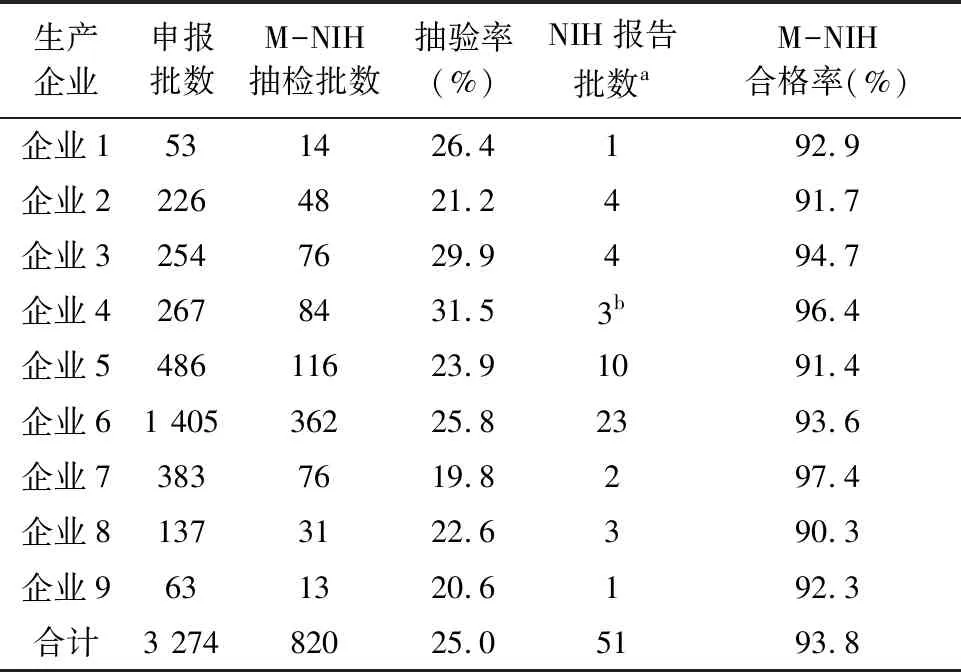
表10 M-NIH法在狂苗批签发中的应用
3 讨论
狂苗效价测定替代方法的3个研究方向:①减少动物使用量;②疫苗单一稀释度免疫小鼠后进行血清抗体检测;③建立体外效价试验[6,14-16]。人用狂苗的效价替代研究进展缓慢主要原因是替代方法需与“金标”NIH法进行比较,而“金标”NIH法本身变异性很大,WHO认可NIH试验可信限为25%~400%,体外替代方法和“金标”NIH法比较的相关性较差。因此,要建立人用狂苗体外替代方法难度很大,需要大量的验证实验和监管当局的批准[17-18]。2017年由WHO牵头组织的全球性合作研究,利用巴斯德开发的可以识别三聚体RABV糖蛋白的抗原位点Ⅲ(aa 330至338)mAb-D1单抗,采用双抗体夹心ELISA法,研究建立人用狂苗的效价测定体外替代方法,研究结果与NIH法检测比较结果一致,是最有望替代NIH试验的体外方法[19-22]。近年来越来越多国际专家建议体外效价试验来替代体内动物试验[23-24]。但截至目前,尚未有WHO或欧洲药典等指南发布体外效价替代方法。同时,Volokhov等[25]专家指出体外ELISA法不能真正反映诱导产生体内保护性免疫应答的免疫原含量。虽然Machado等[26]的研究证实通过减少NIH法50%动物使用量可以不影响结果判定,但仍需要进行3个稀释度的动物免疫。我国狂苗的质控可以通过体外ELISA法检测抗原含量进行批间一致性控制,但由于国内各企业所用狂犬病毒疫苗株和细胞基质以及生产工艺之间差别较大,与NIH法比较相关性较差,不适用于国家技术监管部门统一评价狂苗效价。因此本研究建立M-NIH半定量方法,采用单一稀释度,大大减少动物使用量,符合动物使用的“3R”原则。
中检院52批次狂苗验证结果显示,两种方法的符合率为92.3%(Kappa=0.82,P<0.01),9家实验室247批次狂苗扩大联合验证结果显示,两种方法的符合率为80.2%(Kappa=0.54,P<0.01),两种方法符合率差异有统计学意义(χ2=4.34,P=0.037),考虑跟实验用疫苗相关,前者的验证疫苗均使用了申报批签发疫苗及效价抽样合格疫苗。而9家实验室扩大验证用疫苗247批次中参照WHO指南的要求加入了不合格疫苗作为对照样品[5],大量效价在临界值附近的疫苗造成了M-NIH半定量结果判定的准确性有所下降,与NIH法的符合率低于52批次验证结果。对21批编盲样品的重复性实验结果也充分显示了对低于合格标准及高于合格标准的疫苗,M-NIH与NIH符合率分别是100%和87.5%,而对于效价标准临界值的疫苗两种方法检测结果的符合率仅有50%。因此规定对于M-NIH法效价不符合标准的疫苗需采用经典的NIH法进行检验。采用该方法的实验室应已建立稳定的NIH方法并通过充分验证,并定期对该方法进行评估,确保该方法的可靠性[13]。
M-NIH法设立了国家标准品保护率的范围作为实验室内控标准,标准品保护率的实验室内变异为21.7%,实验室间变异为23.4%,说明该方法重复性良好,3家企业狂苗适用性验证结果也显示M-NIH法在各实验室检测结果稳定,批间一致性良好(批间变异系数在17.5%~32.1%之间,实验间变异系数在0%~34.1%之间)。该方法获得批准后已应用于狂苗的批签发检验。该方法的应用提高了狂苗效价的抽检率,效价测定由20%提高到25%以上,同时也大大提高了狂苗检验效率,加快了批签发进度,节省了人力和动物使用量。单一稀释法作为狂苗批签发效价NIH法的补充方法发挥了重要的技术支撑作用。

