三亚湾近岸海域浮游植物群落特征及其环境影响因子
赵 茜,王兴华,王 蒙,李格乐,王 辉,殷安齐
(1. 海南热带海洋学院 热带海洋生物资源利用与保护教育部重点实验室,海南 三亚 572022; 2. 海南热带海洋学院 海南省热带海洋渔业资源保护与利用重点实验室,海南 三亚 572022; 3. 海南热带海洋学院 海南省近岸海洋生态环境过程与碳汇重点实验室,海南 三亚 572022; 4. 海南热带海洋学院 海南省现代化海洋牧场工程研究中心,海南 三亚 572022; 5. 海南热带海洋学院 生态环境学院,海南 三亚 572022; 6. 湛江港(集团)股份有限公司,广东 湛江 524068; 7. 三亚市农业技术推广服务中心,海南 三亚 572019)
海洋浮游植物是海洋生态系统的重要组成部分,是物质循环和能量流动的关键过程[1-2]。浮游植物群落结构的变化可以及时反映水体环境的变化以及整个水生生态系统的稳定性[3-4],水环境的变化也会改变浮游植物群落结构的物种组成和丰度。浮游植物与其生活环境密切相关,营养盐水平、温度和光照条件对浮游植物群落结构影响很大,其影响水平能够通过浮游植物的生长和繁殖率表现出来[5-6]。因此,根据浮游植物群落结构多样性及其时空变化,能够对水体的营养水平和污染状态作出判断,有助于深入了解海洋生态系统的健康状况。
三亚湾(18°13′~18°17′N;109°22′~109°29′E)是紧挨三亚市区的六大海湾之一,是三亚市重点监测港湾。随着海南建设自由贸易港、打造国际旅游岛等一系列国家战略决策的实施,三亚市旅游业、加工业及港口航运等发展迅速[7-9]。近年来,由于生活污水和船舶废水的排放以及海岸工程的建设,三亚湾近岸海域污染日趋严重,部分区域出现海水浑浊和海滩变黑的现象[10]。此外,海湾的大量建筑物削弱了该海域的水动力,使得该海域对营养盐等污染物质的净化能力降低。目前,三亚湾有关浮游植物的调查已开展多次:2004 年,杨志浩等[11]在三亚湾共鉴定出169 种网采浮游植物;2011 年,车志伟等[12]在春、夏、秋、冬4个季节对三亚湾海域网采浮游植物种类进行研究和分析;2019 年,程贤松等[13]在春、秋两季对三亚湾的浮游植物及水质进行网采取样调查;2020 年4 月和2021 年4 月,洪鹏等[14]对三亚湾近岸海域浮游植物进行2 次网采取样调查。近年来,对三亚湾浮游植物的研究主要是用浅水Ⅲ型浮游生物网(77 μm)的方式进行样品采集,水采的方式较少。网采样品中小尺寸浮游植物的遗漏导致该区域浮游植物丰度的结果偏低[15-16];而水采样品中小尺寸浮游植物丰度较高,误差较小,水采对不同尺寸浮游植物统计更全面[16],更适用于三亚湾近岸海域浮游植物的定量研究。本研究基于2021 年夏冬两季三亚湾近岸海域水采浮游植物与水环境因子调查,分析浮游植物群落结构特征及其与环境因子之间的关系,以期为三亚湾近岸海域的生态系统保护提供基础数据和支持。
1 材料与方法
1.1 样品采集与分析 参考《海洋调查规范》[17],结合三亚湾近岸海域实际情况,在水深小于10 m处设置6 个站位(图1)。S1位于三亚湾与天涯湾分界处,处于围填海状态;S2位于三亚湾派出所附近,人为干扰较少,可作为背景值;S3位于三亚景利莱文旅商业中心附近,人为干扰较多;S4位于海月广场附近的浅桥下,人为干扰较为严重;S5位于三亚港码头处,受航运情况、船舶废水的影响较多;S6位于半山半岛帆船港处,处于围填海状态。三亚地处热带区域,四季划分不明显,于2021年6月(夏季)和12 月(冬季)进行采样。
1.1.1 浮游植物样品 参考《近岸海域环境监测技术规范》[18],使用玻璃采水器在表层水深0.5 m处采集水样,并将水样立即转入1 L的采样瓶,用中性福尔马林溶液固定样品至终浓度为1%~2%,带回实验室静置至少48 h后采用虹吸法吸去上清液,浓缩至25 mL,获得浮游植物定量样品,在蔡司显微镜Axiolab 5下进行种类鉴定和细胞计数。
1.1.2 水环境样品 用1.5 L采水器采集混合水样,使用多参数水质测定仪现场测定温度(T)、盐度(S)、酸碱度(pH)、溶解氧(DO);将采集后的水样装入溶解氧瓶和采样瓶中,置于装有冰袋的泡沫箱中低温保存。参考《海洋监测规范 第4部分:海水分析》(GB 17 378.4-2007)[19],将带回实验室的水样进行化学需氧量(COD)、五日生化需氧量(BOD5)、氨氮(NH3-N)、亚硝酸盐氮(NO2-N)、硝酸盐氮(NO3-N)和无机磷(DIP)的测定,各指标的分析方法见表1。
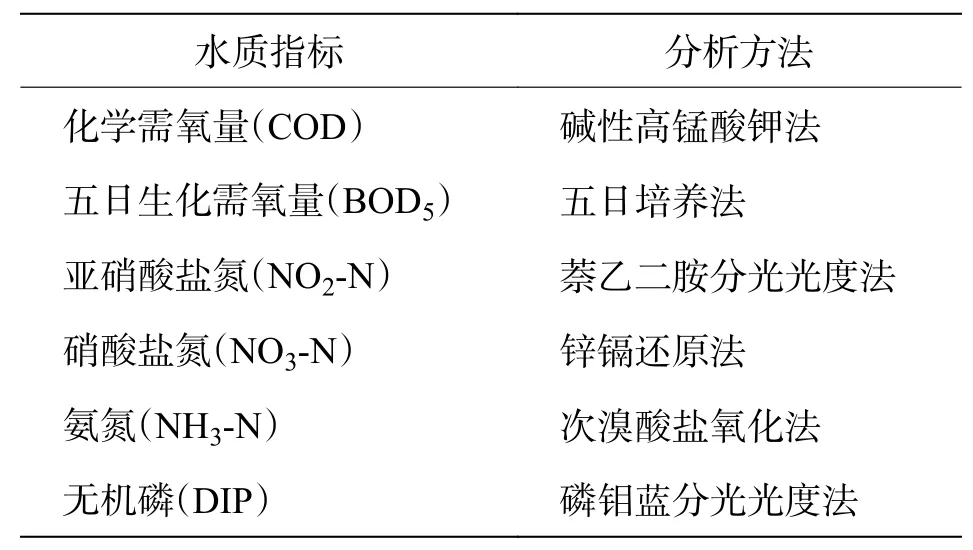
表1 水质分析方法
1.2 数据处理
1.2.1 优势种的确定 根据每个种类的优势度(Y)[20]确定优势种。
式中,Ni表示所测样品中第i种物种的个数,N表示样品中所有种类的总个数,fi表示第i种在各站点出现的频率。Y>0.02的种类为优势种。
1.2.2 多样性的分析 采用生物多样性指数(Shannon-Wiener[21];Pielou[22];Margalef[23])进行多样性分析。
式中:H′表示Shannon-Wiener多样性指数,J表示Pielou均匀度指数,d表示Margalef丰富度指数,S表示样品的总种类数,Pi表示第i种的个数(Ni)与总个数(N)的比值(Ni/N)。
1.2.3 统计分析 运用Excel 2019和Origin 2021进行统计分析和绘图。采用SPSS 26.0对各项数据进行正态性检验,符合正态分布且方差齐性时,采用单因素ANOVA方差分析组间差异性,反之则用Wilcoxon秩和检验(两组之间)和Kruskal-Wallis检验(多组之间)分析组间差异性。采用Canoco 5.0对优势浮游植物种类作去趋势对应分析(DCA),DCA大于4时,选择典范对应分析(CCA)来解释优势浮游植物和环境因子之间的关系;DCA小于3时,应选择冗余分析(RDA);DCA介于3~4之间,两种分析模型均可[24]。
2 结果与分析
2.1 浮游植物种类组成 本研究共鉴定出浮游植物158 种(含变种、变型,不含未定种),隶属于6门64 属。硅藻种类最多,42 属116 种,占总种类数的73.42%;甲藻17 属36 种,占总种类数的22.78%。其中,角毛藻属(Chaetoceros)种类最多,共19 种,占总种类数的12.03%;其次是根管藻属(Rhizosolenia)和原多甲藻属(Protoperidinium),均为10 种,各占总种类数的6.33%;其他61 属的种类数均小于10 种。夏季共发现浮游植物130 种,其中硅藻99 种、甲藻25 种;冬季共发现浮游植物111 种,其中硅藻80 种、甲藻26 种。硅藻与甲藻种类数占比在95%左右,可见该海域浮游植物群落主要由硅藻和甲藻构成。夏季S2站位的浮游植物种类最多,为88 种,S6最少,为36 种;冬季S4站位的浮游植物种类最多,为80 种,S6最少,为21 种(图2)。

图2 浮游植物种类组成
2.2 浮游植物细胞丰度 如图3所示,在夏季和冬季,S4站位浮游植物丰度均最高,分别为39.04×105个·L-1和20.46×105个·L-1;S6站位浮游植物丰度最低,分别为4.33×105个·L-1和0.60×105个·L-1。在季节方面,夏季浮游植物平均丰度(15.07×105个·L-1)显著高于冬季(7.06×105个·L-1)。

图3 浮游植物细胞丰度
2.3 浮游植物优势种 调查海域的浮游植物优势种季节变化明显:夏季(表2)优势种13 种,链状曲壳藻(Achnanthes catenate)为第一优势种(Y=0.123),细胞丰度为13.28×105个·L-1,占总丰度的14.71%,其丰度最大值出现在S4站位(8.63×105个·L-1),仅在S5站位未发现该藻种。冬季(表3)优势种10 种,翼根管藻(Rhizosolenia alata)为第一优势种(Y=0.109),细胞丰度为4.62×105个·L-1,占总丰度的10.89%,其丰度最大值出现在S3站位(1.78×105个·L-1),最小值出现在S6站位(0.003×105个·L-1)。整体来说,三亚湾近岸海域硅藻优势最为明显。此外,冬季一些物种的丰度占比虽高于0.02,但因其出现频率低,未成为优势种,如链状曲壳藻(A. catenate)和中肋骨条藻(S. costatum)等。
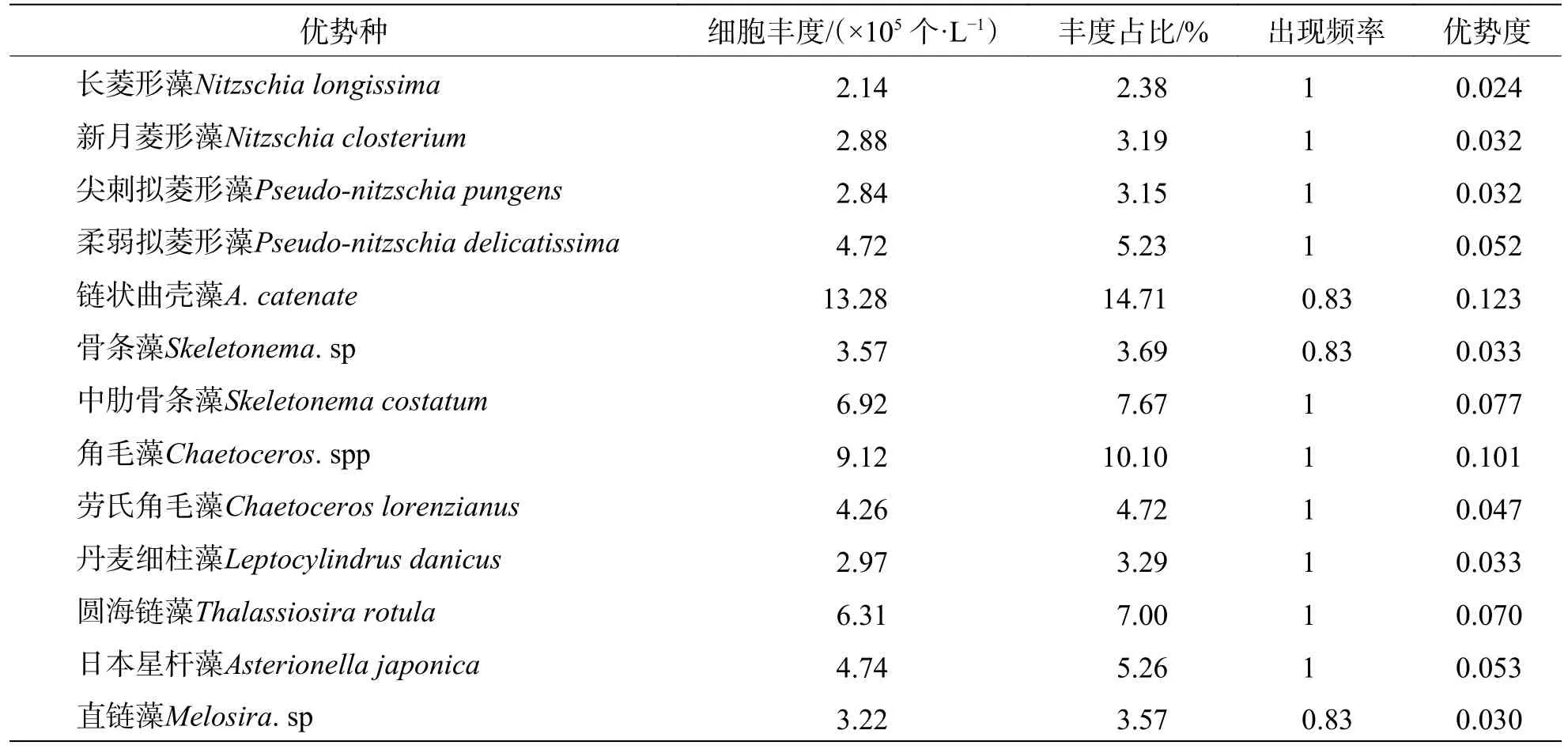
表2 夏季浮游植物优势种及优势度

表3 冬季浮游植物优势种及优势度
2.4 浮游植物群落结构指数 三亚湾近岸海域浮游植物群落结构指数如图4所示,Shannon-Wiener多样性指数的变化范围为2.08~5.16,均值为4.14,最高值出现在夏季的S2站位,最低值出现在冬季的S6站位,水质多处于无污染-轻污染状态。Pielou均匀度指数在0.47~0.82之间变化,均值为0.70。均匀度指数最高值出现在夏季的S2站位,最低值出现在冬季的S4站位,水质多处于轻污染-中污染状态。Margalef丰富度指数变化范围为1.26~4.45,均值为3.13,最高值为夏季的S2站位,最低值出现在冬季的S6站位,水质多处于中污染状态。经Wilcoxon秩和检验和Kruskal-Wallis检验得出,各项浮游植物群落结构指数时空差异性不明显。
2.5 浮游植物与环境因子相关性分析
2.5.1 环境因子的分布特征 三亚湾近岸海域水环境因子状况见表4,经Wilcoxon秩和检验,除S、COD、BOD5、NO3-N和DIP(P>0.05)以外,其他环境因子均存在显著性差异。其中,T(P<0.01)、pH(P<0.05)和NH3-N(P<0.01)的夏季数值显著高于冬季,DO(P<0.01)和NO2-N(P<0.05)的冬季数值显著高于夏季。水质符合二类海水水质标准。

表4 三亚湾近岸海域水环境因子状况
2.5.2 冗余分析(RDA) 选取夏季、冬季各站位出现频率≥20%,且至少取一个站位的相对丰度高于1%的10 种浮游植物进行去趋势对应分析[25-26],梯度长度分别为1.7和2.3,均小于3,采用冗余分析对优势浮游植物丰度与环境因子进行RDA排序(图5),藻类代码见表5。
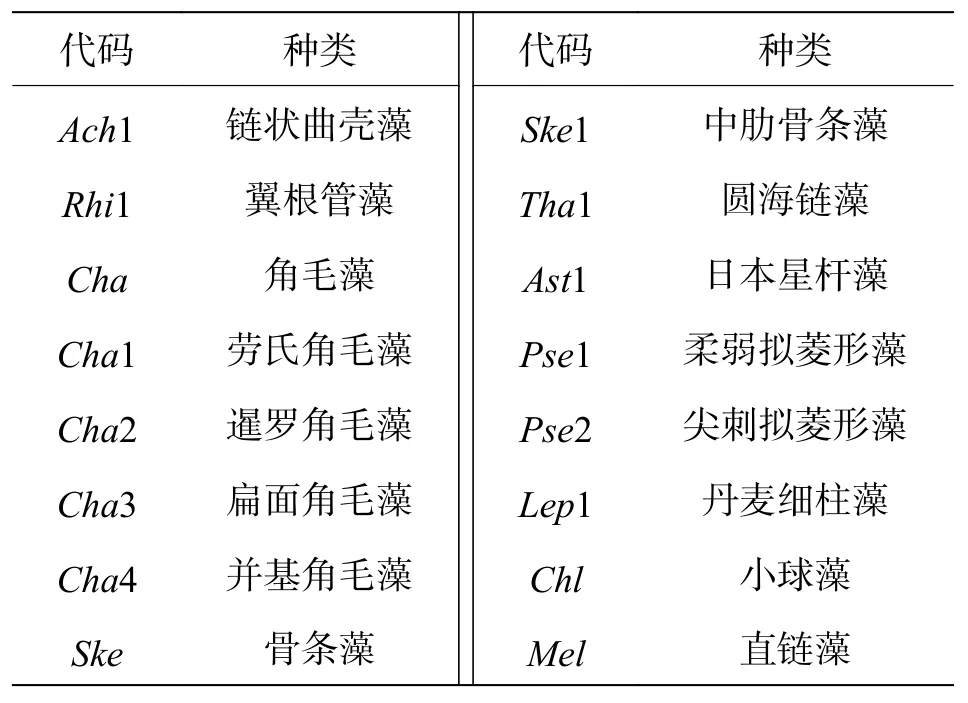
表5 进行RDA排序的浮游植物种类代码

图5 夏季(A)和冬季(B)优势浮游植物丰度与环境因子的RDA排序
利用向前引入法逐步筛选环境因子,经Monte Carlo置换检验,结果表明,夏季COD(F=15.2,P=0.002)、DO(F=12.0,P=0.002)、NO3-N(F=9.3,P=0.002)、S(F=6.5,P=0.012)和NO2-N(F=3.5,P=0.028)这5 个环境因子达到显著水平,是影响夏季优势浮游植物丰度的主要环境因子;冬季NH3-N(F=8.9,P=0.002)、COD(F=3.5,P=0.002)、S(F=5.1,P=0.002)、NO3-N(F=4.0,P=0.002)和pH(F=2.9,P=0.012)这5个环境因子达到显著水平,是影响冬季优势浮游植物丰度的主要环境因子。
图5表明,夏季优势浮游植物主要集中在第一、四象限,与环境因子有明显关系,可以分为3类:第一类包括圆海链藻(T. rotula)、柔弱拟菱形藻(P. delicatissima)、丹麦细柱藻(L. danicus)、劳氏角毛藻(C. lorenzianus)、中肋骨条藻(S. costatum),与DO、pH、BOD5呈正相关,与NH3-N、DIP、NO2-N、S和NO3-N呈负相关;第二类是小球藻(C.sp.),与T和COD呈负相关;第三类包括骨条藻(S.sp.)、角毛藻(C.spp.)、链状曲壳藻(A.catenate)和日本星杆藻(A. japonica),与T、COD呈正相关。冬季优势浮游植物主要集中在第二、三象限,也分为3类:第一类包括角毛藻(C.spp.)、柔弱拟菱形藻(P. delicatissima)、劳氏角毛藻(C.lorenzianus)、丹麦细柱藻(L. danicus)、尖刺拟菱形藻(P. pungens),与T、DO呈正相关,与NO2-N、NO3-N和DIP呈负相关;第二类为小球藻(C.sp.),与COD、BOD5、NH3-N呈正相关,与pH、S呈负相关;第三类包括翼根管藻(R. alata)、暹罗角毛藻(C. siamense)、扁面角毛藻(C. compressus)、并基角毛藻(C. decipiens),与pH、S正相关,与COD、BOD5、NH3-N呈负相关。
结果表明,硅藻门在三亚湾近岸海域浮游植物群落结构中起主要贡献作用,RDA分析结果表明,S、pH、DO、COD、NO2-N、NO3-N和NH3-N是夏冬两季浮游植物群落结构的关键驱动因子。
3 讨 论
3.1 浮游植物群落结构组成 本研究结果表明,三亚湾近岸海域夏冬两季浮游植物共158 种,两季皆以硅藻为主,其次为甲藻,两者共占总种类数的96.20%,其他门类仅占极少数,该海域浮游植物群落结构的生态类型为硅藻-甲藻型,与其他海湾的浮游植物群落结构研究结果一致[27-29]。关于三亚湾海域浮游植物长期变化的研究报道均是使用浅水Ⅲ型浮游生物网进行采集样品[11-14],而基于水采方法的浮游植物群落结构比传统的网采方法更能反映浮游植物的实际情况,因为网采样品不能将水体中全部粒径的浮游植物采获,算是1种半定量的方法。本研究中水采的浮游植物丰度的数量级为105个·L-1,而程贤松[13]、车志伟[12]、杨志浩[11]、洪鹏[14]等网采样品的数量级在105个·m-3左右。在镜检样品时发现,粒径小的浮游植物远远多于粒径大的,不仅是部分硅藻,绝大多数甲藻的尺寸都小于77 μm。网采样品中浮游植物种类数、丰度与甲藻种类数均呈现出水采高于网采的规律[11,30-32],此次水采样品的总丰度及甲藻种类数均高于之前的网采样品,所以采样方式可能是导致该海域浮游植物丰度数量级与前人研究不同的原因。
三亚湾近岸海域夏冬两季优势种差异较大,交替明显,18 种优势种中只有5 种是共有优势种,均为广温广布性种,优势种中近岸广布性种占主要地位,并在夏冬两季均有出现。夏季第一优势种为链状曲壳藻(A. catenate),镜检结果表明,其主要以6~20 个的群体形态出现,易志勇[33]研究发现,链状曲壳藻(A. catenate)在低氮浓度下更易于形成链状群体,当氮浓度为2.5 mg·L-1时,链状曲壳藻(A. catenate)生长情况最佳。三亚湾近岸海域的氮元素水平均处于较低的状态,链状曲壳藻(A.catenate)以群体形态出现与易志勇的研究是一致的。冬季的第一优势种是翼根管藻(R. alata),夏季数量不多,却在冬季成为第一优势种,罗先香等[31]对黄河口及邻近海域的调查发现,翼根管藻(R. alata)对水环境变化的敏感程度相对较高,与S呈显著正相关关系,与T、COD和pH呈显著负相关关系,与本研究中的翼根管藻(R. alata)的丰度分布情况大致相同。
3.2 浮游植物群落的多样性 Shannon-Wiener多样性指数用于判断群落结构的复杂程度,浮游植物的种类越多或者分布越均匀,值越大,群落结构越复杂[34]。均匀度指数用于判断群落是否成熟稳定[35],丰富度指数的值越大,群落结构越稳定,生态系统的抗干扰能力越强[36]。本研究结果表明,夏季各站位浮游植物群落的H′、J和D的平均值分别为4.44、0.73和3.33,冬季分别为3.84、0.67和2.93,说明该海域浮游植物多样性较高,物种较为丰富,群落结构较复杂、稳定性较好,生态系统抗干扰能力较强。
综合对比图2和图4可以发现,夏、冬两季物种数与丰富度指数变化大致相同。两者在S2站位均达到峰值,不同之处出现在夏季的S4站位,虽然此站位的物种数处于较高水平,但由于硅藻(丰度占比99.12%)大量繁殖导致丰度远远高于其他站位,使得该站位丰富度指数较低,出现偏差。单一藻类优势过高,会影响群落结构指数的变化趋势[37],夏季链状曲壳藻(A. catenate)的丰度占比为14.71%,冬季翼根管藻(R. alata)的丰度占比为10.89%,是引起该海域多样性指数与丰富度指数变化趋势不同的原因。三亚旅游业淡、旺季特征明显,4 月至10 月是旅游淡季,而1 月至3 月和11 月至12 月为旺季[38]。S2站位相对于其他站位人流量最少,受人为影响最小,夏季该站位的浮游植物种类数、多样性指数和丰富度指数均处于高峰期,表明该站位物种种类多、多样性好,分布均匀。
夏冬两季的浮游植物群落差异性明显。夏季浮游植物丰度和种类数均显著高于冬季。S2站位受人类活动干扰较少,浮游植物种类较丰富,在夏冬两季均为最高值,且物种分布均匀,群落稳定性大,水质状况整体优良。S4站位的两季硅藻种类数相差不大,但冬季甲藻种类数高于夏季,导致该站位种类数季节差异与其他站位相反,即夏季种类数低于冬季。经差异性检验后发现,S1站位与S6站位无显著性差异(P=0.805)。S1站位处以大坝作为三亚湾与天涯湾的分界,S6站位位于半山半岛帆船港港内。二者均处于围填海状态,仅有围填海的程度不同。围海可以兴建养殖池塘、围海制盐等,填海可以用于港口码头建设、城镇及工业用地发展等[39],而围填海这一用海方式能够引发围填海附近海域生物多样性降低、优势种演替和群落结构变化[40],所以S1、S6站位的物种多样性均低于其他站位可能与围填海工程有关,且处于港湾内部的S6站位受到的影响更为严重,浮游植物种类和丰度均处于最低水平,该站位浮游植物群落复杂程度低,稳定性差,物种丰富度低,生态系统抗干扰能力弱。S4站位与S1、S6站位均存在极显著性差异(P<0.01)。S4站位位于海上浅桥的桥下,人流量较大,有机污染程度较高,COD和浮游植物丰度在该站位均达到最高。COD是反映水体有机和无机可氧化物质污染的常用指标,较高的有机物含量,有利于浮游植物的生长[37],与该站位浮游植物丰度达到最高的结果相一致。
3.3 浮游植物群落与环境因子的关系 浮游植物的生长受温度、盐度、营养盐等诸多环境因子的综合影响,各环境因子及其间的交互作用共同影响浮游植物群落结构[41],RDA分析结果显示,夏季浮游植物主要受S、DO、COD、NO2-N和NO3-N的影响,冬季主要受S、pH、COD、NO3-N和NH3-N的影响。
S是影响浮游植物营养盐吸收和繁殖的关键因素之一[42],本研究中,S的季节变化不明显,两季的S在S5站位均为最低值,可能与船舶废水、生活污水等的排放有关。林庚明等[43]通过主成分分析发现S对楚科奇海浮游植物分布有重要影响;卜世勋等[44]发现S是影响2020 年抚宁海湾扇贝养殖区的浮游植物群落结构的主要环境因子之一,与本研究结果相符。
三亚湾近岸海域水质呈弱碱性,而弱碱性的水体环境有助于浮游植物吸收CO2,从而提高光合作用的效率[45]。本研究中发现,夏季的pH值是显著高于冬季的,甲藻的种类数与丰度占比在冬季均有所升高,据Chust等[46]认为,CO2的增加对硅藻应该是略微有益的,对甲藻非常有益,因此,推测pH对冬季的浮游植物群落结构组成影响较夏季明显。
近岸海域是敏感区域,在多种作用的影响下,会导致DO呈现出不同的特点[42],如水质中营养盐含量较为丰富时,浮游植物大量繁殖,光合作用增强,导致溶解氧含量上升[47]。本研究中,夏季的DO含量与优势浮游植物呈显著正相关关系,与O′boyle等[48]对爱尔兰河口和近岸沿海水域浮游植物生物量积累影响因素的研究结果相一致。同时,DO也与温度呈负相关关系,夏季虽有大量的浮游植物进行光合作用,产生DO,但水温的升高有利于海洋动物的生长繁殖,消耗水中的DO[30],从而导致夏季的DO含量低于冬季。
COD是表示水体还原性物质含量的指标,也是衡量水体有机物含量的指标[37]。本研究中,COD无明显的季节性变化,但空间变化较为显著。S4站位位于海月广场附近,人流量较其他站位大,还处于海岸工程的桥下,COD含量均显著高于其他站位。人类活动输入大量的营养物质[49],导致有机物质含量较高,为浮游植物的大量繁殖提供了条件,特别是甲藻,其丰度和种类数在此站位均达到最高值。甲藻与硅藻的生存条件相似,这与柴然等[37]对崂山近岸浮游植物群落的研究结果相一致。
氮、磷是浮游植物生长中常见的限制营养元素,可以调节浮游植物的生长,影响浮游植物的种类和丰度[50]。邹景忠等[51]提出营养盐阈值标准为:水质中DIN含量为0.2~0.3 mg·L-1,DIP含量为0.04 mg·L-1。本研究中,三亚湾近岸海域两个季节的DIN和DIP含量均低于阈值,证明了该海域为贫营养海域。结果表明,优势浮游植物丰度与无机氮呈显著负相关关系,与无机磷的相关性不显著。有研究结果表明,硅藻和甲藻对氮磷的需求是不同的,其中,硅藻对氮元素的需求较大,甲藻对磷元素的需求较大[52]。夏冬两季硅藻丰度占比分别为97.81%和96.88%,对氮元素的需求更大,磷元素与甲藻丰度均处于较低水平,相关性不明显。
综上所述,三亚湾近岸海域浮游植物以硅藻门为主要种类,该海域浮游植物丰度存在明显的季节性差异。该海域浮游植物群落多样性较高,稳定性较好,生态系统具有较强的抗干扰能力。两季水环境因子表明该海域水质处于二类海水水质状态,相关部门应该采取相关措施,降低人为活动及海岸工程建设对三亚湾近岸海域水质的影响,保护海域生态环境。
——以汝溪河为例

