外源植物生长调节剂对桑黄发酵产黄酮的影响
宋 刚 张伟杰 张 德 凡军民 余甜幸
(江苏农林职业技术学院 茶与食品科技学院,江苏 句容 212400)
桑黄(Sanghuangporusspp.)隶属担子菌门(Basidiomycota)、锈革菌目(Hymenochaetales)、桑黄孔菌属(Sanghuangporus),世界范围内共有14种[1-2]。桑黄是中国传统的名贵中药材,其名称最早出自唐初甄权所著《药性论》[1],又名桑耳,国内大部分地区都有分布。《本草纲目》记载,桑黄能“利五脏,宣肠胃气,排毒气”,中医认为桑黄具有活血止血、化饮、止泻、缓解腹痛等功效[3]。现代研究表明,桑黄具有多种药理活性,不仅能够调节免疫,还可抗肿瘤、抗氧化和降血糖等[4-6]。
桑黄的药理功效与其所含的活性物质密切相关,其中黄酮和多糖是最为重要的两种成分,含量的高低直接影响其药用价值[7]。总黄酮含量可作为桑黄抗氧化功效的主要评价指标,通过液体发酵生产桑黄黄酮已逐渐成为研究热点[8-9]。而培养基中碳源、氮源及初始pH影响桑黄黄酮的生物合成[10],通过优化液体培养基组成可提高桑黄中黄酮类化合物的含量[11-13]。研究表明,植物生长调节剂作为外源添加物,可较大幅度地提高食药用菌代谢物产量[14-16]。目前,已有脱落酸(ABA)可促进桑黄中黄酮产量的报道[17],其他类型植物生长调节剂对桑黄发酵培养影响的研究还比较少。
本研究以团队前期筛选出的产黄酮优势桑黄菌株[18]为材料,通过在其液体发酵培养基中添加8种植物生长调节剂,比较不同处理不同发酵时间菌丝体产量和胞内黄酮含量,探讨植物生长调节剂对桑黄液体发酵菌丝生长和胞内黄酮产量的影响,以期为桑黄液体发酵生产黄酮提供参考。
1 材料与方法
1.1 材料
桑黄菌株为桑树桑黄品种‘SH-8’,由江苏农林职业技术学院江苏食用菌研究所提供。8种植物生长调节剂:细胞分裂素类的6-苄氨基腺嘌呤(6-BA)和激动素(KT),生长素类的萘乙酸(NAA)、2,4-二氯-苯氧乙酸(2,4-D)及吲哚丁酸(IBA),水杨酸(SA),赤霉素(GA3),脱落酸(ABA)。
种子培养基。采用PDA加富培养基,即马铃薯200 g、葡萄糖25 g、酵母膏1 g、蛋白胨1 g、K2HPO42 g、MgSO42 g、琼脂20 g、水1 000 mL,pH自然。高压蒸汽灭菌后倒平板备用。
发酵基础培养基。采用吴亚召等[12]设计优化的桑黄黄酮发酵培养基:玉米粉2.0%、葡萄糖1.5%、黄豆粉1.0%、蛋白胨1.0%、酵母膏0.5%、KH2PO40.2%、MgSO40.05%、维生素B1100 mg/L,pH自然。121 ℃高压蒸汽灭菌20 min后备用。
1.2 方法
种子液制备。从冰箱保存的斜面试管菌种中挑取1小块菌丝块,接种至PDA加富平板28 ℃活化培养5天后,用9 mm打孔器取6块菌丝块,接种至含100 mL种子培养基的250 mL三角瓶中,在160 r/min、28 ℃恒温摇床中培养7天得到种子液。
植物生长调节剂培养基制备。参考王然等[19]方法将水杨酸(SA)、细胞分裂素(6-BA,KT)、生长素(NAA,2,4-D,IBA)、脱落酸(ABA)、赤霉素(GA3)共8种植物生长调节剂配置成1 mg/mL溶液,取1 mL灭菌(高温或常温过滤灭菌,IBA、GA3采用的过滤灭菌)加入装有发酵基础培养基99 mL的250 mL三角瓶中,使其在培养基中浓度为10 mg/L。以不添加为对照处理。
摇瓶培养。将种子液以10%(V/V)的接种量接种到添加了不同植物生长调节剂的发酵培养基三角瓶中,恒温摇床28 ℃、160 r/min培养。分别于第7、9、11天取样,测菌丝体生物量和胞内黄酮含量,每个处理3次重复。
1.3 测定项目
(1)菌丝体生物量。将100 mL发酵液中菌丝用20目筛网收集起来,于清水冲洗,直至培养基完全被洗净,再将菌丝平摊到纱布上,在烘箱中60 ℃烘干,称量得到菌丝干重(g)。
(2)胞内黄酮含量。采用NaNO2-Al3+-NaOH体系分光光度法[20]测定,略有改动。
材料和试剂:菌丝体磨碎干粉样品、95%乙醇、芦丁标准品、NaNO2溶液、Al(NO3)3溶液、NaOH溶液。
供试液制备:称取菌丝研磨干粉样品0.1 g,置于三角瓶内,加入50%乙醇100 mL,75 ℃水浴提取1 h,然后过滤到100 mL容量瓶中,将过滤后的液体加入50%乙醇,使其定容到100 mL,然后摇匀,作为供试液。
芦丁标准曲线绘制:将0 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL和5.0 mL的芦丁标准液倒入6个25 mL的容量瓶中,加入50%乙醇到5.0 mL,再加0.7 mL 5%NaNO2溶液,使其混合均匀,静置反应5 min;各加0.7 mL 10% Al(NO3)3溶液混合均匀,静置反应5 min;各加5 mL 10%NaOH溶液混合均匀后,用50%乙醇定容,放置10 min后,在510 nm波长下测定吸光度。以吸光度为纵轴,芦丁液浓度为水平轴,绘制标准曲线。芦丁浓度为0、20、40、60、80、100 mg/L。
胞内黄酮含量测定:精确吸取3 mL供试液,于25 mL容量瓶中,加2.0 mL 70%乙醇,摇匀,再加0.7 mL 5%的NaNO2,摇匀,静置5 min;将0.7 mL 10%Al(NO3)3加入混合液混合,静置5 min;将5 mL 10%NaOH溶液加入混合液混匀,用50%乙醇定容,10 min后,在510 nm波长下测量吸光度。通过回归方程及样品稀释倍数,计算出样品中黄酮含量(µg/mL)。
(3)胞内黄酮产量。根据第11天时菌丝胞内黄酮含量和菌丝体生物量计算胞内黄酮产量。计算公式:菌丝体黄酮产量(µg/mL) =[胞内黄酮含量(µg/mL)×100 mL/0.1g]×菌丝体干重(g/100 mL)。
将公式计算得到的黄酮产量(µg/mL)单位换算为mg/L,即为所得产量。
1.4 数据处理与分析
每个处理取3次生物学重复,结果用SPSS 25.0进行方差分析和多重比较。
2 结果与分析
2.1 标准曲线
如图1所示,采用NaNO2-Al3+-NaOH比色体系获得的芦丁标准曲线在0~120 mg/L的浓度范围内呈良好线性关系,线性方程为:y= 0.01x+ 0.004,线性相关系数R2=0.9999,可以用于桑黄总黄酮含量计算。
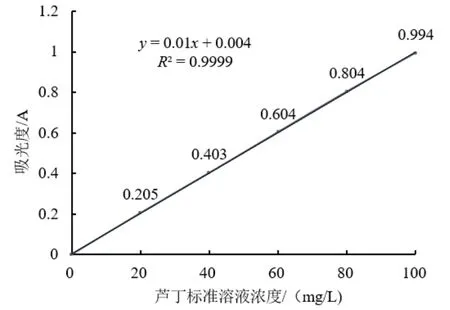
图1 芦丁标准曲线
2.2 植物生长调节剂对桑黄菌丝体生物量的影响
在接种后第7、9、11天分别过滤发酵液,获得桑黄菌丝体,菌丝体呈黄色颗粒状,且发酵时间越长颗粒越大,颜色逐渐变浅。
测定结果显示,外源添加不同植物生长调节剂对桑黄菌丝体生物量影响明显(表1):接种后第7~11天,随培养时间延长,添加6-BA、KT处理菌丝体生物量整体呈上升趋势,具有统计学差异(P<0.05);添加NAA、SA及对照(CK)处理的菌丝体生物量均呈先增加后下降趋势,差异显著;添加GA3和2,4-D处理的菌丝生物量呈逐渐下降趋势,差异显著;添加IBA、ABA处理的菌丝体生物量变化差异不显著。在上述处理中,外源添加2,4-D发酵7天和KT 11天处理的桑黄菌丝体生物量最高,与其他处理间差异显著。
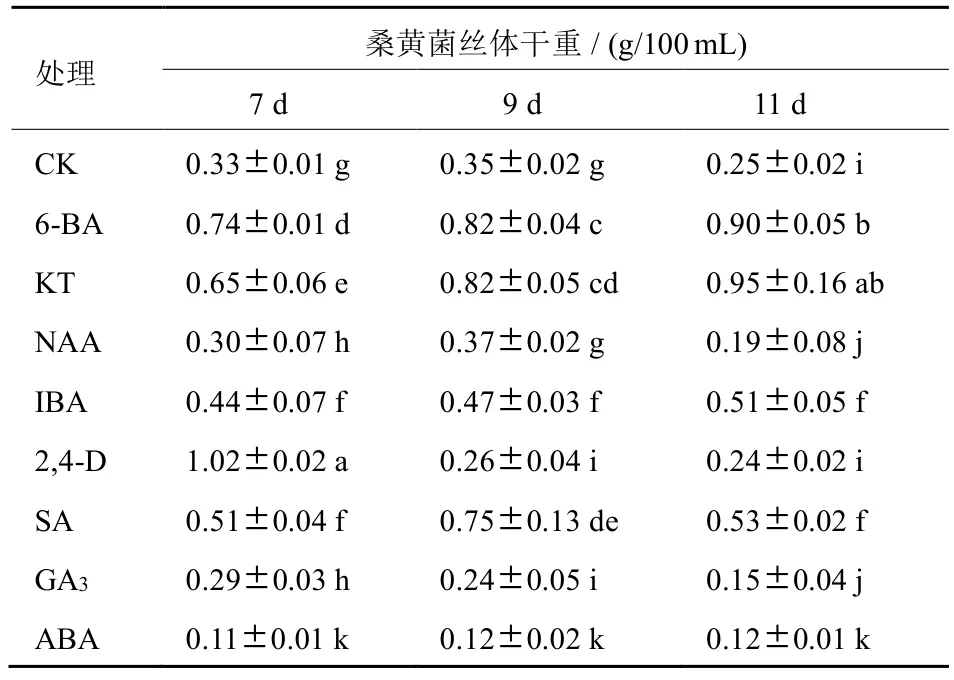
表1 不同植物生长调节剂处理的桑黄菌丝体生物量
综合比较,添加6-BA、KT、IBA、SA、2,4-D处理与CK相比,均能促进桑黄菌丝体生物量增加,尤其6-BA和KT处理,100 mL培养液菌丝最大生物量分别达0.90 g、0.95 g,是CK最大生物量0.35 g的2.6倍和2.7倍;2,4-D在第7天的生物量达到1.02 g/100 mL,是CK最大生物量的2.9倍。NAA无明显影响,而GA3和ABA处理引起桑黄菌丝体生物量下降。
2.3 植物生长调节剂对桑黄菌丝体胞内黄酮含量的影响
在接种后第7、9、11天分别过滤发酵液,获得桑黄菌丝体后测定胞内黄酮含量(图2)。结果显示,与CK相比,发酵培养第7天时,各处理菌丝体胞内黄酮含量接近,无明显差异;第9天时,各处理黄酮含量均提高,以2,4-D处理最高,为32.7µg/mL,是对照含量8.1 µg/mL的4倍;到第11天,KT、6-BA、NAA、IBA处理及CK的黄酮含量达到峰值,以KT处理含量最高(35.8 µg/mL),为对照处理(27.4 µg/mL)的1.3倍,而SA、GA3、ABA处理的含量下降且低于CK。可见,植物生长调节剂的调控效果受发酵时间的影响。
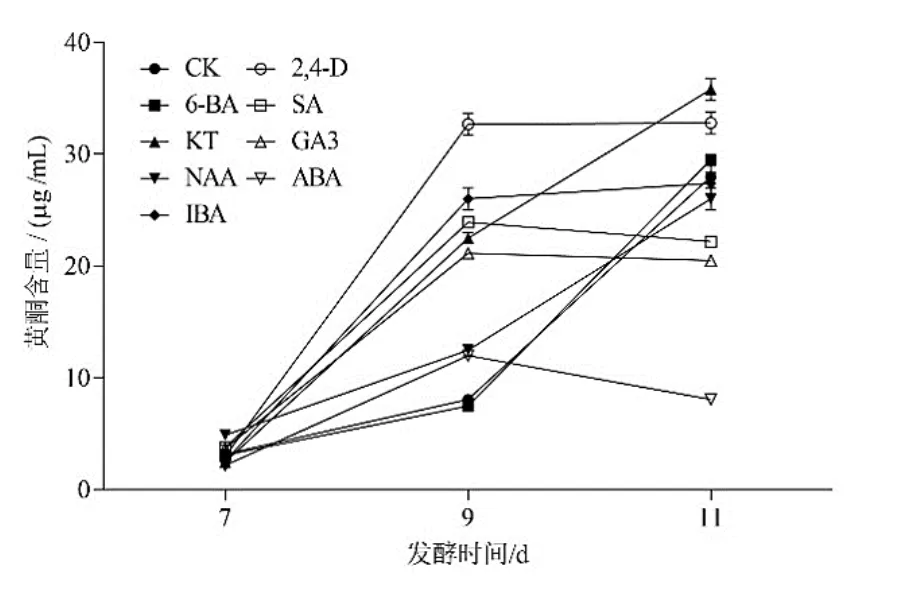
图2 不同植物生长调节剂处理桑黄胞内黄酮含量的变化
综合来看,2,4-D、KT、IBA、6-BA在发酵第7~11天均表现出显著促进桑黄胞内黄酮含量的作用效果。其中,6-BA主要是在第9~11天作用明显,SA、GA3、ABA则在第7~9天内有提升效果。
2.4 植物生长调节剂对桑黄菌丝体胞内黄酮产量的影响
取发酵第11天时桑黄菌丝体干重与胞内黄酮含量,计算菌丝体胞内黄酮产量并进行比较。结果显示,细胞分裂素KT、6-BA处理桑黄胞内黄酮产量分别为339.7 mg/L和266.4 mg/L,显著高于其他处理和CK(69.9 mg/L)(P<0.05),IBA和SA处理其次,NAA、2,4-D处理与CK间差异不显著,GA3和ABA处理显著低于CK(图3)。
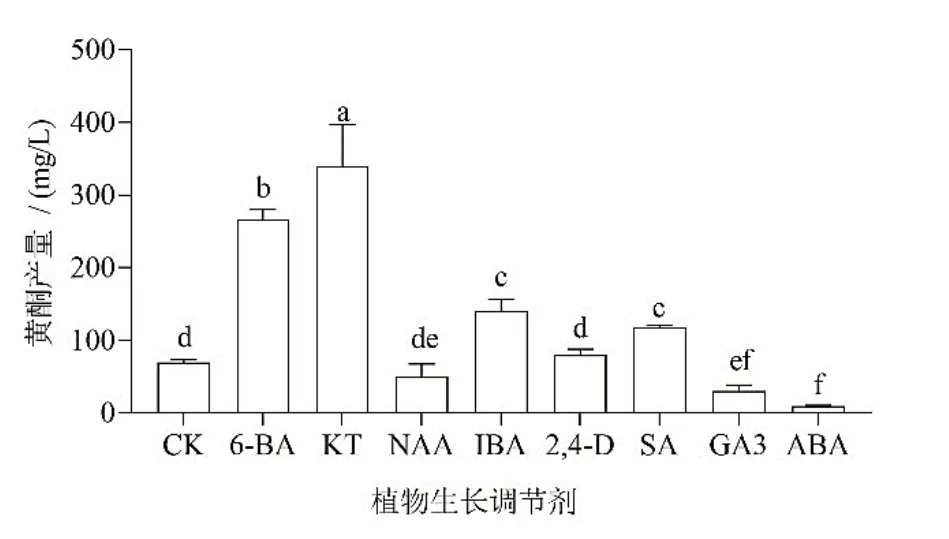
图3 不同植物生长调节剂处理桑黄菌丝体的胞内黄酮产量
3 结论与讨论
世界范围内桑黄孔菌属有14种[2],本研究所用桑黄菌株为桑树桑黄(Sanghuangporus sanghuang)。研究表明,桑树桑黄在活性成分含量及抗氧化等药理作用上都优于暴马桑黄(S.baumii)、杨树桑黄(S.vaninii)等种[21-22]。
本研究比较了8种植物生长调节剂作为外源诱导因子对桑黄液体发酵菌丝体生物量及其胞内黄酮含量的影响。结果表明,与CK相比,除ABA和GA3处理抑制桑黄生长、NAA无明显影响外,其余植物生长调节剂都能促进桑黄菌丝体生物量的提升,但发酵不同时期作用效果差异较大;胞内黄酮含量,各植物生长调节剂的调控效果同样受发酵时间的影响。综合来看,与CK相比,KT、6-BA、IBA、SA均能显著提高桑黄胞内黄酮产量(P<0.05),GA3、ABA抑制桑黄黄酮代谢,NAA、2,4-D无明显影响。其中,KT、6-BA和IBA在培养7~11天中能持续促进菌丝体生物量和胞内黄酮含量的增加,尤其KT处理,在发酵11天时,菌丝体生物量和胞内黄酮含量分别是对照CK最高值时的2.7倍和1.3倍,显著高于其他处理。因此,在桑黄液体发酵培养中添加KT有助于提高黄酮产量,但具体添加量及添加形式还需要进一步深入研究。
本试验中,发酵9天时桑黄菌丝体胞内黄酮含量8种植物生长调节剂处理都高于CK,其中6-BA处理含量是CK的1.1倍,接近王然等[19]研究结果的1.76倍。桑黄菌丝体胞内黄酮产量,根据发酵11天的计算结果,6-BA、KT、SA、IBA处理的黄酮含量均显著高于CK,最高的KT、6-BA处理分别达到CK的4.86和3.81倍,而GA3、ABA处理的含量显著低于CK,与雷萍等[17]采用5~10 mg/L的ABA处理使桑黄发酵液中黄酮含量增加3倍结果相反,这可能与ABA的使用浓度不同有关。

