lncRNA调控miRNA及其在心房颤动中的研究进展
向 锦,杜杨美,贾冬霞,刘思泰
(1.川北医学院,四川 南充 637000;2.四川绵阳四○四医院全科医学科,四川 绵阳 621000)
心房颤动(AF)指心房无序地乱颤,它会增加缺血性脑卒中和心衰的风险,是心血管疾病致死率和致残率的重要原因,并给公共卫生带来沉重的负担,截至2019年估算全球约有5 970万AF患者[1]。AF的发病机制尚未完全清楚,主要与高龄、遗传、性别、肥胖、吸烟、高血压、糖尿病、阻塞性睡眠呼吸暂停、代谢综合征等诸多因素引起的心房电重构和结构重构有关。非编码RNA是近年来分子生物学研究热点之一,相关研究显示:非编码RNA在AF的电生理机制和病理生理学机制中发挥着重要作用,有望成为新的治疗靶点。本研究围绕AF的发生发展、微小RNA(miRNA)及长链非编码RNA(lncRNA)对AF的调控、lncRNA调控miRNA在AF中的作用进行综述。
1 AF与心房重构
心房重构早期表现以离子通道及电生理特征改变为主,这一电生理功能的改变过程对AF的触发与维持发挥着关键作用;重构晚期表现则以心房肌细胞及细胞外基质纤维化等组织结构改变为主,心房纤维化及其导致的传导减慢和传导异质性增加被认为是AF持续的原因;这两过程并非割裂,而是互相成就。心房纤维化机制中成纤维细胞(CF)激活为肌成纤维细胞是关键的一步,并且肌成纤维细胞还可通过旁分泌引起心肌细胞离子通道蛋白表达的改变,其中L型钙通道蛋白Cav1.2表达的下调是心房重构的标志之一[2-4]。Li等[5]研究显示肌成纤维细胞衍生的外泌体能够抑制心肌细胞中Cav1.2表达来增加AF易感性。此外AF易感性增加还与离子通道蛋白Kv4.3、Kv1.5等的下调相关[6]。近年来,对心外膜脂肪组织(EAT)的研究正在迅速增加,它通过脂肪浸润相邻心房心肌和旁分泌作用增加心房纤维化作用,其在AF发病机制中的作用越来越得到重视。Nalliah等[7]研究发现心外膜脂肪组织可使心房传导速度减慢、产生更大的碎裂电位、增加纤维化,随着脂肪浸润发展增加心房传导异质性,并且通过脂肪组织分泌因子破坏肌细胞间机电完整性的蛋白质来降低传导速度。同时心外膜脂肪有通过分泌细胞外囊泡来促纤维化的独特特征[8],这些变化在与心外膜脂肪富集相邻的区域更为明显[9]。另外,淀粉样变致心房电和结构重构作用也不可忽视。Sukhacheva等[10]研究发现淀粉样变性程度与CMC肌原纤维丢失呈正相关。除了改变心房电生理特性外[11],有研究表明转甲状腺素淀粉样蛋白对心房壁的浸润可致心房硬度增加并使其功能进行性丧失,影响患者预后[12]。此外,包括心房细胞凋亡同样参与了AF的发病机制。中脑星形胶质细胞衍生的神经营养因子下调[13]、肌球蛋白轻链 4基因变异[14]、长期高脂饮食[15]等均可能与AF更多的心房细胞凋亡相关。
2 miRNA
表观遗传在AF的发展中起着重要作(图1)。微小核糖核酸(miRNAs)是一长度约为16~29个核苷酸的核苷酸序列,属于内源性小分子非编码RNA,它靶向靶基因mRNA的3'非翻译区(3'-UTR),转录后通过翻译阻遏和降解mRNA两种机制调节基因表达[16]。多个miRNA被证明参与了心房纤维化的病理生理过程。如较为熟知的miR-1和miR-133(在电重构中)和miR-34a(在心纤维化中)。

图1 表观遗传在心AF动的发展中起着重要作用
2.1miRNAs与心房电重构:L型Ca2+电流 (ICa,L)密度的降低是心肌电重构的标志。心房心肌细胞中miR-155表达的增加能降低ICa,L的密度和潜在的电子重构,抑制miR-15可防止AF中与ICa,L相关的电重构,使之可能成为一种针对电重构的新型抗AF方法[17]。过表达的miR-221和miR-222同样被证实降低了L型Ca2+通道和Kcnj5通道的表达和电流密度,它们均靶向CACNA1C和Kcnj5的3'-UTR,可能有助于干扰心脏兴奋的产生和传播[18]。通过调节miR-34a,衔接蛋白Ankyrin B(Ank B)和钠钙交换剂1(在Ca2+稳态中重要的Ank-B结合伙伴)的表达水平及Ca2+信号传导水平发生了改变表达,说明miR-34a可能通过调节Ank-B表达在早期电生理重塑和AF发展中发挥重要作用[19]。见图2。

图2 miRNAs及lncRNAs在心AF动电重构中的作用
2.2miRNAs与心房结构重构:心房纤维化在AF发生发展中起关键作用。miRNA通过介导一系列病理生理改变调节心房胶原蛋白-Ⅰ(collagen-Ⅰ)和胶原蛋白-Ⅲ(collagen-Ⅲ)的水平促进AF纤维化进展。因此,通过干预这些小分子的产生和分泌可能有助于AF的治疗。Lv等[20]的研究表明,过表达miR-27b-3p减轻心房纤维化同时还可以降低AF的发生率和持续时间,并降低collagen-Ⅰ、α平滑肌肌动蛋白(α-SMA)、collagen-Ⅲ、转化生长因子-β(TGF-β1)、Wnt3a的表达,此外还通过荧光素酶活性测定发现Wnt3a是HEK 293T细胞中被验证的miR-27b-3p靶点,以参与调节Wnt/β-Catenin信号通路,在AF纤维化抑制中发挥保护作用。另一分子miR-29b-3p同样可降低心房纤维化程度,降低collagen-Ⅰ和α-SMA等纤维化标志物的表达,并增加连接蛋白Cx43的表达,降低靶基因血小板源性生长因子B(PDGF-B)的表达,并通过此信号通路靶向调节[21]。miR-450a-2-3p的过表达可抑制成纤维细胞中丝裂原活化蛋白激酶1(MAPK1)的表达,从而抑制了α-SMA、collagen-Ⅰ和collagen-Ⅲ并防止CF增殖[22]。Su等[23]发现miR-96在心房组织中与collagen-Ⅰ和collagen-Ⅲ水平呈正相关,通过敲低miR-96发现可减少血管紧张素Ⅱ(Ang-Ⅱ) 诱导的心脏CF增殖、迁移和胶原蛋白的产生从而减弱心房纤维化,并且还发现miR-96可抑制KLF13的表达来促进Ang-Ⅱ诱导的小鼠心脏成纤维细胞的增殖、迁移和胶原蛋白的产生。此外,人诱导多能干细胞衍生的心房心肌细胞-成纤维细胞共培养细胞模型中的miR-146b-5p转染通过调节基质金属蛋白酶TIMP4/MMP9介导的细胞外基质蛋白合成增加了胶原蛋白的合成,通过抑制小鼠模型miR-146b-5p,相关纤维化标志物显著下调,心肌梗死诱导的心脏纤维化减弱,表明抑制 miR-146b-5p可能成为预防心房纤维化的有效治疗方法[24]。miR-455-5p通过直接结合其靶基因细胞因子信号抑制基因3(SOCS3)导致信号转导和转录激活因子3(STAT3)信号通路的激活加速AF的进展,相反,抑制miR-455-5p表达可有效改善 AF[25]。
另外有大量研究表明miRNAs在AF作用中与TGF-β1或TGF-β1/Smads信号通路密切相关。Xu等[26]发现miR-324-3p直接靶向CF中的转化生长因子β1(TGF-β1)抑制CF增殖,可能通过PI3K/AKT信号通路发挥作用。Li等[27]发现miR-10a直接与参与细胞生长增殖的BCL6与3'-UTR结合,下调miR-10a可抑制胶原形成,减少心房结构重塑,减少CF的增殖,最终通过抑制TGF-β1/Smads信号通路减轻AF大鼠的心脏纤维化。而miR-21通过上调WW结构域蛋白1(WWP-1)使TGF-β1/Smad2信号通路失活,从而抑制心脏CF增殖[28]。另外发现miR-21在调节AF纤维化方面与先前Cao等[29]的研究似有矛盾,这有待更深入研究。miR-4443通过靶向血小板反应蛋白1(THBS1)保护AF并调节TGF-β1/α-SMA/胶原蛋白通路以抑制人心CF增殖和胶原蛋白合成[30]。通过上调miR-27b,可靶向ALK5使Smad-2/3通路失活,抑制collagen-I、collagen-III、纤溶酶原激活物抑制剂1(PAI-1)和α-SMA的表达来改善心房纤维化和AF[31]。miR-1202通过激活TGF-β1/Smad2/3通路靶向一氧化氮合酶(nNOS),促进人心脏CF转化为促纤维化表型[32]。Reilly等[33]发现人类AF中miR-31的心房特异性上调是导致心房肌营养不良蛋白和nNOS耗竭的关键机制,使动作电位持续时间及其速率失稳,从而增加AF 的可诱导性。还有miR 132直接靶向结缔组织生长因子(CTGF)抑制其表达来调节AF纤维化[34]。见图3。
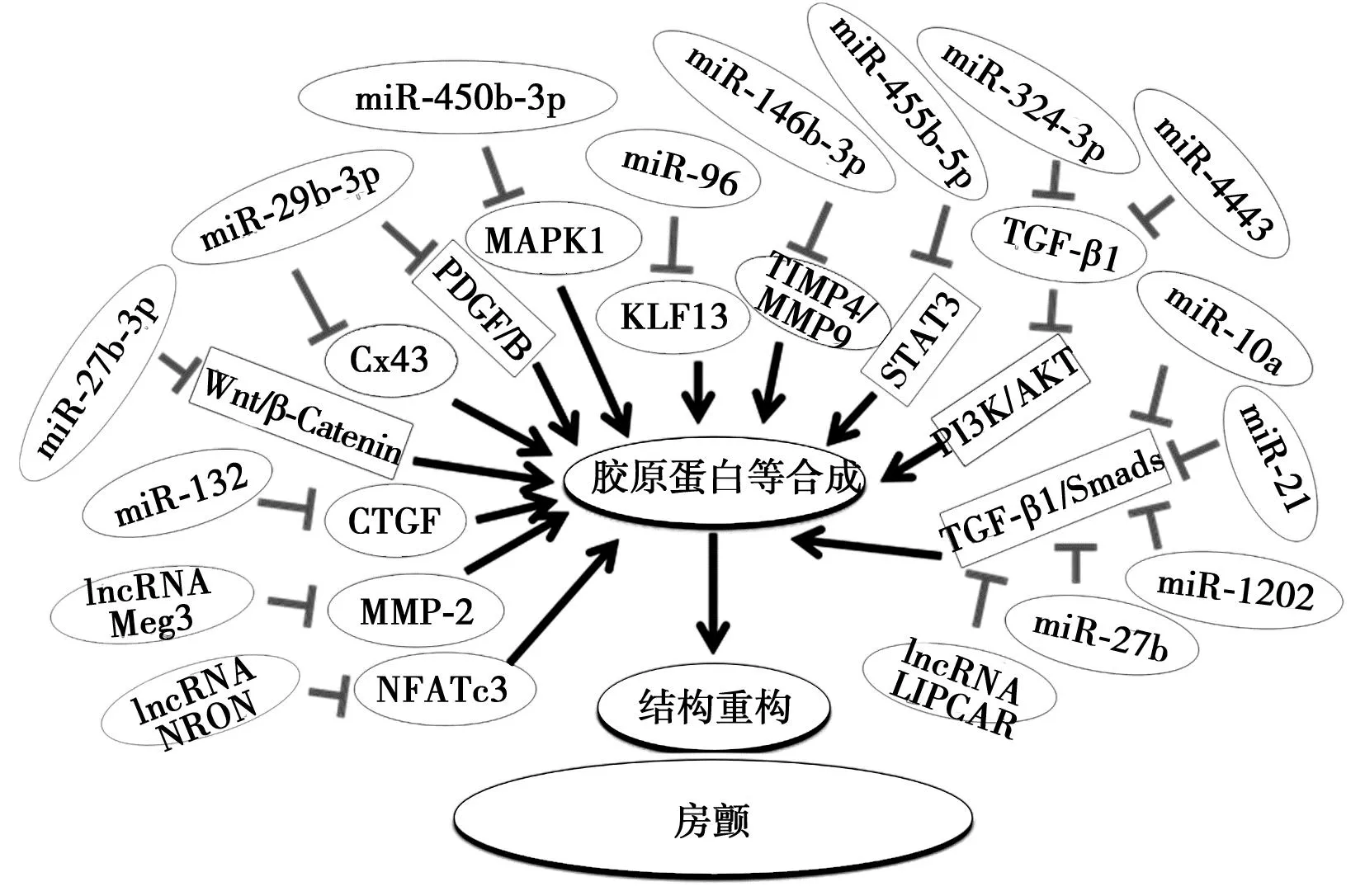
图3 miRNAs及lncRNAs在心房颤动结构重构中的作用
3 lncRNAs
长链非编码RNA(lncRNAs)是一类长度超过200个核苷酸的非编码RNA,虽然它不具备编码蛋白质的功能或仅能编码部分蛋白肽段,但是它在人类诸多疾病发展中扮演着重要角色[35]。许多研究报道在AF发病中lncRNAs可通过调控关键通路或核心蛋白发挥作用。
3.1lncRNA对心房电重构的调节:电重构主要通过缩短心房有效不应期和动作电位持续时间而发生,虽然不及结构重构中作用更加广泛,但lncRNA也参与了心房电重构。Li等[36]发现沉默lncRNA TCONS_00075467过后,体内心房动作电位和有效不应期缩短,体外L型钙电流和动作电位持续时间减少。说明失调的lncRNA可能在调节AF期间的电重构中起重要作用,并进一步证明了lncRNA TCONS_00075467可以在体外和体内海绵化miRNA-328以调节下游蛋白质编码基因CACNA1C(一种L型钙通道)来调节心房电重构[36](图2)。
3.2lncRNA对心房结构重构的调节:lncRNA Meg3主要由心脏CF表达,Piccoli等[37]发现lncRNA Meg3可调节基质金属蛋白酶 2 (MMP-2) 的产生,在晚期心脏重塑过程中发生转录下调导致MMP-2 转录下调,从而减少心脏纤维化并改善舒张功能。研究发现AF患者右心耳组织中lncRNA GAS5的表达明显低于窦性心律患者,ALK5作为GAS5的靶标,并表明lncRNA GAS5可以通过抑制ALK5来抑制AF细胞增殖[38]。Wang等[39]发现通过上调lncRNA LIPCAR促进了Ang Ⅱ对collagen-Ⅰ、collagen-Ⅱ、α-SMA和Smad2/3磷酸化水平、细胞活力和心房成纤维细胞增殖的促进作用,说明LICPAR通过调节TGF-β/Smad通路促进心房纤维化,而沉默LIPCAR则产生相反的作用。Wang等[40]研究则发现lncRNA NRON通过促进NFATc3磷酸化抑制成纤维细胞增殖,抑制collagen-Ⅰ和collagen-Ⅲ的表达,从而缓解心房纤维化(图3)。
3.3lncRNA对miRNA的调控:lncRNA 可作为micRNAs的海绵,在房颤发病机制中发挥重要作用。浆细胞瘤变异易位1(PVT1)是位于人类染色体8q24.21上的一个lncRNA,已被证明与肝纤维化有关。Cao等[41]通过体外试验发现lncRNA PVT1可作用于miR-128-3p促进 Sp1 表达参与TGF-β1/Smad信号通路,进一步行体内试验发现PVT1 敲低可减弱小鼠心房纤维化,进而说明lncRNA PVT1可通过miR-128-3p-SP1-TGF-β1-Smad轴促进心房纤维化。提示lncRNA PVT1可能成为AF治疗的靶点。另外,Yang等[42]发现miR-23b-3p 和 miR-27b-3p分别靶向TGF-β1受体3(TGFBR3)的 3'-UTR中的两个不同位点,同样激活成纤维细胞中的Smad3信号传导以促进心房纤维化。Guo等[43]发现lncRNA H19通过抑制miR-29a-3p/miR-29b-3p-VEGFA/TGF-β轴促进CF增殖和α-SMA、collagen-Ⅰ、collagen-Ⅱ、MMP-2等合成促进AF纤维化。此外,荧光素酶基因检测结果显示miR-133a-3p直接受lncRNA心肌梗死相关转录物(MIAT)靶向调控。lncRNA HOTAIR正向调节连接蛋白43(Cx43)的表达,而miR-613可减弱lncRNA HOTAIR 对 Cx43 表达的上调作用,此外,HOTAIR可以明显减轻miR-613对Cx43表达的抑制作用,通过荧光素酶测定证实lncRNA HOTAIR 通过海绵化miR-613上调Cx43表达从而抑制心房重塑[44]。lncRNA MIAT下调可致胶原蛋白减少和抑制collagen-Ⅰ、collagen-Ⅲ、结缔组织生长因子(CTGF)和TGF-β1来缓解AF,增加心房有效不应期(AERP),并减少AF持续时间以及心肌细胞凋亡,而抗miR-133a-3p则逆转lncRNA MIAT下调带来的这些影响[45]。Guo等[46]发现lncRNA TUG1的敲低抑制了AngII诱导的CF增殖,并且作为miR-29b-3p 的竞争性内源性RNA(ceRNA)发挥作用,通过调节miR-29b-3p/TGF-β1轴来抑制CF增殖。此外,荧光素酶报告基因检测和全细胞膜片钳记录证实lncRNA TCONS-00106987可通过与miR-26的内源性竞争促进电重构,以诱导其靶蛋白基因KCNJ2的转录,从而增加内向整流子K+电流(IK1),心房有效不应期缩短,使体内AF诱导率增加[47]。lncRNA XIST是miR-214-3p的竞争性内源性RNA(ceRNA),可触发其靶基因Arl2的上调,沉默Arl或过表达miR-214-3p可逆转XIST对炎症和细胞焦亡的影响。Yan等[48]发现lncRNA XIST通过吸收miR-214-3p促进Arl2表达来抑制AF中心肌细胞焦亡。对房颤关键基因的挖掘一直是重点,Zhao等通过差异表达基因发现BIRC5可能作为AF的相关基因,其可通过受lncRNA NPHP3-AS1调节的miR-1285-3p调控。lncRNA NRON 的过表达通过抑制心房肌细胞中的NFATc3核转运来抑制miR-23a 的表达,使心房肌细胞衍生的外泌体中miR-23a的水平降低,促进M2巨噬细胞极化并减轻心房纤维化[49]。Shen等[50]的研究发现由YY1基因诱导的lncRNA KCNQ1OT通过与miR-384结合促进CACNA1C的上调,来调节AngⅡ诱导的AF,影响AF的传导与持续时间。
4 总结与期望
表观遗传修饰已经引起诸多领域的关注,这一重要的生物学过程可能作为关键步骤影响疾病发生发展。然而,表观遗传因素的性质和其在AF中的作用是模糊、复杂多变的。近来,全基因组测序技术的飞速发展和表观遗传学研究的显著进展,许多表观遗传学因素被发现,其有可能成为多种疾病和再生医学的治疗靶点。值得关注的是,虽然本研究中几乎全部均表明相应分子生物层面观察到与AF的相应联系或后续表达变化,但似乎仍存在这样一种情况,即AF病因繁多,影响因素众多,具有个体化特征,大部分试验没有进一步观察说明这些影响因素是否达到足够引起在临床上明显表型变化的程度。另外,有少许研究观察到同一分子通过不同途径对AF纤维化产生相反结果,这些对AF进一步的干预带来困扰。本研究讨论了miRNA与lncRNA 及其相互在AF中的作用,尽管大量的miRNA、lncRNA已被确定与AF发生发展相关,但只有一小部分功能被阐明。在AF形成中各种表观遗传因素之间存在着相互作用的网络,单一的miRNA或lncRNA不可能对AF发生发展起决定性作用或者说对临床症状负责,因此需要对相应表观遗传的网络进行深度探索。总之,分子生物学作为近年来的热点,期望有更多专注于AF治疗和预防的研究从基础研究走向临床研究,造福患者。

