中枢神经系统孤立性纤维性肿瘤的临床病理特征(附12例分析)
乌肖林,李慧,王朝夫,程平,张本炎
1 山东大学第二医院病理科,济南 250000;2 上海交通大学医学院附属瑞金医院病理科;3 安徽中医药大学第一附属医院病理科
孤立性纤维性肿瘤(solitary fibrous tumor, SFT)是一种纤维母细胞性间叶源性肿瘤,由WAGNER 于1870年首次在胸膜中发现,并对其组织学特征进行了描述,之后在软组织和其他许多器官中都有报道。SFT 可发生于身体的任何部位,但发生于中枢神经系统的较少见,约占所有中枢神经系统肿瘤的1%[1]。研究[2]显示,与非中枢神经系统的SFT 相比,中枢神经系统SFT预后较差,复发及转移概率较高。目前,部分病理医师缺乏对SFT的认识,在诊断上容易被忽视而引起误诊及漏诊。2013年1月—2022年2月,上海交通大学医学院附属瑞金医院收治中枢神经系统SFT 患者12 例,现对其临床病理资料作回顾性分析,总结中枢神经系统SFT的临床病理特征。
1 资料分析
1.1 临床材料 12 例中枢神经系统SFT 患者,男6例、女6 例,发病年龄28~78 岁,平均年龄52 岁。12 例患者中,6 例肿瘤发生于颅内、4 例发生于椎体(2例发生于颈椎、2例发生于胸椎)、2例为颅外转移的SFT(1 例转移灶位于胰腺,1 例转移灶位于左肝,分别于10年前及7年前在外院接受脑部SFT切除)。12 例患者中,4 例为复发病例,2 例位于颅内,1 例位于颈椎,1例位于胸椎。6例肿瘤位于颅内的患者临床主要症状为头痛头晕;4 例肿瘤位于椎体的患者临床主要症状为肢体麻木、无力;转移灶在胰腺的患者临床以腹痛为主要症状,转移灶在肝脏的患者临床以复查发现肝脏占位就诊。
1.2 病理资料 12 例患者均接受手术切除治疗,留取手术标本进行病理检查。手术切除的标本大部分为碎组织,切面灰白,质地中等,肿瘤最大径为5.0~7.0 cm,椎体肿瘤相对较小,最大径为0.8~2.0 cm。12 例患者中,WHO1 级4 例,包括2 例首发病例及2例复发病例;WHO2级2例,包括1例第3次复发的病例及1 例肝脏转移病例;WHO3 级6 例,包括4 例首发病例、1 例复发病例及1 例胰腺转移病例。手术标本在镜下表现为无固定的排列方式,组织学改变多样,大部分肿瘤见“鹿角样”的分支薄壁血管,呈血管外皮瘤样改变(图1A);部分区域可见囊性变、出血及血管扩张,个别血管内可见血栓形成,肿瘤细胞间局部见胶原纤维,局灶呈瘢痕样改变、水肿或黏液变性,肿瘤可见细胞丰富区及稀疏区,细胞呈圆形、卵圆形、多角形或梭形,细胞界限不清,大部分肿瘤细胞胞质少,少量肿瘤细胞胞浆丰富,略透明,细胞核染色质略粗、边集,部分肿瘤细胞可见小核仁,个别细胞退变明显,随着级别的升高,核分裂像越来越多(图1B);WHO3 级肿瘤可见坏死(图1C)。复发3次发生在右侧顶叶的病例最后两次病理检查结果均为WHO2 级,核分裂像约6 个/10 HPF,细胞核均卵圆形,染色质略粗,可见小核仁,部分胞浆透亮,可见胶原纤维增生,但后一次较前一次细胞核异型性更加明显。复发2 次发生在胸5 椎管内的病例后两次病理级别不同:前一次病理为WHO2 级,核分裂像约8 个/10 HPF,后一次病理为WHO3级,细胞密度较前一次略丰富,核分裂像明显增多,约15个/10 HPF,并见灶状坏死。发生在椎体的大部分肿瘤间见多量胶原纤维增生,而发生在颅内的肿瘤较少见胶原纤维增生。免疫组化检测结果显示,12 例患者肿瘤细胞均弥漫表达STAT6;10 例肿瘤细胞不同程度的表达CD34,2 例肿瘤细胞不表达CD34(其中1 例为首发病例;1 例为肝脏转移病例,肝脏转移病灶CD34 阴性,但该病例颅内原发病灶CD34阳性);10例肿瘤细胞不同程度的表达Bcl-2;12 例肿瘤细胞弥漫性表达或部分性表达CD99;WHO1 级的肿瘤细胞Ki67 增殖指数5%~10%,WHO2 级的肿瘤Ki67 增殖指数5%~20%,WHO3 级的肿瘤Ki67 增殖指数10%~50%,随着肿瘤级别的升高,Ki67增殖指数明显升高。
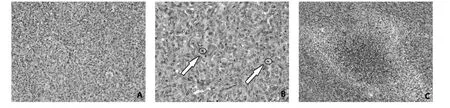
图1 1例中枢神经系统SFT患者的病理检查结果(HE染色)
1.3 治疗及随访 12 例患者均接受手术切除治疗,术后随访9~273 个月,其中1 例首发WHO3 级患者术后接受放疗,其余患者术后均未行放、化疗;颅内的4 例首发病例除1 例失访外,其余3 例随访9~70 个月均未复发;颅内的2 例复发病例随访188~273 个月,分别复发1 次及3 次;椎体的2 例首发病例随访66 个月及70 个月,均未复发;椎体的2例复发病例,1例死亡,1例失访;转移至胰腺的病例随访123 个月,首次术后47 个月出现肝转移,100 个月出现胰腺转移,胰腺转移术后又发生转移,未行特殊治疗;转移至左肝的病例随访91 个月,首次术后66 个月出现腹膜后转移,69 个月出现髂骨转移,88个月出现肝转移,肝转移术后3个月死亡。
2 讨论
1931年,KLEMPERER 和RABIN 提出将SFT 作为一种独立的肿瘤实体[3]。在中枢神经系统中,BEGG 等[4]1954年首次报道发生于脑膜的血管外皮细胞瘤(hemangiopericytoma,HPC),CARNEIRO等[5]1996年首次报道了发生于脑膜的SFT,二者在显微镜下的形态特征均与软组织的SFT 表现一致。SFT 和HPC 以前被列为两种独立的肿瘤实体,近几年分子遗传学研究[6]发现,SFT 和HPC 具有相同的分子特征,即12q13 的倒置形成融合基因NAB2-STAT6,研究提示SFT 与HPC 实为同一肿瘤谱系,故第五版WHO(2021)中枢神经系统肿瘤的分类中去除了“HPC”这一术语,与软组织肿瘤病理诊断术语统一,统称为SFT,分为3 个级别[7],WHO1 级:肿瘤细胞排列稀疏,无明显异型性,核分裂象<2.5个/mm2(5 个/10 HPF);WHO2 级:肿瘤细胞稍密集,具有一定异型性,核分裂象≥2.5 个/mm2(5 个/10 HPF),不伴坏死;WHO3 级:肿瘤细胞密度高,异型性更明显,核分裂象≥2.5 个/mm2(5 个/10 HPF),且伴坏死。
SFT 在软组织和其他许多器官中都有报道,可发生于身体的各个部位,如胸膜、眼眶、肝脏、卵巢、骨、肾上腺、膀胱、甲状腺、胃、肺、纵隔、盆腔、腹膜后、前列腺等[8-12],而发生于中枢神经系统较少见,约占所有中枢神经系统肿瘤的1%[1],成年人多见,40~60岁高发,男性发病率略高。本研究12例患者中,男性6 例、女性6 例,性别未见差异,发病年龄28~78 岁(中位生存年龄42 岁,平均年龄52 岁),与文献[13-14]报道基本一致。临床表现与发病部位有关,本研究中肿瘤位于颅内的大部分患者临床主要症状为头痛头晕,肿瘤位于椎体的大部分患者临床主要症状为肢体麻木、无力;转移灶在胰腺的患者临床以腹痛为主要症状,转移灶在肝脏的患者临床以复查发现肝脏占位就诊。
SFT 特征性的形态为血管外皮瘤样的生长方式和不同程度的胶原纤维增生,但是SFT 也可以表现出其他形态,包括巨细胞、黏液样区域、多形性、脂肪瘤样和去分化区域。按照第五版WHO(2021)中枢神经系统肿瘤分类诊断标准对本研究中12 例患者进行重新分级,其中WHO1 级4 例,包括2 例首发病例及2例复发病例;WHO2级2例,包括1例第3次复发的病例及1 例肝脏转移病例;WHO3 级6 例,包括4 例首发病例、1 例复发病例及1 例胰腺转移病例。其中复发3 次发生在右侧顶叶的病例,最后两次病理虽然最终诊断均为WHO2 级,核分裂像均约6个/10 HPF,但后一次较前一次细胞核异型性更为明显;复发2次发生在胸5椎管内的病例后两次病理级别不同:前一次病理为WHO2 级,后一次病理为WHO3 级,细胞密度较前一次略丰富,核分裂像由8个/10 HPF 增加到15 个/10 HPF,并见灶状坏死。通过本次研究,我们发现在椎体的大部分肿瘤间可见大量胶原纤维增生,而发生在颅内的肿瘤较少见胶原纤维增生。
免疫组化指标对SFT 的诊断具有重要的意义,肿瘤细胞一般表达STAT6、CD34、CD99、Bcl-2,一般不表达CK、EMA、S-100、SMA、PR 等。SFT 存在特异性的NAB2-STAT6 基因融合[6],从而导致STAT6 蛋白过表达,故STAT6 强而弥漫的核阳性是诊断SFT的一个非常有意义的指标。多项研究[15-18]表明,运用免疫组织化学法检测STAT6 蛋白的表达情况能间接反映NAB2-STAT6 融合基因的信息,基本可以代替融合基因的检测。STAT6 核表达并不是SFT 独有的,在其他肿瘤中也有报道,如星形细胞瘤(IDH突变型,WHO4 级)、去分化脂肪肉瘤、滤泡性淋巴瘤、低度恶性纤维黏液样肉瘤[19-21]。本研究中12 例患者肿瘤细胞均弥漫表达STAT6,10 例肿瘤细胞不同程度的表达CD34,10 例肿瘤细胞不同程度的表达Bcl-2,12 例肿瘤细胞弥漫性表达或部分性表达CD99。2 例CD34 阴性的病例中1 例为首发WHO1级的病例,患者随访66 个月,无复发;1 例为肝脏转移病例,肝脏转移灶术后3个月死亡,该病例颅内原发病灶CD34 阳性。DERMAWAN 等[22]报道,CD34阴性的SFT更常见于头颈部,更易发生转移,并发现部分转移的CD34 阴性病例,原发灶CD34 呈弥漫性强阳性,结合本研究中1 例CD34 阴性的转移病例,我们认为CD34 表达丢失在疾病进展(SFT 级别升高或转移)的过程中可能发挥重要的作用,CD34 表达缺失在SFT发展过程中的作用及其分子机制需待后续更加深入的研究和探讨。
在SFT 中也偶尔表达有上皮源性、肌源性或神经内分泌等标记物,导致与其他血管外皮瘤样生长模式的肿瘤相混淆。在临床特征、组织学形态及免疫组化表型不典型的情况下,需要进行NAB2-STAT6 融合基因的检测来最终确诊。由于12 号染色体上的NAB2 与STAT6 基因相距较近,NAB2 与STAT6 基因融合的检测不适合做荧光原位杂交(FISH),可通过逆转录聚合酶链反应(RT-PCR)或二代测序(NGS)检测[23]。
SFT 需与以下肿瘤进行鉴别:①纤维型脑膜瘤:两者在临床、影像学及组织学上有时极其相似,但纤维型脑膜瘤血管外皮瘤样结构不常见,免疫组化标记SSTR2A、EMA 及PR 阳性,STAT6 及CD34 阴性;②原发性和转移性单相型滑膜肉瘤:肿瘤细胞常可见血管外皮瘤样排列结构,瘤细胞间可见多少不等的胶原,免疫组化标记显示两者均可表达Bcl-2 和CD99,但SFT 表达CD34 和STAT6,而滑膜肉瘤均不表达CD34 和STAT6,并具有特征性的SS18(SYT)-SSX 融合基因;③间叶性软骨肉瘤:肿瘤原始的小圆细胞成分及有时呈血管外皮瘤样的表现与SFT相似,但间叶性软骨肉瘤内含有软骨岛,免疫表型S100、D2-40 阳性,STAT6 阴性,分子检测显示有HEY1-NCOA2 融合基因;④神经鞘瘤:经典神经鞘瘤组织学通常可见致密区及疏松区,常伴有出血、囊性变和组织细胞浸润,致密区细胞核呈栅栏状排列,肿瘤以致密区为主时需与SFT 相鉴别,在两者形态难以区分时,免疫组织化学检测结果具有重要作用,神经鞘瘤通常弥漫表达S-100 和SOX10,而不表达STAT6、CD34;⑤胶质肉瘤:需与3 级的SFT 鉴别,两者均可见坏死,但胶质肉瘤可见胶质成分,微血管增生具有特征性,GFAP 局灶阳性,S-100 阳性,STAT6阴性;⑥恶性黑色素瘤:瘤细胞表达S-100、SOX10、HMB45和Melan-A等黑色细胞标记,不表达STAT6。
在疾病发展过程中,10%~30%的SFT 表现为局部复发和远处转移,其中10%~40%复发发生在5年后,发生在15年后的复发病例比较罕见[24]。较高的局部复发率是头颈部SFT 的重要特征,需要长期随访。有文献[25]报道,由于解剖结构的特殊性,对不良预后潜在影响较大的因素是切缘状态。研究[26]发现,SFT 组织形态学出现显著的玻璃样变性、黏液样变性、水肿、坏死、出血以及脑实质和骨骼侵犯提示预后不良,易复发及转移。当出现脑实质及颅骨的侵犯,由于肿瘤可能不能被完全切除,肿瘤的复发风险显著增加,是预后不良的主要因素[27]。与非中枢神经系统原发的SFT 相比,中枢神经系统原发的SFT预后较差[2]。本研究中12例患者随访9~273个月,其中6 例为复发转移病例,比例占50%,与文献报道基本相符。WHO1级的4个病例,其中1例随访188 个月复发一次,其余3 个病例均未复发及转移,预后相对较好;WHO2级的2个病例,1例多次复发,1 例为转移病例,转移病例的随访结果为死亡;WHO3 级的6 个病例除1 例失访外,1 例死亡,1 例转移,其余3例均未复发转移,这可能随访时间较短有关,但WHO2 级及WHO3 级病例的总体预后较WHO1 级的病例差。另外我们发现,复发及转移的病例再次复发和转移的概率很大,且预后差。3 例复发病例,1 例失访,2 例多次复发,复发2 次发生在胸5 椎管内的病例两次复发病理显示肿瘤的分级明显升高,随访结果显示患者死于该疾病。2 例转移病例,其中1例WHO3级转移至胰腺的病例随访123个月,首次术后47个月出现肝转移,100个月出现胰腺转移,胰腺转移术后又有转移;1 例WHO2 级转移至左肝的病例随访91个月,首次术后66个月出现腹膜后转移,69 个月出现髂骨转移,88 个月出现肝转移,肝转移灶术后3个月因该疾病去世,随着随访时间的延长,转移及复发的风险明显增加。第徐婉妮等[26]汇总的126 个中枢神经系统孤立性纤维性肿瘤的病例结论显示2级和3级的病例预后较1级差,易出现复发和转移。第五版WHO(2021)中枢神经系统肿瘤关于SFT 的ICD-O 编码为1,为交界性病变,组织学根据核分裂像及坏死两个指标分为3级。结合本研究的病例随访结果及前期文献报道,我们认为将中枢神经系统的原发的SFT定义为交界性肿瘤并没有完全的体现该肿瘤的生物学行为。
治疗上,手术完全切除是治疗局限性SFT(包括局部复发性[28])的最佳选择;由于解剖部位的特殊性,术后联合放疗可显著延长肿瘤的复发时间及生存期;晚期病例可选择蒽环类药物化疗,但其治疗效果需要进一步的研究和分析[29]。
综上所述,SFT 是一种中枢神经系统少见的间叶源性肿瘤,组织形态多样,病理特征为血管外皮瘤样的生长方式和不同程度的胶原纤维增生,免疫组化指标对SFT 的诊断具有重要的意义,须结合组织形态、免疫表型做出最终诊断,必要时可基因检测辅助诊断。中枢神经系统原发的SFT 复发转移率较高,建议手术完全切除后辅助放疗。病理医生需掌握SFT 的组织形态学特点、免疫表型和特征性的分子改变,做出准确诊断。神经外科医生对中枢神经系统原发的SFT 术后治疗应积极,不能因为目前的WHO分类将其列为交界性肿瘤而放松警惕。

