不同原核表达载体对非洲猪瘟病毒CD2v蛋白可溶性表达及免疫反应性比较
冯梦珂,王星博,林璐璐,崔明仙,颜焰,周继勇*
(1.浙江大学动物医学中心,浙江 杭州 310058;2.农业农村部动物病毒学重点实验室,浙江 杭州 310058)
非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)引起的一种猪急性、出血性、烈性传染病,死亡率极高[1]。自20 世纪20 年代首次在肯尼亚被发现以来,ASF先后在非洲和亚欧大陆迅速传播,2018 年8 月我国辽宁省沈阳市报道首例ASF疫情,随后ASF在全国范围内大规模暴发流行[2]。由于缺乏有效的治疗手段和安全的疫苗,ASF对动物健康、食品安全、国民经济乃至生态环境都构成了持续的威胁[3]。
ASFV 基因组由一个170~190 kb 的双链DNA分子组成,病毒粒子呈现对称的二十面体结构,成熟病毒粒子包含多达68 种结构蛋白和100 多种非结构蛋白,其中结构蛋白对病毒感染研究及疫苗、诊断试剂研制的意义重大[4]。病毒粒子自外而内包括外囊膜、衣壳、内膜、核衣壳和基因组5 个部分[5],外囊膜由EP402R基因编码的CD2v 蛋白组成。CD2v是一种与T淋巴细胞表面黏附受体CD2相似的蛋白,由信号肽(1~16 个氨基酸)、胞外区(17~207个氨基酸)、跨膜区(208~228个氨基酸)和胞内区(229~375 个氨基酸)4 部分组成[6],CD2v 参与ASFV 宿主免疫应答、免疫逃逸和病毒复制等生理生化过程,是病毒诊断和疫苗研发的重要靶点蛋白[7]。用杆状病毒表达的CD2v 蛋白免疫可保护猪免于致死性感染[8],而且用CD2v蛋白免疫还可诱导猪产生特异性T细胞免疫反应[9]。
真核细胞和原核细胞均可用于外源基因的表达。真核表达系统表达的重组蛋白在结构和功能上更接近天然蛋白[10]。已有研究利用昆虫杆状病毒及CHO等真核表达系统对CD2v蛋白进行表达[11-13],其纯化蛋白能与临床ASFV抗体阳性血清反应。大肠埃希菌原核表达系统具有操作简单方便、表达周期短且成本低、蛋白表达水平高等优点,缺点在于所表达蛋白大多为包涵体,无法形成正确的三维结构,往往无生物学活性[14-16]。多个研究小组尝试利用原核表达系统来表达CD2v蛋白,但表达蛋白主要以包涵体形式存在[17-20],对包涵体进行溶解及镍柱亲和层析后,CD2v纯化蛋白与ASFV抗体阳性血清的免疫反应性较差[19];而纯化的CD2v 可溶性蛋白能够被ASFV 抗体阳性血清识别,具有良好的反应原性[18];蛋白质印迹法分析结果表明,表达的可溶性CD2v胞外区蛋白与ASFV抗体阳性血清具有良好的免疫反应性[17]。
综上所述,原核表达系统主要以包涵体形式表达CD2v 蛋白,包涵体蛋白的免疫反应性较差且纯化、复性难度较大,不利于蛋白的功能研究及应用。因此,把CD2v 蛋白与适宜的标签蛋白进行融合表达,筛选促进蛋白可溶性表达的载体,对CD2v蛋白的可溶性表达具有重要意义[21]。本研究基于5种不同的原核表达载体,筛选能促进CD2v 蛋白可溶性表达的最佳表达载体,通过临床ASFV 抗体阳性血清检测并比较可溶性CD2v 蛋白和包涵体CD2v 蛋白的免疫反应性,为原核表达可溶性CD2v 蛋白及探究其免疫原性奠定基础。
1 材料与方法
1.1 材料
高保真酶(货号P510-01)购自南京诺唯赞生物科技股份有限公司;异丙基硫代-β-D-半乳糖苷[isopropylthio-β-D-galactoside(IPTG),货 号15529019]、DNA 标志物(货号01112376)购自赛默飞世尔科技(中国)有限公司;聚合酶链反应(polymerase chain reaction, PCR)产物清洁回收试剂盒(货号2101050)、DNA 凝胶回收试剂盒(货号2003050)购自杭州新景生物试剂开发有限公司;DH5α和BL21(DE3)大肠埃希菌感受态细胞由本实验室制备;原核表达载体pET-28a、pET32a、pGEX-4T-1、pMAL-C6T 和pCold-TF 由本实验室保存;二辛可酸(bicinchoninic acid, BCA)蛋白浓度测定试剂盒(货号C503021-0500)购自生工生物工程(上海)股份有限公司;镍-氨三乙酸(nickelnitrilotriacetic acid, Ni-NTA)琼脂糖(货号30210)购自德国QIAGEN公司;辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗鼠IgG(货号074-1806)、HRP标记的羊抗猪IgG(货号14-14-06)购自美国KPL公司;质粒小提试剂盒(货号DP103-02)购自天根生化科技(北京)有限公司;其他生化试剂均为国产分析纯。临床ASFV 抗体阳性血清(病毒被灭活)和标准阴性血清由本实验室保存。
1.2 方法
1.2.1 原核表达质粒的构建与鉴定
根据GenBank 数据库中公布的非洲猪瘟病毒HLJ-2018 株(登录号MK333180.1)的序列信息,由杭州尚亚科技有限公司合成去除信号肽和跨膜区的非洲猪瘟病毒CD2v 蛋白(CD2vΔSP-TM)序列。将序列插入原核表达载体pET-28a,构建原核表达质粒pET28a-CD2vΔSP-TM。根据不同的原核表达载体设计引物,以pET28a-CD2vΔSP-TM 原核表达质粒为模板,通过PCR扩增CD2v序列后,将目的片段分别插入pCold-TF、pMAL-C6T、pGEX-4T-1 和pET-32a 原核表达载体,得到原核表达质粒pCold-TF-CD2vΔSP-TM、pMAL-C6T-CD2vΔSP-TM、pGEX-4T-1-CD2vΔSP-TM 和pET32a-CD2vΔSPTM。将上述原核表达质粒转化至DH5α大肠埃希菌感受态细胞中,涂板并挑选单克隆菌落,将PCR鉴定为阳性的菌液送至杭州尚亚科技有限公司进行测序,对测序正确的阳性菌液进行质粒抽提,用于后续原核表达实验。
1.2.2 CD2v 蛋白的原核表达与鉴定
将鉴定正确的质粒转化至BL21(DE3)大肠埃希菌感受态细胞中,涂板培养后,挑取单克隆菌落接种至LB 培养基中,于37 ℃活化,将活化后的菌液按照体积比1∶100 转接至含抗生素(100 μg/mL)的LB 液体培养基中,于37 ℃、200 r/min 条件下培养约4 h,待菌液在600 nm 处的吸光度值达0.6 时,向菌液中加入终浓度为1.0 mmol/L 的IPTG,于16 ℃、120 r/min 条件下培养16 h,诱导结束后离心收集菌液,在冰浴条件下超声破碎,离心后分别吸取上清液并保留沉淀,制备样品,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis, SDS-PAGE)后,用考马斯亮蓝R250进行染色,以检测重组蛋白的表达情况及存在形式。各载体标签及CD2v重组蛋白分子量如表1所示。
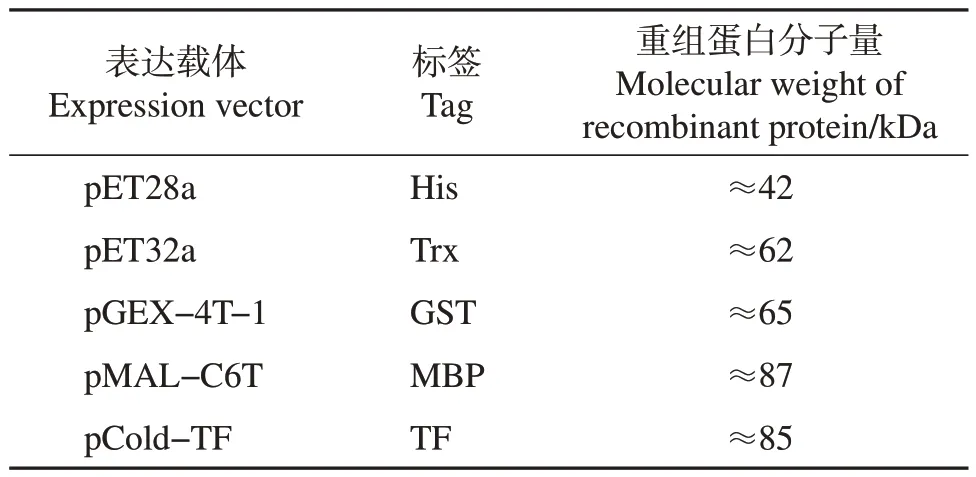
表1 不同原核表达载体标签及重组蛋白分子量Table 1 Different prokaryotic expression vector tags andmolecular weights of recombinant proteins
1.2.3 CD2v 蛋白的纯化与鉴定
离心收集经低温诱导后的pCold-TFCD2vΔSP-TM菌体沉淀,用磷酸盐缓冲液(phosphate buffer solution, PBS)重悬后,在冰浴条件下超声破碎,离心收集上清液。将上清液与Ni-NTA琼脂糖混合,以4 ℃低温翻转孵育4 h,随后用20 mmol/L咪唑去除杂蛋白,用50 mmol/L 咪唑洗脱CD2v-TF 重组蛋白。同样,离心收集经低温诱导后的pET28a-CD2vΔSP-TM菌体沉淀,用尿素溶液(8 mol/L尿素,20 mmol/L NaH2PO4·2H2O,300 mmol/L NaCl,pH 8.0)重悬后,在冰浴条件下超声破碎,离心收集上清液。将上清液与Ni-NTA 琼脂糖混合,以4 ℃低温翻转孵育4 h,随后用缓冲液A(8 mol/L 尿素,20 mmol/L NaH2PO4·2H2O,300 mmol/L NaCl,10 mmol/L咪唑,pH 8.0)、缓冲液B(8 mol/L尿素,20 mmol/L NaH2PO4·2H2O,300 mmol/L NaCl,10 mmol/L 咪唑,pH 6.3)、缓冲液C(8 mol/L 尿素,20 mmol/L NaH2PO4·2H2O,300 mmol/L NaCl,pH 5.9)依次去除杂蛋白,用缓冲液D(8 mol/L 尿素,20 mmol/L NaH2PO4·2H2O,300 mmol/L NaCl,pH 4.5)洗脱CD2v-His重组蛋白。收集每次被洗脱的样品,用BCA法测定CD2v-TF和CD2v-His重组蛋白浓度,并将这2种重组蛋白保存于-40 ℃冰箱中。
纯化蛋白通过考马斯亮蓝R250 染色和蛋白质印迹法(Western blotting)进行鉴定。在蛋白质印迹法中,将经过SDS-PAGE后的纯化蛋白分别转印至硝酸纤维素膜上,用5%脱脂奶粉封闭1 h(37 ℃),加入按体积比1∶1 000稀释的多聚组氨酸标签(His-Tag)的鼠源单抗作为一抗,37 ℃孵育1 h后,用含吐温-20 的磷酸盐缓冲液(phosphate buffer solution with Tween-20, PBST)洗涤3次,每次5 min,然后加入按体积比1∶5 000 稀释的HRP 标记的羊抗鼠二抗,37 ℃孵育1 h,用PBST洗涤后,利用增强型化学发光(enhanced chemiluminescence, ECL)试剂进行显色。
1.2.4 2 种CD2v 重组蛋白的免疫反应性比较
采用间接酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)方法比较2种CD2v重组蛋白的免疫反应性。将纯化后的2 种CD2v 重组蛋白用0.05 mmol/L PBS(pH 9.6)稀释至2 μg/mL,然后以100 μL/孔包被96 孔酶标板,每块96 孔酶标板于4 ℃过夜包被12 h,弃包被液,用200 μL/孔PBST 清洗3 次后,每孔加入200 μL 5%脱脂奶粉,37 ℃封闭1 h,然后用200 μL/孔PBST 重复清洗3次。临床ASFV 抗体阳性血清(n=5)和标准阴性血清(n=5)分别用5% 脱脂奶粉按体积比1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600 稀释后,每孔加入100 μL 稀释后的溶液,37 ℃孵育1 h,每个稀释度设3个重复。用PBST洗涤3 次后,按100 μL/孔加入经1∶2 000 稀释的HRP标记的羊抗猪IgG,37 ℃孵育45 min,再用PBST 洗涤3 次后,每孔加入100 μL 3,3´,5,5´-四甲基联苯胺(3, 3´, 5, 5´-tetramethylbenzidine, TMB)显色液,37 ℃避光显色10 min 后,每孔立即加入50 μL 2 mol/L H2SO4,终止显色。用酶标仪测定每孔在450 nm 波长处的吸光度值,采用配对样本t检验分析相同稀释度下2种蛋白的免疫反应性差异。
2 结果与分析
2.1 原核表达质粒的构建与鉴定结果
以合成CD2v基因的质粒为模板,通过PCR 扩增得到去除信号肽和跨膜区的CD2v 序列片段,将其分别构建到pET-28a、pET32a、pGEX-4T-1、pMAL-C6T、pCold-TF 5 个原核表达载体中,获得原核表达质粒,然后将这些质粒转化到DH5α大肠埃希菌感受态细胞中,经过对应抗性的LB 平板筛选,挑取单克隆菌落接种于对应抗性的LB液体培养基中进行培养。以特异性引物(上游引物CD2v-F,5´-ATTGATTATTGGGTTAGTTTTAATAAAA-3´;下游引物CD2v-R,5´-TTAAATAATTCTATCTACA TGAATAAGCGA-3´)对菌液进行PCR 鉴定。结果(图1)表明,在969 bp长度附近出现目的条带。通过核酸测序确定CD2v基因序列、插入位置及开放阅读框都正确后,抽提质粒进行后续原核表达实验。
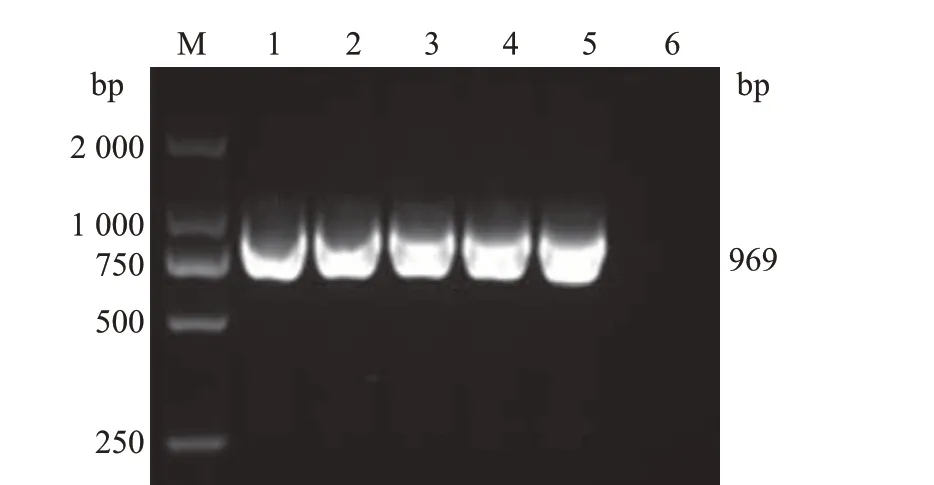
图1 重组质粒的PCR鉴定结果Fig.1 PCR identification results of recombinant plasmids
2.2 CD2v 蛋白的原核表达与鉴定结果
将鉴定正确的原核表达质粒转化至BL21(DE3)大肠埃希菌感受态细胞中,经IPTG 诱导后,通过SDS-PAGE 和考马斯亮蓝R250 染色确定不同重组蛋白的表达形式。结果(图2)表明:pET28a-CD2vΔSP-TM 重组质粒(图2A)和pGEX-4T-1-CD2vΔSP-TM重组质粒(图2C)主要表达包涵体蛋白;pET32a-CD2vΔSP-TM重组质粒(图2B)未表达CD2v重组蛋白;pMAL-C6T-CD2vΔSP-TM重组质粒(图2D)同时表达包涵体和可溶性蛋白,其中以包涵体蛋白居多;pCold-TF-CD2vΔSP-TM 重组质粒(图2E)以表达可溶性蛋白为主。
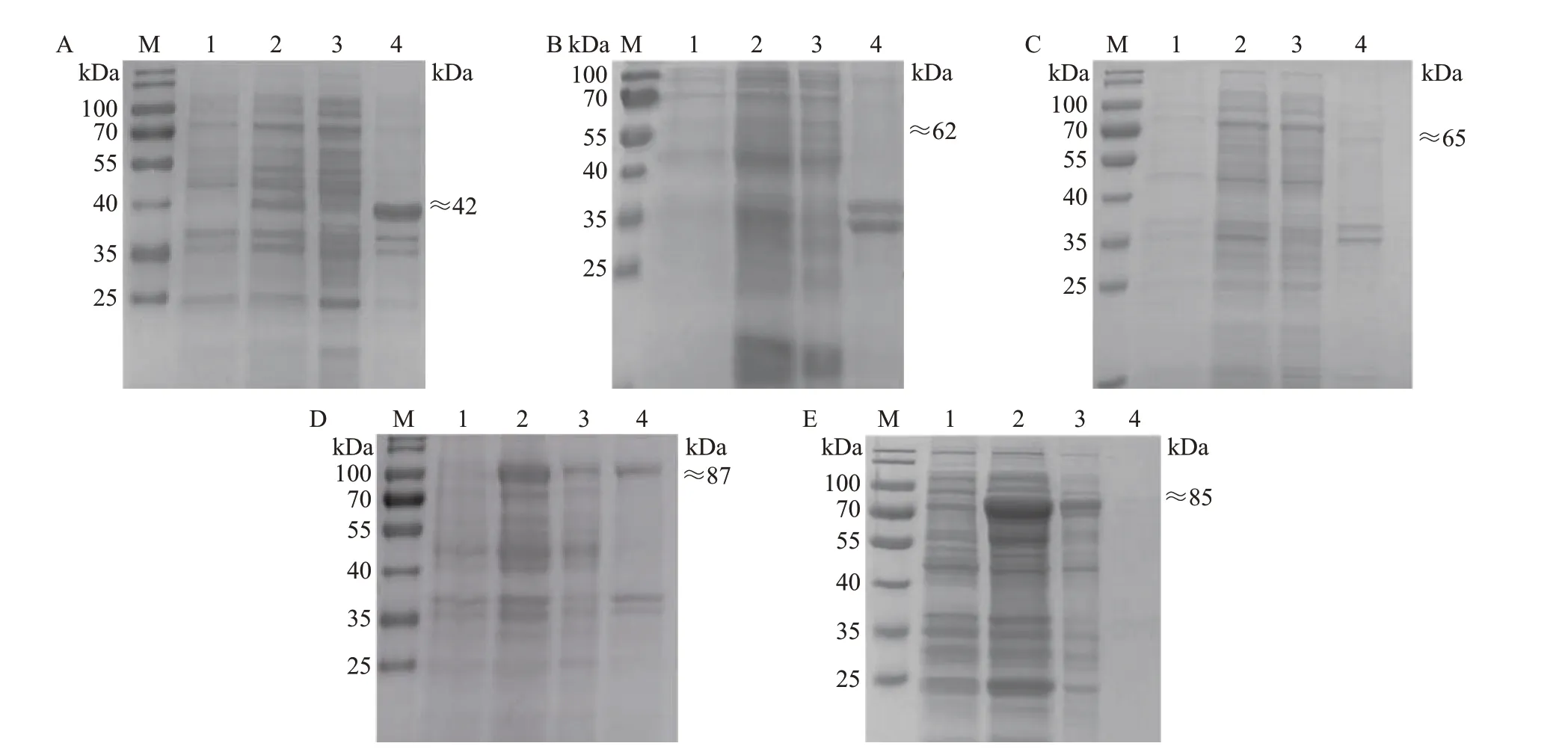
图2 5种不同原核表达载体对CD2v重组蛋白表达的SDS-PAGE分析Fig.2 SDS-PAGE analysis of CD2v recombinant protein expression by five different prokaryotic expression vectors
2.3 CD2v 蛋白的纯化与鉴定结果
将低温诱导表达的CD2v-TF、CD2v-His重组蛋白通过超声破碎、镍柱亲和层析及洗脱等过程进行纯化,并用SDS-PAGE和蛋白质印迹法验证其纯化情况。结果表明,在预期的85 kDa附近有CD2v-TF重组蛋白阳性条带(图3),在预期的42 kDa 附近有CD2v-His重组蛋白阳性条带(图4)。
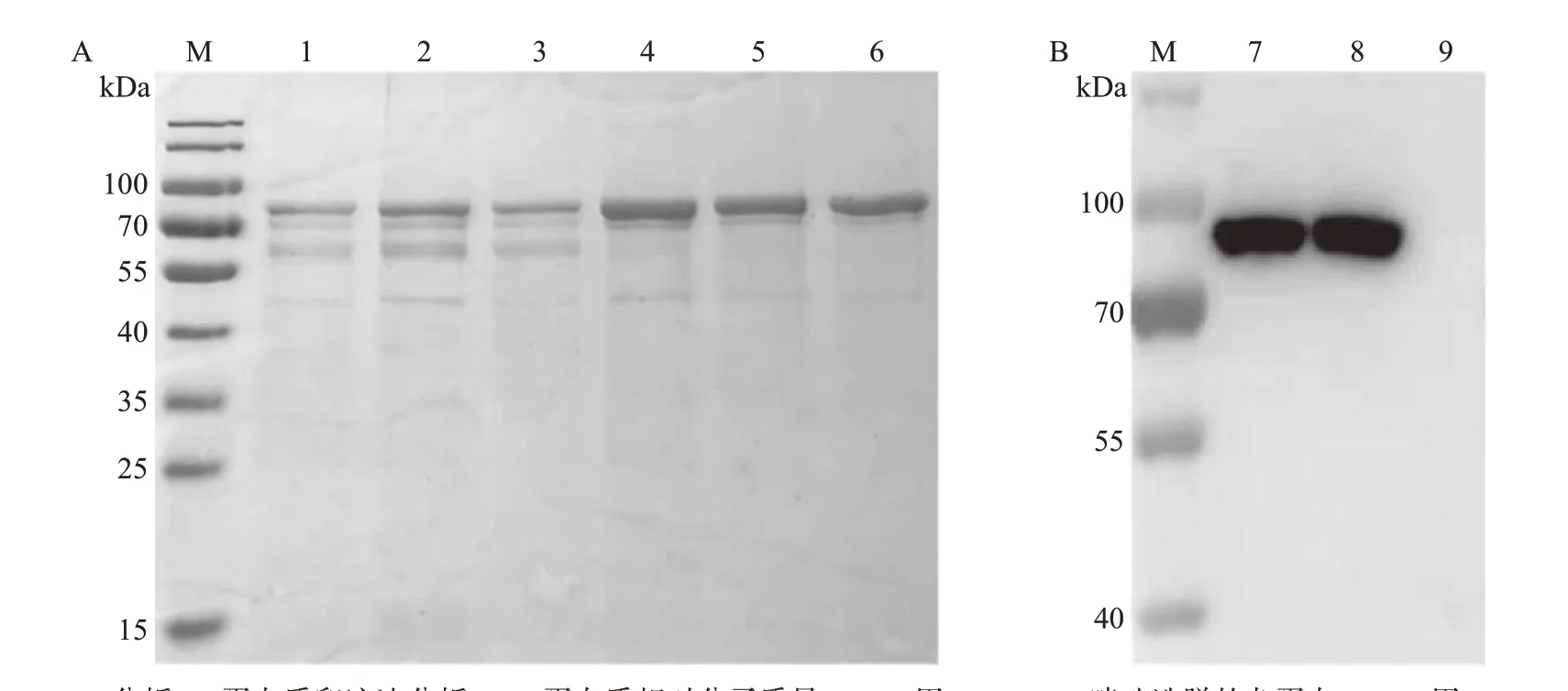
图3 CD2v-TF重组蛋白纯化结果Fig.3 Purification results of CD2v-TF recombinant protein
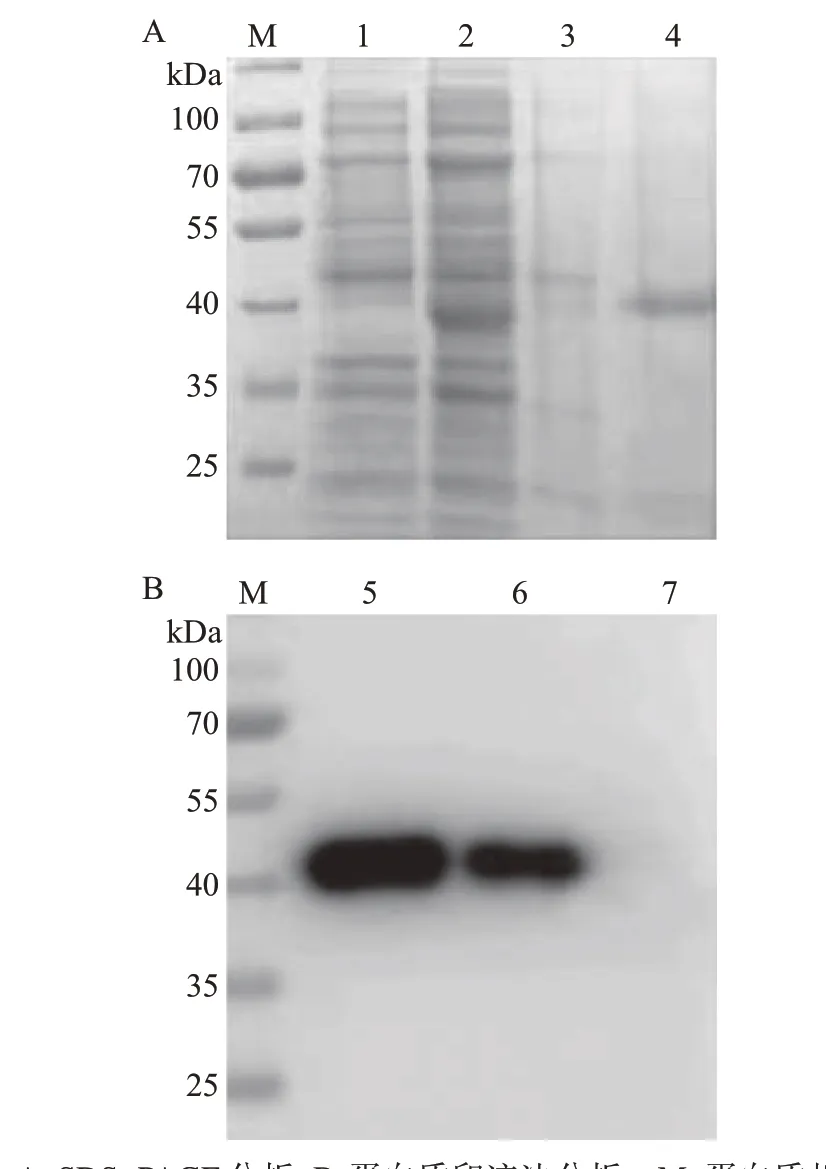
图4 CD2v-His重组蛋白纯化结果Fig.4 Purification results of CD2v-His recombinant protein
2.4 2 种CD2v 重组蛋白的免疫反应性比较分析
利用间接ELISA 方法检测(图5)显示,随着抗体浓度降低,抗原抗体免疫反应性呈现下降趋势。采用配对样本t检验分析在相同稀释度下2 种蛋白的免疫反应性差异,以在450 nm波长处的吸光度值表示。结果(图5)表明,在体积比1∶200和1∶400稀释度下,ASFV 抗体阳性血清与CD2v-TF 重组蛋白的免疫反应性显著高于与CD2v-His重组蛋白的免疫反应性(P<0.05)。
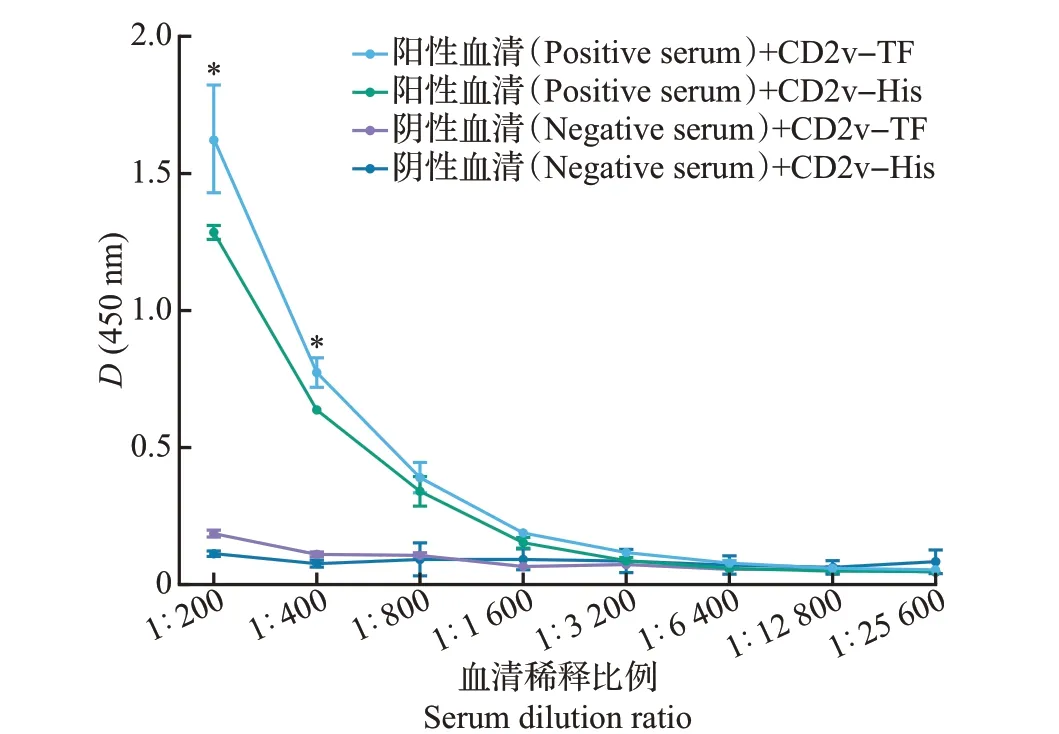
图5 利用间接ELISA方法检测2种CD2v重组蛋白的免疫反应性Fig.5 Immunoreactivity of two CD2v recombinant proteins detected by indirect ELISA
3 讨论
ASF 对生猪养殖行业造成了严重的经济损失,由于尚无有效的疫苗和药物进行预防或治疗,目前只能依靠严格的生物安全措施进行防控[22]。CD2v是第一个被证实对ASFV致死性攻击具有保护作用的ASFV 蛋白,已成为DNA 疫苗、病毒载体疫苗等研究的重要靶点,在ASFV 疫苗研发中具有重大潜力[23-25]。
大肠埃希菌原核表达系统具有操作简单方便、表达量高、周期短、成本低等优点,但其表达的CD2v蛋白多以包涵体的形式存在,经尿素溶解后,蛋白空间结构被破坏而呈变性状态,空间表位丢失,导致免疫原性较差[11,26-27],影响了其在低成本疫苗研制中的应用。本研究系统比较了5种原核表达载体不同重组标签对CD2v 蛋白可溶性表达的影响。结果表明:作为被广泛应用的pET表达系统中的2 个代表性载体,pET28a 和pET32a 均未能促进CD2v的可溶性表达;pGEX-4T-1载体虽然具有促进蛋白可溶性表达的谷胱甘肽-S-转移酶(glutathioneS-transferase, GST)标签[28],但其仍表达以包涵体形式为主的CD2v 重组蛋白;pMAL-C6T 载体具有麦芽糖结合蛋白(maltose binding protein, MBP)标签,该标签不仅能提高重组蛋白表达量,而且能减少蛋白降解并促进其可溶性表达[29],在本研究中该标签虽然可提高CD2v 蛋白的可溶性表达,但在非变性亲和纯化过程中杂蛋白较多,影响了CD2v 蛋白的纯度;而pCold-TF 载体表达的CD2v 重组蛋白均以可溶性的方式存在,且可纯化获得纯度较高的可溶性重组蛋白。pCold-TF是一种冷休克载体,带有触发因子(trigger factor, TF)标签,而TF是原核细胞中与核糖体相关的分子伴侣蛋白,可促进多肽进行共翻译折叠表达,并通过提高蛋白的正确折叠来促进可溶性表达[30]。
4 结论
本研究构建了5 种原核表达重组质粒,比较了CD2v蛋白的可溶性表达情况,并利用临床ASFV抗体阳性血清比较了在可溶性和包涵体形式下CD2v蛋白的免疫反应性。结果表明,TF标签可有效促进CD2v蛋白的可溶性表达,且可溶性CD2v蛋白的免疫反应性显著高于包涵体蛋白,表明蛋白的可溶性表达可能在空间表位层面影响蛋白的免疫反应性。因此,选择合适的表达载体是CD2v 蛋白在原核表达系统中实现正确折叠和可溶性表达的一种有效策略。本研究为ASFV CD2v 蛋白的可溶性表达提供了参考载体,为CD2v 蛋白功能与免疫原性研究及亚单位疫苗研制奠定了基础。

