慢性心脏电极穿孔的识别及处理策略分析
张艺民 昃峰 段江波 周旭 李学斌
随着心律植入装置(cardiac implantable electronic device,CIED)植入数量的增多,CIED 植入术后并发症的发生率也随之升高。心脏电极穿孔是指与电极导线相关的心脏穿孔,主要为心房肌和心室肌的穿孔,可引起心脏压塞甚至死亡。研究表明,起搏器植入引起的心脏电极穿孔发生率为0.1%~0.8%,埋藏式心脏转复除颤器(ICD)植入引起心脏电极穿孔发生率为0.6%~5.2%[1]。慢性心脏电极穿孔指术后30天以后发生的穿孔,由于电极导线植入时间长,拔除困难,手术风险高,目前尚无统一的处理策略[2]。笔者对慢性心脏电极穿孔的识别以及处理策略进行探讨。
1 资料与方法
1.1 研究对象
纳入2007年1月至2019年1月就诊于北京大学人民医院确诊慢性心脏电极穿孔的患者。纳入标准:①出现胸痛、膈肌刺激等症状;②程控参数异常;③影像学(包括胸部X 线、心脏超声心动图、胸部CT)提示心脏电极穿孔;④发生在CIED 术后30天后。符合上述第③+④条合并(或不合并)①、②中的任意一条者入选本研究。排除标准:发生在CIED 术后30天内。
1.2 手术过程
1.2.1 经静脉拔除 经静脉拔除在导管室进行,连续心电和动脉血压监测。心脏外科手术团队及手术室备用。手术在局部麻醉或全身麻醉下进行,麻醉方式取决于患者的一般情况和医生的习惯。全身麻醉患者行经食管超声心动图检查。所有穿孔电极均通过“分步”方法拔除。①对于主动固定电极,将电极配套的标准钢丝通过电极“中心腔”送至电极远端,通过螺旋回撤装置回撤主动电极螺旋后尝试直接手动拔除;对于被动固定电极,将电极配套的标准钢丝通过电极“中心腔”送至电极远端后尝试直接拔除。②如果直接拔除失败,则将锁定钢丝(Cook 公司)通过电极“中心腔”送至电极远端固定,然后再次尝试拔除。③如果使用锁定钢丝拔除仍然失败,并且穿孔电极是普通起搏电极,则使用Snare下腔回收装置经股静脉通路送至右房进行心腔内抓捕电极;如果穿孔电极是除颤电极,则使用激光鞘(SLS II鞘;Spectranetics,Colorado Springs,Colorado)沿电极推进,以分离上腔静脉/右房连接血管入口部位的纤维组织。对于穿孔时间较长的被动固定电极(>5年)、术前有心包积液或穿孔电极穿出心包的患者,在尝试拔除电极之前进行干性(预防性)心包穿刺,并在心包内留置猪尾导管。
1.2.2 开胸手术拔除 开胸手术在手术室全身麻醉下进行,常规消毒铺单,正中切口,胸骨下段部分切开,暴露心包,心包悬吊,寻找穿孔电极,于心外剪断电极,经原起搏器植入切口去除穿孔电极,穿孔部位3.0滑线带毡片缝合,观察术野无明显活动性出血后放置心包纵隔引流,逐层关胸。
1.3 观察比较内容
回顾性分析患者的基线资料、临床特征(包括症状、影像学表现、穿孔时间、血流动力学情况、CIED植入类型、电极类型)、电极拔除情况及并发症等情况。
1.4 统计学分析
正态分布的计量资料采用均数±标准差表示,偏态分布的计量资料采用中位数(四分位数间距)表示,计数资料以例(率)表示。
2 结果
2.1 基线资料
共入选30例患者,其中男性17例(56.7%),女性13例(43.3%),年龄(63.3±16.0)岁,体重指数(23.9±2.6)kg/m2。合并高血压8例(26.7%),糖尿病3例(10.0%),冠心病4例(13.3%),心房颤动5 例(16.7%)。30 例中房室传导阻滞15 例(50.0%),病窦综合征10 例(33.3%),室性心动过速4例(13.3%),心室颤动1例(3.3%)。19例(63.3%)植入双腔起搏器(DDD 型),6例(20.0%)植入单腔起搏器(VVI型),5例(16.7%)植入ICD。
2.2 临床特征
30例中胸痛15例(50.0%),呼吸困难4例(13.3%),肌肉刺激3 例(10.0%),意识丧失3 例(10.0%),无症状者5例(16.7%),出现心包积液2例(6.7%),有1例(3.3%)伴有周围器官损伤,表现为穿孔电极导线引起左侧胸腔积液。30例中18例(60.0%)胸片提示电极穿孔(图1A),14 例(46.7%)超声心动图提示电极穿孔(图1B);有3例(10.0%)完善了胸部CT,且均提示电极穿孔(图1C)。30例穿孔发生在CIED 术后1 095.0(365.0,1 825.0)天,术前血流动力学稳定,收缩压(131.5±15.1)mm Hg,舒张压(77.0±9.7)mm Hg。穿孔电极中主动固定电极15例(50.0%),被动固定电极10例(33.3%),除颤电极5例(16.7%)。
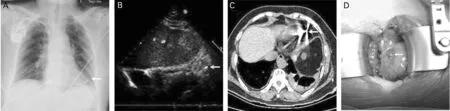
图1 不同影像或直视下的电极穿孔
2.3 电极拔除情况
所有患者均成功完成穿孔电极拔除手术,其中经静脉拔除19例(63.3%),经开胸手术拔除11例(36.7%)(图1D)。在经静脉拔除患者中,3例(10.0%)直接拔除,13例(43.3%)经锁定钢丝拔除,2例(6.7%)为穿孔时间较长的被动固定电极(分别为5年、7年),经Snare下腔回收装置拔除,1例(3.3%)为术后5年穿孔的除颤电极,经激光鞘拔除。术前行心包穿刺并留置猪尾导管4 例(13.3%),其中1例(3.3%)术前心脏超声提示中量心包积液,心包穿刺共引流血性心包积液约400ml;另外3 例(10.0%)虽然术前没有心包积液,但是1例(3.3%)为穿孔时间较长的被动固定电极(7年)、2例(6.7%)电极穿出心包,考虑拔除过程中出现心包积液风险较高,故拔除电极之前进行干性心包穿刺并留置猪尾导管(图2)。

图2 干性(预防性)心包穿刺
2.4 并发症情况 1例(3.3%)患者经开胸手术拔除穿孔电极术后第6天发现手术切口敷料渗湿,挤压切口可见较多脓性分泌物,细菌培养提示产酸克雷伯菌,予患者抗感染、伤口换药10天后手术切口愈合良好。其余患者无手术切口感染、血管或瓣膜撕裂、心包积液、心脏压塞及手术相关死亡发生。
3 讨论
心脏电极穿孔可表现为胸痛、呼吸困难、肌肉刺激等,严重者可引起心包积液甚至心脏压塞以及心脏周围器官损伤,其中胸痛是最常见的临床表现,部分穿孔患者无临床症状[3-4]。Van Gelder等[5]认为在慢性穿孔患者中,由于电极植入时间长,电极头端被纤维组织包裹,降低了血液快速进入心包腔的风险,因此一部分患者并没有明显的临床表现。本研究中83.3%的患者有症状,最常见的症状为胸痛(50.0%),16.7%的患者无明显症状。心脏电极穿孔可通过胸部X 线、超声心动图以及胸部CT 明确诊断,其中胸部CT 是诊断心脏电极穿孔的金标准[6]。无症状患者通常是在常规程控过程中发现电极参数异常怀疑穿孔,并通过进一步影像学检查确诊。
2017年HRS专家共识建议,如心脏电极穿孔患者出现胸痛、心包积液等临床表现,则应该拔除穿孔电极[7]。本研究拔除穿孔电极的患者中有5 例(16.7%)无明显临床表现。目前对于无症状心脏电极穿孔患者是否需要拔除穿孔电极尚无统一标准。由于慢性穿孔电极拔除风险高,有学者认为对于穿孔电极未引起心脏周围器官损伤的无症状慢性心脏电极穿孔患者,可以暂时保留穿孔电极,并植入新电极[8]。然而,保留穿孔电极可能会引起严重并发症,如心脏压塞、损伤心脏周围器官等,一旦发生上述严重并发症,将会严重威胁患者的生命安全;另外,随着时间的推移,电极可被纤维组织包裹,电极拔除的困难程度及并发症的发生率会随之增加[9]。因此,笔者认为对于无症状慢性心脏电极穿孔患者,应权衡利弊,尽可能拔除穿孔电极。
2009年AHA 专家共识建议在慢性心脏穿孔中首选开胸手术拔除穿孔电极[10]。由于慢性心脏穿孔患者的穿孔电极植入时间长,穿孔电极与周围组织粘连较重,甚至被纤维组织包裹,经静脉拔除风险大,因此在最开始遇到慢性心脏穿孔患者时,笔者首选开胸手术。本研究中有11例(36.7%)慢性心脏穿孔患者是通过开胸手术拔除穿孔电极。经静脉拔除是一项逐渐成熟的电极拔除技术,与开胸手术相比,经静脉拔除具有创伤小、伤口感染风险低、患者疼痛程度轻、住院时间短以及花费低等优势,国外的经验表明采用经静脉“分步”式拔除术式拔除电极的成功率为96%~100%[11]。在血流动力学稳定且不伴周围器官损伤的急性心脏电极穿孔患者中,经静脉拔除已经被证明是一种安全有效的手术方法[3,12]。随着技术的进步以及术者经验的积累,诸多学者开始尝试在慢性心脏电极穿孔患者中经静脉拔除穿孔电极,并且已经取得了令人满意的效果[2,4]。目前国外报道经静脉成功拔除的穿孔电极最长时间为14 年,该穿孔电极为心室主动固定电极,在激光鞘的辅助下成功拔除[13]。本研究中经静脉拔除穿孔电极的19例患者术前血流动力学稳定,均首先尝试直接手动拔除;如失败,则使用锁定钢丝拔除;如仍失败,则使用Snare下腔回收装置或激光鞘拔除;19例患者均成功拔除穿孔电极。根据笔者的经验,绝大多数慢性穿孔电极可以通过锁定钢丝拔除;少数病例由于穿孔时间较短可以直接手动拔除;对于穿孔时间较长(≥5年)的穿孔电极,由于组织粘连较重,可能需要在Snare下腔回收装置或激光鞘等拔除工具的辅助下拔除。
对于合并心包积液的穿孔患者,如果是中大量心包积液,或者心包积液量增长较快,甚至出现心脏压塞,则需要进行心包穿刺引流[1,10]。本研究中有1例(3.3%)患者于起搏器植入术后4年发生穿孔,穿孔电极为心室主动固定电极,术前心脏超声提示中量心包积液,血流动力学稳定,在电极拔除前进行心包穿刺,并留置猪尾导管,共引流出血性心包积液约400 ml,然后经锁定钢丝成功拔除穿孔电极。在未合并心包积液患者中,对于穿孔时间长的被动固定电极或者穿孔电极穿出心包的患者,由于被动固定电极头端较粗,植入时间长、粘连严重,因此在经静脉拔除穿孔电极过程中出现心包积液甚至心脏压塞的风险较高,为了应对电极拔除过程中可能出现的心包积液以及心脏压塞,笔者尝试在术前首先进行干性(预防性)心包穿刺,并留置猪尾导管,以便及时引流可能出现的心包积液,避免心脏压塞,同时可以为开胸手术争取时间,在成功留置猪尾导管后再经静脉拔除穿孔电极。Huang等[14]的研究中有5例穿孔患者术前进行了预防性心包穿刺,其结果表明,在未合并心包积液的心脏电极穿孔患者中,术前进行预防性心包穿刺可显著降低心脏压塞的发生率。Scanavacca等[15]认为心包穿刺产生的负压可使脏层心包与壁层心包贴在一起,进而压迫心房或心室壁的外膜,有助于封堵穿孔。因此对于未合并心包积液的患者,但经静脉拔除风险高(如穿孔时间较长的被动固定电极或者电极明显穿出心包的患者),且患者不接受开胸手术,经静脉拔除前进行干性(预防性)心包穿刺是一种可以考虑的手术方案[14]。
在一些严重的病例中,电极不仅穿出心包,甚至穿入心脏周围器官,造成心脏周围器官损伤,如气胸、血胸等,经静脉拔除风险高,一般选择开胸手术拔除[16]。但是目前也有报道在类似病例中,经静脉拔除穿孔电极也是可行的[4]。本研究中有1例发生于起搏器植入术后9个月的心脏电极穿孔,穿孔电极为心室主动固定电极,穿孔电极引起左侧胸腔积液,该患者在全麻以及经食管超声监测下,经锁定钢丝成功拔除穿孔电极。这种情况下经静脉拔除风险较高,术前需要仔细评估患者的一般情况以及心脏周围器官损伤程度,术中需要严密监测,同时建议在经验丰富并且有心脏外科团队后备的的中心进行。对于病情复杂、心脏周围器官损伤严重的病例仍然建议开胸手术拔除。需要指出的是,不管电极穿孔的程度是否严重,如果患者血流动力学不稳定,则需要通过开胸手术拔除穿孔电极[14]。
本研究中有1例(3.3%)患者经开胸手术拔除穿孔电极后第6天发现手术切口感染,细菌培养提示产酸克雷伯菌,予患者抗感染、伤口换药后愈合良好。其余患者无手术相关并发症发生。在经静脉拔除穿孔电极过程中最担心拔除穿孔电极后出现心脏压塞,但是本研究中经静脉拔除穿孔电极的患者术后未出现心包积液及心脏压塞,这可能与心肌的“自我封闭”特性有关,当穿孔电极被拔除后该特性可对出血进行自我限制[14]。但是在拔除穿孔电极过程中仍然需要严密监测患者的生命体征以及心包情况,一旦出现心包积液,及时行心包穿刺引流。
本研究存在以下局限性:①本研究是一项单中心回顾性描述性研究;②本研究样本量较小;③本研究中无心房穿孔病例,这可能与心房穿孔较少见有关。

