肝硬化可疑自发性细菌性腹膜炎患者的预后及发生死亡的危险因素
唐 巧,周 超,张 宁,何召云,张晶晶,付双楠,李 昕,刘鹏程,张田义,张 瑾,宫 嫚
1南方医科大学中医药学院,广东 广州 510515;2解放军总医院第五医学中心中医肝病科,北京100039
自发性细菌性腹膜炎(SBP)是肝硬化合并腹水患者常见的并发症,最近一项全球多中心研究显示,在纳入的1302例伴细菌感染的肝硬化患者中SBP占比高达27%[1],其预后不良[2],因此及时准确地启动抗生素治疗是改善患者预后的关键[3]。从2000年国际腹水俱乐部(IAC)、2010年欧洲肝病研究学会(EASL)至2021年美国肝脏病学会(AASLD)等发布的SBP诊断标准均为腹水中多形核细胞计数(PMN)≥250个/mm3,和(或)常规腹水细菌培养阳性;当腹水PMN计数<250个/mm3且腹水细菌培养阳性时,诊断为细菌性腹水(BA)[4-6]。由于常规腹水细菌培养阳性率低,且耗时较长,加上部分SBP患者临床症状不典型等原因[5-7],临床实践中腹水PMN计数是SBP的主要诊断依据。但也有相关研究指出腹水PMN≥250个/mm3作为SBP诊断标准可能过于严苛,会造成约20%可疑患者漏诊[8]。因此,即使没有达到SBP的诊断标准,当患者腹水PMN计数<250个/mm3且伴发热、腹痛、血白细胞升高等可疑SBP表现时,也应该高度怀疑SBP。也有个别研究指出,可疑SBP患者的病死率与普通SBP相近[9]。除此以外,目前尚无针对可疑SBP患者预后及其危险因素的相关研究。因此需要进一步的临床证据为该类患者抗生素应用的诊疗决策提供参考,提高抗生素应用的及时性及精准性。为加深对可疑SBP患者的认识,更好地把握其临床特征,本研究回顾性分析了2021年6月~2022年6月于解放军总医院第五医学中心住院的323例肝硬化失代偿期伴腹水患者的临床资料,观察SBP、BA、可疑SBP及无感染患者在临床特征和预后上的差异,探索影响可疑SBP患者预后的危险因素,为优化可疑SBP患者临床管理路径、评估其预后提供参考及依据。
1 资料和方法
1.1 研究对象与研究设计
患者纳入标准为:肝硬化失代偿期合并中大量腹水;具有腹水常规及腹水细菌培养结果。排除标准如下:年龄<18周岁或>80周岁;合并其他严重慢性疾病;HIV患者;继发性腹膜炎;孕妇;合并恶性肿瘤;合并其他部位感染者。根据腹水PMN计数、常规腹水细菌培养结果以及是否伴有可疑SBP表现,将患者分为SBP组(腹水PMN计数≥250个/mm3)、BA组(PMN<250 个/mm3,且常规腹水细菌培养结果阳性)、可疑SBP组(PMN<250个/mm3,常规腹水细菌培养结果阴性,伴可疑SBP表现)及无感染组(PMN<250个/mm3,常规腹水细菌培养结果阴性,无可疑SBP感染表现),前3组患者均经验性应用头孢三代或喹诺酮类或根据药敏结果予以针对性抗生素治疗。纳入分组流程见图1。本研究已获得中国人民解放军总医院第五医学中心伦理委员会批准[批号:KY-2022-11-74-1]。由于本研究为回顾性研究,患者的知情同意被放弃。
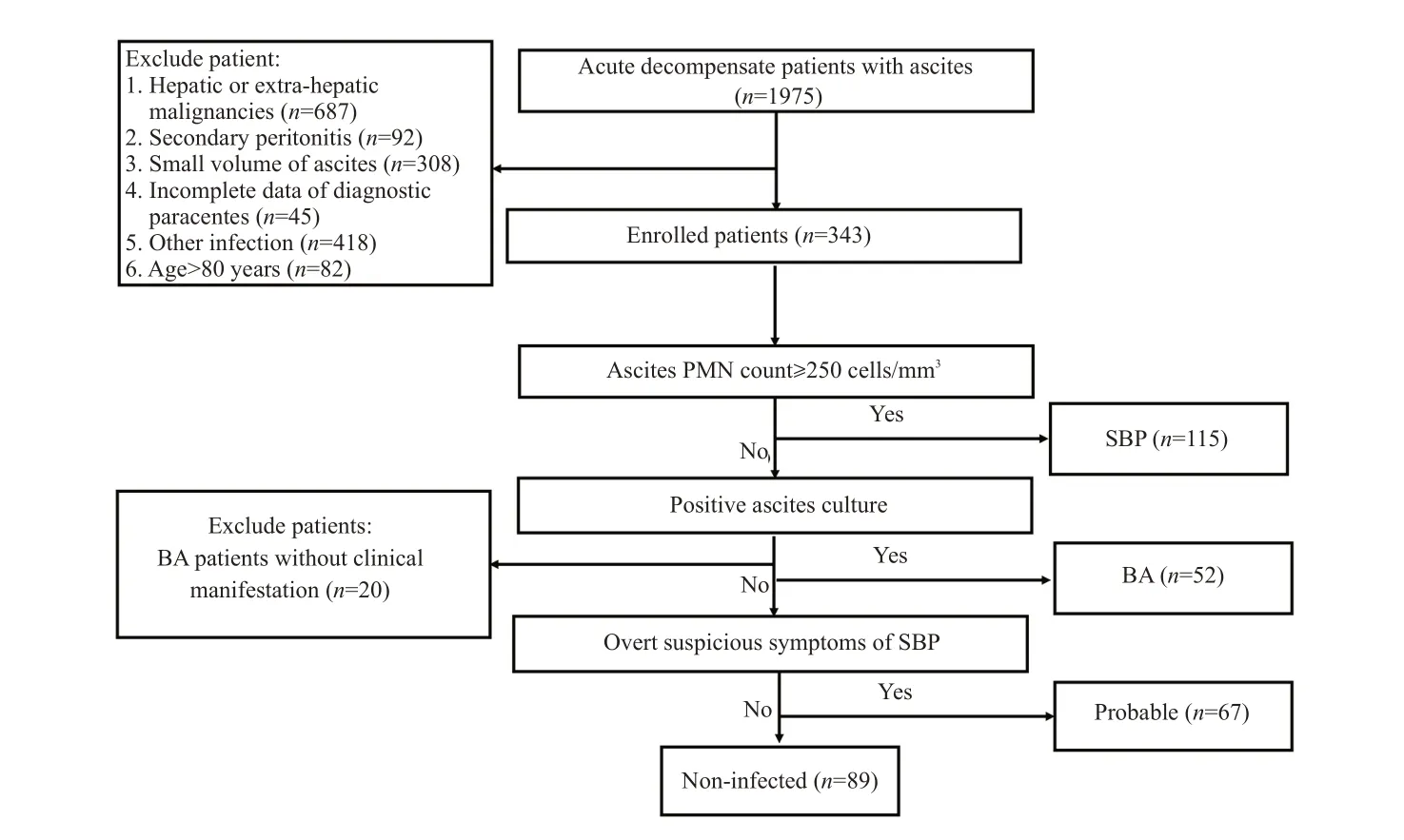
图1 病例纳入分组流程Fig.1 Flowchart of patient enrollment.

图2 4组总体生存曲线Fig.2 Survival curves of the patients in the 4 groups.
1.2 相关定义与标准
肝硬化失代偿期诊断符合中华医学肝病学会2019年发布的《肝硬化诊治指南》标准[10];纳入患者中部分符合慢加急性肝衰竭(ACLF)诊断,诊断标准依据《肝衰竭诊治指南(2018年版)》[11];中大量腹水诊断依据中华医学肝病学会2017年发布的《肝硬化腹水及相关并发症的诊疗指南》[7];SBP及BA诊断依据2021年AASLD发布指南[6]。可疑SBP根据国内外指南定义如下[5-7]:急性腹膜炎相关表现:腹痛、腹部压痛或反跳痛、腹肌张力增大、呕吐、腹泻或肠梗阻;全身炎症反应综合征(SIRS)表现;无明显诱因肝功能恶化;不明原因的肝性脑病;休克;顽固性腹水或利尿剂突发无反应或肾功能衰竭;急性胃肠道出血。
1.3 观察指标以及资料收集
收集资料主要包括以下内容:人口统计学资料、既往病史等;入院前3个月内或本次住院症状好转,经评估无感染,停用抗生素后的外周血白细胞(WBC)、中性粒细胞(NEU)计数;行诊断性腹腔穿刺时的临床症状、体征及实验室检查结果,包括白蛋白(ALB)、总胆红素(TBIL)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、血肌酐(sCr)、血尿素氮(BUN)、血钠(Na)、国际标准化比值(INR)、凝血酶原活动度(PTA)、WBC、血小板(PLT)、NEU、降钙素原(PCT)、C反应蛋白(CRP);住院期间并发症发生情况,包括消化道出血、肝性脑病(HE)及急性肾损伤(AKI);终末期肝病模型(MELD)评分、终末期肝病血清钠(MELD-Na)评分[12,13];生存资料通过对患者进行电话随访或查询门诊、住院记录获得,随访时间为90 d或随访至死亡。
1.4 统计学分析
所有正态分布的计量资料均使用均数±标准差表示,组间比较采用独立样本t检验或ANOVA进行;非正态分布计量资料使用中位数与四分位数间距表示;组间对比使用Mann-WhitneyU检验或Kruskal-Wallis 检验,是否符合正态分布使用Kruskal-Wallis检验进行检验。计数资料用频数和构成比/率(%)表示,组间比较采用皮尔逊卡方检验、Fisher确切概率法。为控制混杂因素,使纳入倾向性评分匹配(PSM)模型的协变量在可疑SBP组与无感染组间趋于均衡可比,设定卡钳值为0.1,使用1∶1最邻近匹配法进行匹配,以得到组间均衡性良好的可疑SBP组患者与无感染患者。各组患者生存情况使用Kaplan-Meier 法及Log-rank 法进行分析比较。影响可疑SBP患者预后的危险因素使用Cox回归模型进行分析。数据分析使用SPSS25.0进行,P<0.05认为差异具有统计学意义。
2 结果
2.1 患者一般资料
本研究纳入患者以男性(263例,占81.42%)为主,最常见病因为乙型肝炎病毒相关肝硬化(216 例,占66.87%)。年龄52.09±11.62岁,MELD评分为17.88±7.70。共22例患者失访,其中SBP组14例、BA组1例、可疑SBP组3例、无感染组4例。90 d随访期内共118例患者死亡,其中SBP组54例、BA组25例、可疑SBP组29例及无感染组10例。
2.2 患者临床特征、预后比较
4组患者行诊断性腹腔穿刺时的临床特征见表1。可疑SBP组临床症状较SBP组及BA组隐匿,其出现腹痛、感染性休克及发热的比例显著低于SBP 组及BA 组(P<0.05),实验室检查指标方面,可疑SBP 组ALB水平与无感染组及BA组无显著差异,高于SBP组(P<0.001);SBP组、BA组及可疑SBP组3组间TBIL、sCr、BUN、WBC、NEU 无显著差异,均高于无感染组患者(P<0.05);3组血Na水平低于无感染组,差异具有统计学意义(P<0.001);可疑SBP 组腹水WBC、PMN计数中位数显著高于BA组及无感染组,低于SBP组(P<0.05)。4组患者中ACLF患者比例具有显著差异(P<0.001),预后评分方面,无感染MELD 评分最低(14.29±5.45),可疑SBP组MELD评分(16.77±7.40)与BA组(17.59±7.61)无显著差异(P>0.05),低于SBP组(21.35±8.03),4组间MELD评分差异具有统计学意义(P<0.001),4组间MELD-Na评分差异同样具有统计学意义(P<0.001)。

表1 入组患者临床特征Tab.1 Clinical characteristics of the enrolled patients
采用Kaplan-Meier 曲线分析4组患者生存情况,log-rank法检验4组患者总体生存率差异,结果提示,90 d随访期内,可疑SBP组病死率与SBP组(Log-rankP=0.121)及BA组(Log-rankP=0.805)差异无统计学意义,显著高于无感染组(Log-rankP<0.001)。
2.3 可疑SBP是肝硬化腹水患者死亡危险因素之一
采用Cox比例风险模型评估年龄、性别、病因、是否具有可疑SBP、临床指标及MELD评分对可疑SBP组及无感染组死亡风险的影响(表2)。单因素Cox回归提示可疑SBP显著增加肝硬化腹水患者死亡风险[风险比(HR)=1.467,95%CI=1.068~2.015,P=0.018]。将所有单因素分析中P<0.1的变量纳入多因素Cox回归模型,结果显示,可疑SBP是肝硬化腹水患者死亡危险因素之一(HR=1.539,95%CI=1.048~2.261,P=0.028)。此外,PCT≥0.5 ng/mL(HR=1.550,95%CI=1.002~2.398,P=0.049)及MELD 评分≥15(HR=1.757,95%CI=1.185~2.607,P=0.005)也是影响肝硬化腹水患者90 d生存状态的重要风险因素。
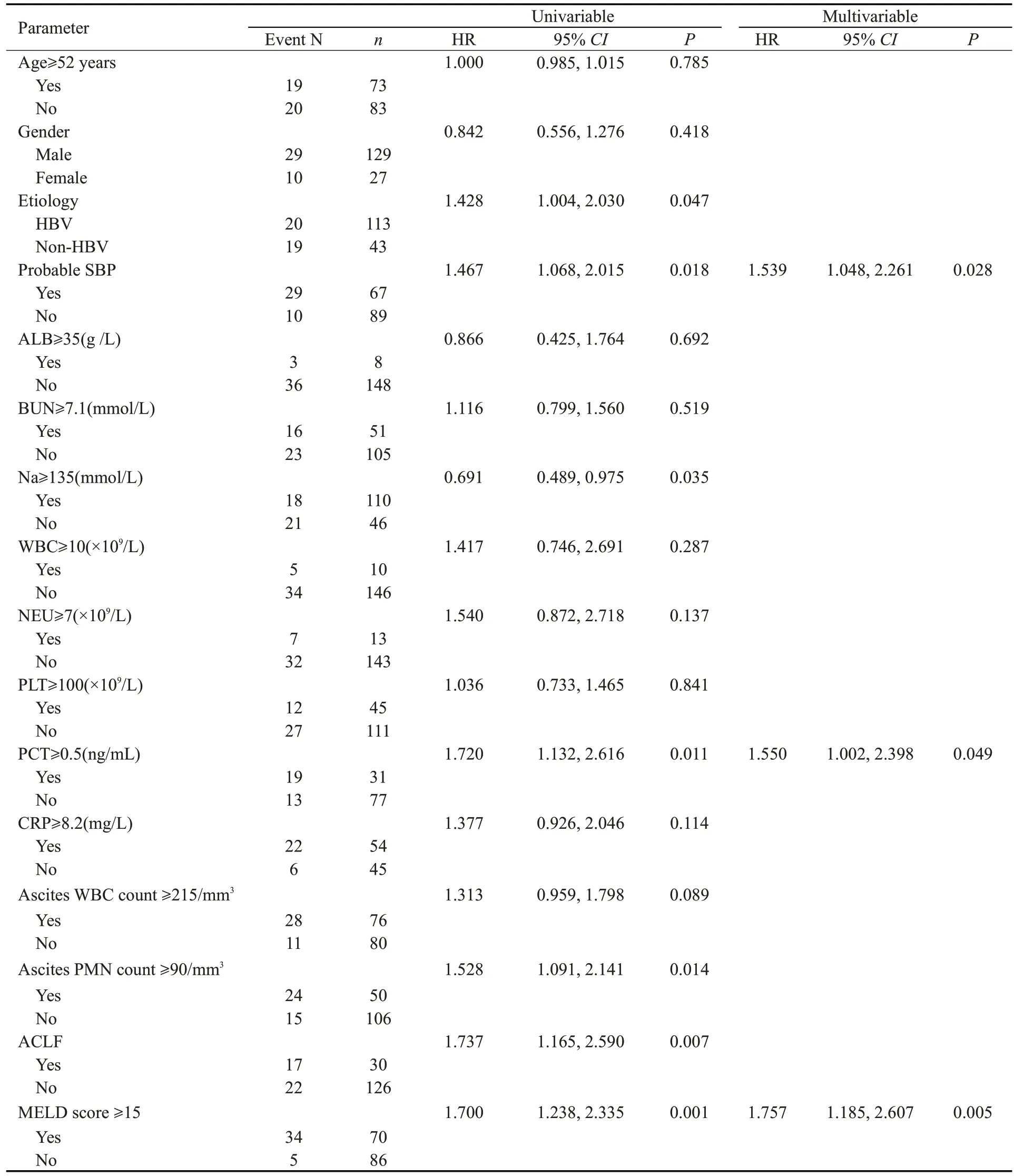
表2 可疑SBP组与无感染组患者Cox比例风险模型Tab.2 Cox proportional hazard model of probable SBP patients and non-infected patients
由于可疑SBP组与无感染组组间协变量不均衡,故进一步使用PSM控制混杂因素,均衡协变量以评估两组基线特征以及预后,PSM前可疑SBP组与无感染组相比平均年龄较大(P=0.006),TBIL、sCr、INR、MELD评分及MELD-Na评分均高于无感染组(P<0.05),血钠低于无感染组(P<0.001)。纳入PSM的因素为两组间差异具有统计学意义的单项临床指标变量(TBIL、sCr、INR、血钠),使用1∶1最邻近匹配法,设定卡钳值为0.1,进行PSM。成功匹配可疑SBP组与无感染组各46例,PSM后两组间上述指标达到均衡,差异无统计学意义(P>0.05,表3)。
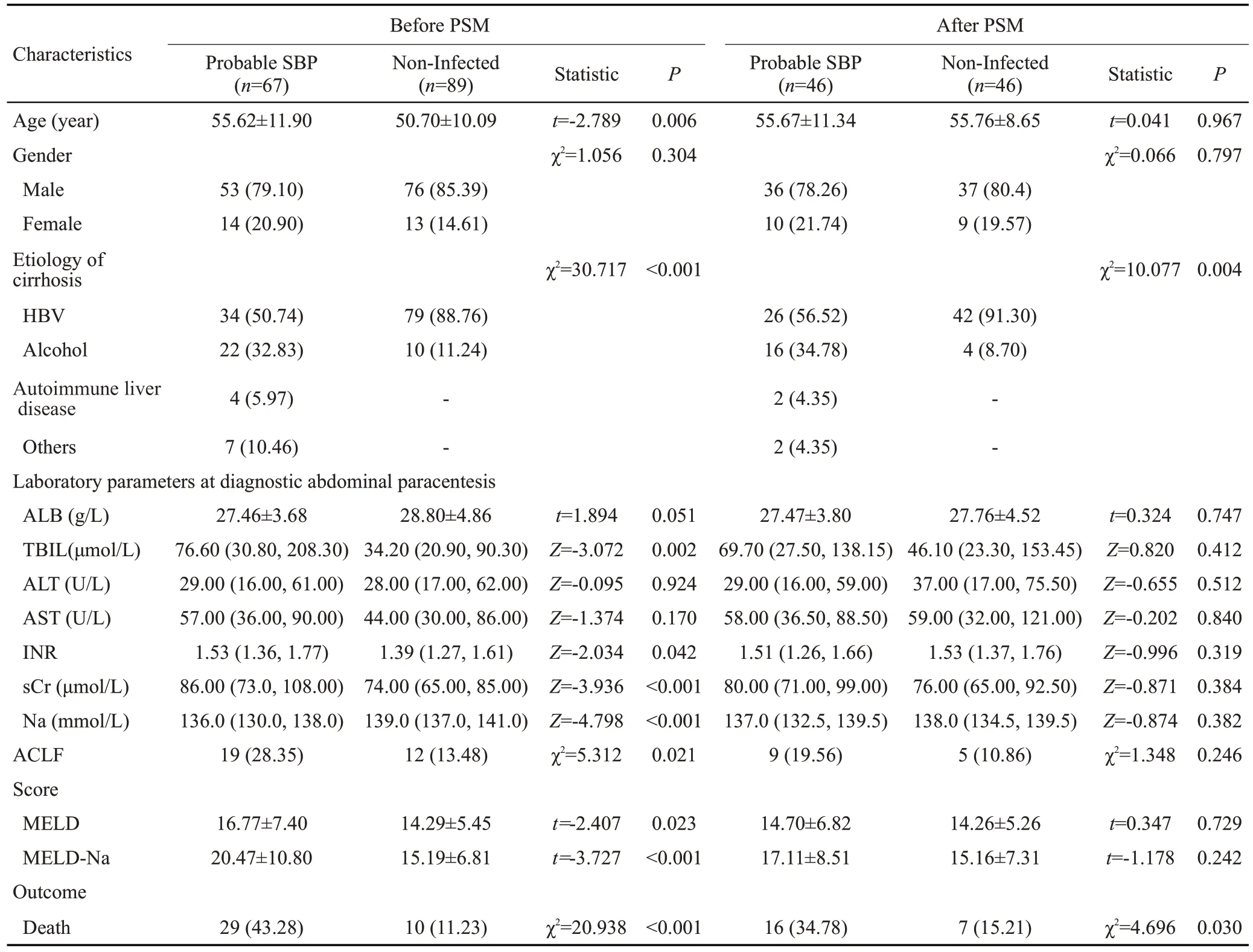
表3 可疑SBP患者与无感染患者PSM前后临床特征Tab.3 Clinical characteristics of probable SBP and non-infected ascites groups before and after propensity score matching.
对PSM前后两组患者生存情况进行分析,PSM前可疑SBP 组随访期间病死率显著高于无感染组(P<0.001,图3A);经PSM得到组间均衡可比的46对可疑SBP患者与无感染患者,可疑SBP组随访期间病死率仍高于无感染组(P=0.038,图3B),PSM前后结果一致。
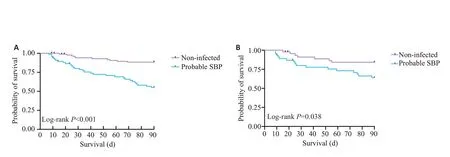
图3 可疑SBP组与无感染组总体生存曲线Fig.3 Survival curves for probable SBP and non-infected ascites groups before(A)and after(B)propensity score matching.
2.4 可疑SBP患者预后影响因素
比较可疑SBP 患者中生存组与死亡组临床特征(表4),结果显示,死亡组TBIL、INR、AST、NEU、ΔNEU、PCT水平及MELD评分显著高于生存组(P<0.05)。将上述在两组间差异具有统计学意义的连续变量及WBC、基线WBC、基线NEU 及ΔWBC 纳入Cox 比例风险模型进行分析(表5),单因素Cox分析结果显示,AST>64.00U/L、NEU>3.95×109/L、PCT>0.48 ng/mL及MELD评分>15是影响可疑SBP患者90 d预后的危险因素(P<0.05),将单因素分析中P<0.1的变量纳入Cox多因素分析,结果显示,PCT>0.48 ng/mL(HR=1.989,95%CI: 1.111~3.560,P=0.021)及MELD 评 分>15(HR=1.943,95%CI: 1.118~3.377,P=0.018)是可疑SBP患者90 d预后的独立预测因素。
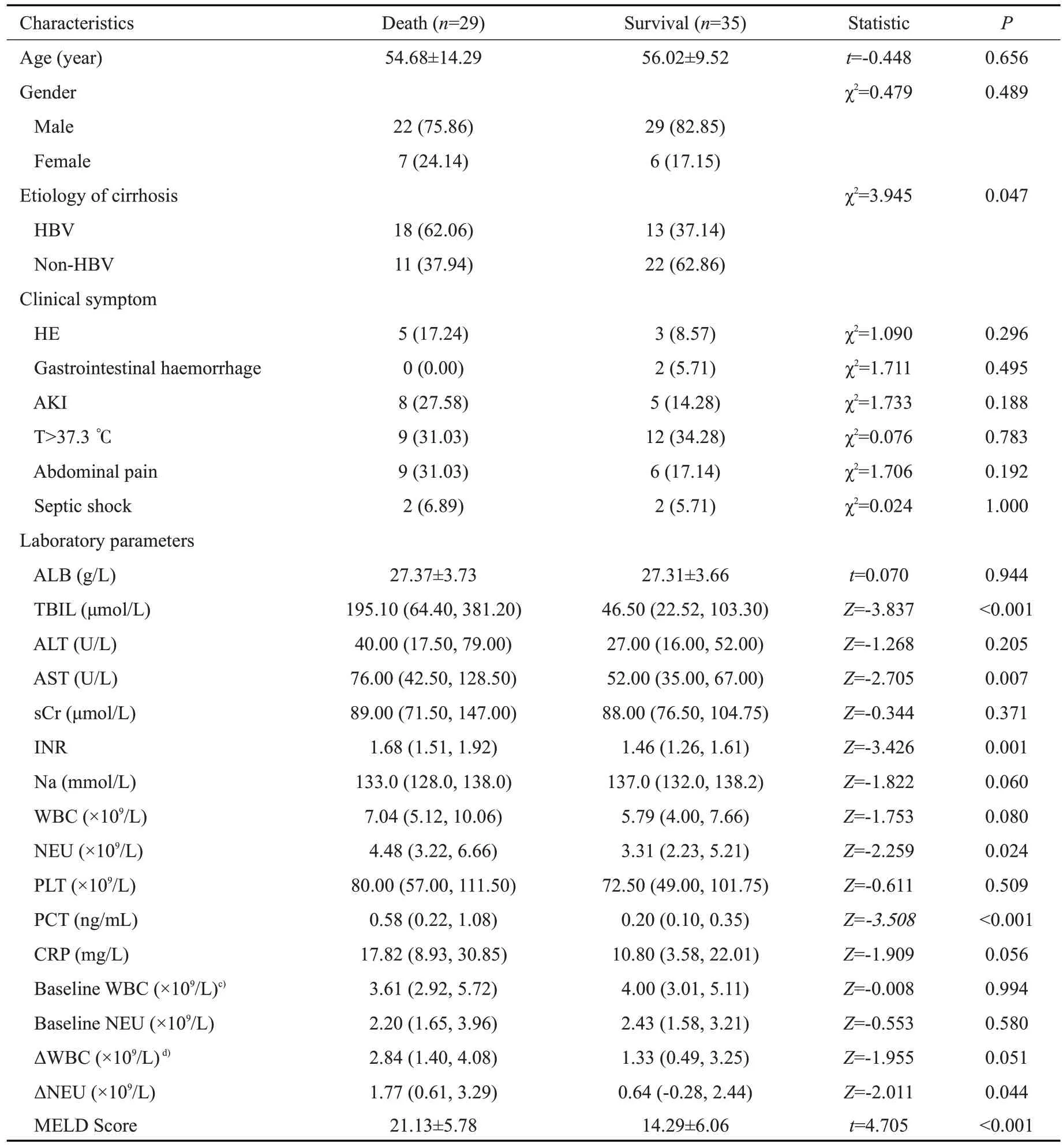
表4 可疑SBP组生存与死亡患者临床特征Tab.4 Clinical data of survivors and dead patients in probable SBP group
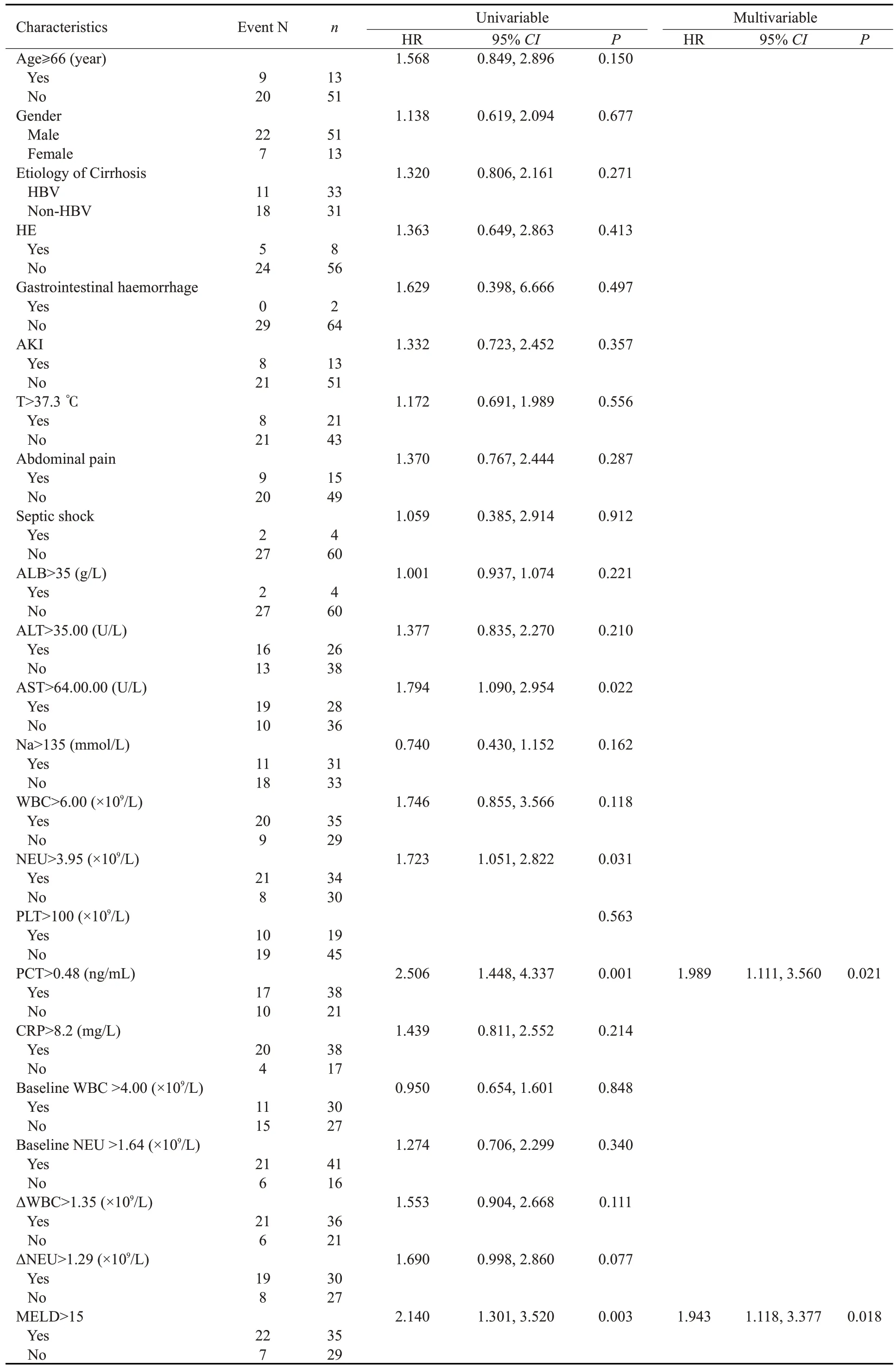
表5 可疑SBP患者Cox比例风险模型Tab.5 Cox proportional hazard model for probable SBP patients
3 讨论
目前研究普遍认为细菌易位(BT)是SBP的主要发病机制,由于小肠细菌过度生长、宿主免疫功能低下及肠道屏障功能受损,原本肠道里的活细菌及其产物(如细菌DNA等)转移到肠系膜淋巴结或身体其他部位,包括腹水及血液中,导致免疫系统过度激活,诱发炎症反应从而加重病情[14,15]。多项研究指出常规腹水细菌培养阴性,且PMN计数<250个/mm3的肝硬化患者腹水中同样能检测到细菌DNA,且腹水细菌DNA阳性患者较阴性患者预后不良[15-18]。因此,即使未明确诊断SBP,当患者出现可疑SBP表现时,同样提示可能存在BT,应予以重视。然而目前关于可疑SBP研究有限,为进一步加深对可疑SBP的认识,本研究纳入了323例肝硬化并腹水患者,发现在90 d随访期内,即使并未确诊SBP或BA,可疑SBP患者同样具有不可忽视的不良预后。与本研究结果一致,既往研究也发现可疑SBP 患者与SBP、BA患者预后相似[9]。此外,为提高研究结论的可信度,本研究在增加样本量的基础上采用PSM均衡各因素在可疑SBP组与无感染组之间的分布,使协变量在两组之间均衡可比,发现PSM后可疑SBP患者总体生存率仍然显著低于无感染患者,进一步验证了其不良预后。
目前临床实践中腹水PMN 计数≥250 个/mm3是SBP的主要诊断依据,但既往研究指出,由于SBP患者多存在大量腹水,导致腹水PMN计数不能达到诊断标准[19]。已有学者报道使用PMN计数≥250个/mm3作为SBP 诊断阈值会导致20%~40%患者漏诊,使用腹水PMN≥100个/mm3作为SBP诊断阈值可以减少漏诊[8,20],国外相关研究也指出PMN计数≥100个/mm3是后续发展为SBP的危险因素[21]。本研究可疑SBP组患者预后不良,PMN计数虽未达到SBP诊断标准,但显著高于BA及无感染组患者,与以上文献研究结果相互印证,提示当患者出现可疑SBP表现且PMN计数≥100个/mm3时应引起临床医师高度重视。
由于肝硬化患者普遍存在脾功能亢进,导致NEU破坏增加、释放减少以致NEU寿命缩短[22],故肝硬化患者外周血基线WBC、NEU值常低于正常值,“正常”范围的WBC计数可能已经是其基线值的2~3倍甚至更高。因此,在诊断肝硬化患者感染时,应该结合其基线值进行判断。本研究对可疑SBP组患者基线、行诊断性穿刺时WBC、NEU值进行了动态评估,发现可疑SBP组患者行诊断性腹腔穿刺时外周血WBC、NEU较其基线值均出现了显著升高,证实部分可疑SBP患者存在感染。由于正常参考值对于肝硬化患者感染的诊断参考价值有限,本研究通过绘制ROC曲线,采用约登指数最大法,计算得到最佳cut-off值,将WBC及NEU转化为二分类变量再后纳入Cox回归模型进行分析,Cox单因素分析显示外周血NEU>3.95×109/L是影响可疑SBP患者预后的危险因素,既往关于BA患者预后危险因素的研究也发现死亡组患者与生存组患者NEU存在显著差异[23],故应该重视外周血NEU计数在腹腔感染患者诊断以及预后评估方面的作用,并积极应用抗生素治疗。
作为一项常用的细菌感染标志物,PCT在临床上被广泛应用于辅助SBP的诊断。既往已经有多项研究证实了PCT辅助SBP诊断方面的价值[24-26],中华医学会肝病学分会2017年发布的肝硬化腹水及相关并发症的诊疗指南提出,PCT>0.5 ng/mL伴可疑腹膜炎表现即可诊断SBP[7]。除了诊断价值,既往多项研究也发现PCT对于肝硬化患者预后评估方面也存在一定价值[25,27]。本研究发现PCT>0.48 ng/mL为影响可疑SBP患者预后的危险因素,与上述研究相符,进一步印证了在PCT水平较高的可疑SBP患者中使用抗生素的必要性。
作为肝硬化患者常用预后评分模型,MELD评分越高,意味着预后越差。过去关于MELD评分在SBP以及BA患者的预后评估中的作用已经有较多的研究[28,29],但MELD评分在可疑SBP患者预后评估中的研究比较有限,本研究发现MELD评分对于可疑SBP患者预后也有着较好的预测效果,行诊断性腹腔穿刺时MELD评分>15的患者90 d预后不良,有利于识别高危患者,及时启动抗生素治疗,改善患者预后。
本研究尚存在一定的局限性。第一、由于本研究属于单中心回顾性研究,纳入患者数量有限,随访时间有限,因此未来需要增加样本量进行前瞻性、多中心、长随访周期的临床研究以增加结果的可信度。第二、由于样本量有限,导致Cox回归模型纳入变量有限,部分单因素分析具有统计学意义的变量无法进一步纳入模型。
综上所述,本研究发现,可疑SBP病情较重,TBIL、sCr 显著高于无感染组;感染指标如外周血及腹水WBC、NEU显著高于无感染组。预后不佳,其病死率与SBP、BA相近。可疑SBP是影响肝硬化腹水患者预后的重要危险因素之一。PCT及MELD评分升高是影响其预后的独立危险因素。因此应引起临床医师高度重视。

